原子核外电子排布的周期性[上学期]
图片预览




文档简介
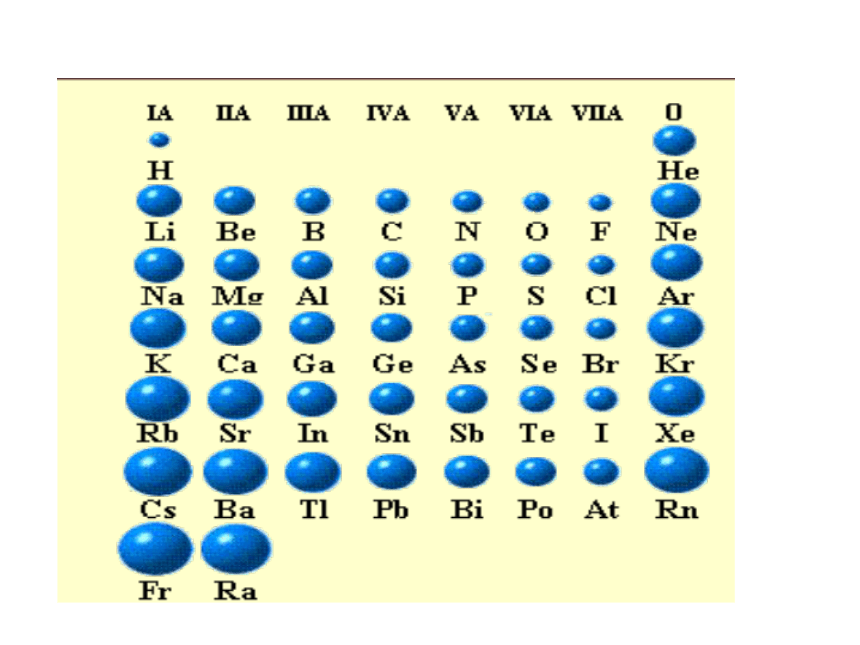
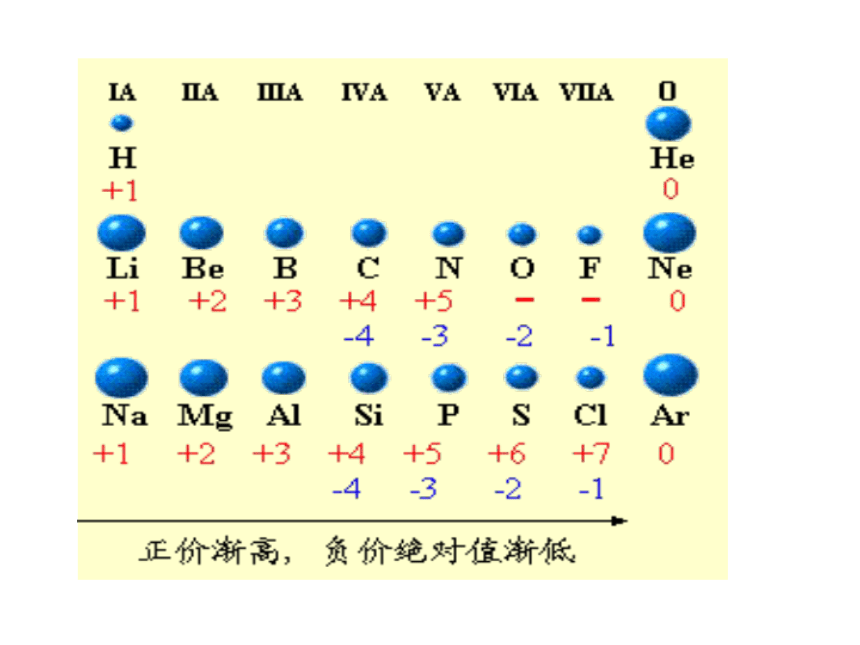
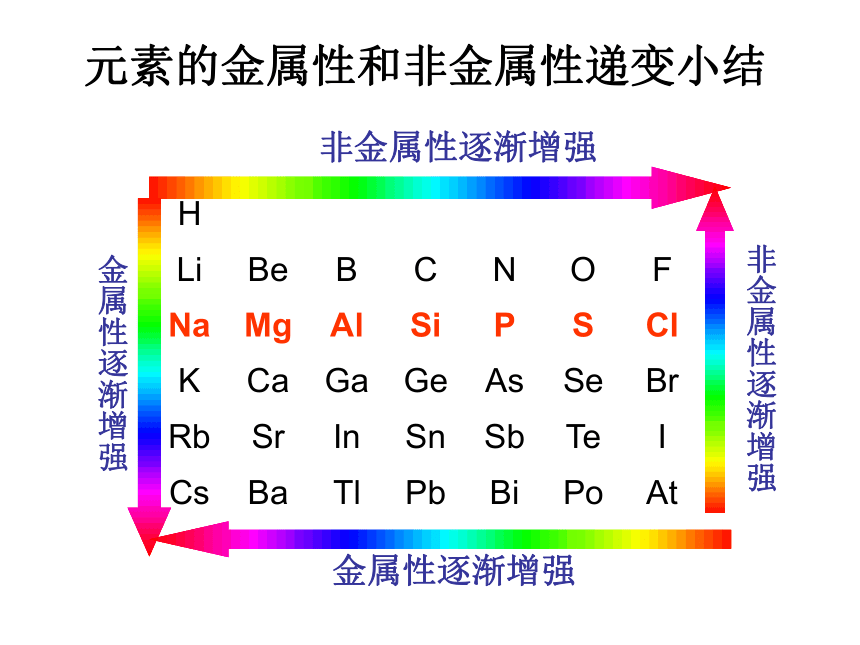
课件15张PPT。原子核外电子排布的周期性元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强原子结构和元素周期律
核外电子排布和周期表的关系
一、周期
如何根据核外电子分布确定元素在周期表中的周期数?
方法是:按填充顺序,写出元素原子的核外电子排布,最外电子层数,为该元素的周期数。
周期数=最外电子层数n
如:35Br [Ar]3d104s24p5 ;47Ag [Kr]4d105s1
各周期内所含的元素种数与相应能级组内轨道所能容纳的电子数相等。
二、元素周期表中元素的分区:
根据元素原子外围电子排布的特征,可以把周期表中的元素所在位置分成s.p.d.ds和f五个区。
s区元素(ns1-2):ⅠA,ⅡA族元素
P区元素(ns2np1-6):ⅢA──ⅦA族元素、零族元素
d区元素((n-1)d1-9 ns1-2):ⅢB──ⅦB族、Ⅷ族元素
ds区元素((n-1)d10 ns1-2):ⅠB,ⅡB族元素
f区元素(n-2)f1-14(n-1)d0-1ns2 :镧系和锕系元素s区元素:最后1个电子填充在ns轨道上,价层电子的构型是ns1或ns2,位于周期表的左侧,包括ⅠA和ⅡA族,除氢元素外,它们都是活泼金属,容易失去电子形成+1或+2价阳离子。p区元素:最后1个电子填充在np轨道上,价层电子构型是ns2np1~6,位于周期表右侧,包括ⅢA~ⅦA族元素。大部分为非金属。0族稀有气体也属于p区。
s区和p区的共同特点是:最后1个电子都排布在最外层,最外层电子的总数等于该元素的族数。s区和p区就是按族划分的周期表中的主族。d区元素:它们的价层电子构型是(n-1)d1~9ns1~2,最后1个电子基本都是填充在倒数的第二层(n-1)层d轨道上的元素,位于长周期的中部。这些元素都是金属,常有可变化的化合价,称为过渡元素。它包括ⅢB~Ⅷ族元素。ds区元素:价层电子构型是(n-1)d10ns1~2,
即次外层d轨道是充满的,最外层轨道上有1~2个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括ⅠB和ⅡB族,处于周期表d区和p区之间。它们都是金属,也属过渡元素。f区元素:(n-2)f 0~14ns2,
或(n-2 )f 0~14(n-1)d 0~2ns2,它包括镧系和锕系元素(各有14种元素),由于本区包括的元素较多,故常将其列于周期表之下。它们的最外层电子数目相同,次外层电子数目也大部分相同,只有外数第三层的电子数目不同,所以每个系内各元素的化学性质极为相似,都为金属,将它们称为内过渡元素。
(主族)(主族) (副族)
(过渡元素)三、族(主族、副族):
按传统习惯,周期系分为7个主族(A),7个副族(B)及第Ⅷ族,零族。
方法是:按电子填充顺序,最后一个电子进入的情况决定,有如下具体情况:属s区元素每一个能级组对应于周期表中的一个周期
周期数=最外电子层数n(2) 凡是最后一个电子填入ns或np轨道的都是
主族元素,其价电子的总数等于其族数。例: 元素 S ,原子序数16 核外电子排布:1s2 2s2 2p6 3s2 3p4
价电子为 3s2 3p4
或写作 [Ne] 3s2 3p4第三周期 ⅥA族小结:(3) 凡最后一个电子填入(n-1)d或(n-2)f轨道上的
元素都属于副族(过渡元素)。
ⅢB~ⅦB族元素,价电子(最外层和次外层
电子)总数等于其族数;
ⅠB和ⅡB族元素 ,最外层电子数等于族数例: Mn , 原子序数25, 核外电子排布: 1s2 2s22p6 3s23p6 3d54s2
或写成: [Ar] 3d5 4s2 Cd , 原子序数48,
核外电子排布:1s22s22p63s23p63d104s24p64d105s2
[Kr] 4d105s2第五周期 ⅡB族第四周期 ⅦB族
核外电子排布和周期表的关系
一、周期
如何根据核外电子分布确定元素在周期表中的周期数?
方法是:按填充顺序,写出元素原子的核外电子排布,最外电子层数,为该元素的周期数。
周期数=最外电子层数n
如:35Br [Ar]3d104s24p5 ;47Ag [Kr]4d105s1
各周期内所含的元素种数与相应能级组内轨道所能容纳的电子数相等。
二、元素周期表中元素的分区:
根据元素原子外围电子排布的特征,可以把周期表中的元素所在位置分成s.p.d.ds和f五个区。
s区元素(ns1-2):ⅠA,ⅡA族元素
P区元素(ns2np1-6):ⅢA──ⅦA族元素、零族元素
d区元素((n-1)d1-9 ns1-2):ⅢB──ⅦB族、Ⅷ族元素
ds区元素((n-1)d10 ns1-2):ⅠB,ⅡB族元素
f区元素(n-2)f1-14(n-1)d0-1ns2 :镧系和锕系元素s区元素:最后1个电子填充在ns轨道上,价层电子的构型是ns1或ns2,位于周期表的左侧,包括ⅠA和ⅡA族,除氢元素外,它们都是活泼金属,容易失去电子形成+1或+2价阳离子。p区元素:最后1个电子填充在np轨道上,价层电子构型是ns2np1~6,位于周期表右侧,包括ⅢA~ⅦA族元素。大部分为非金属。0族稀有气体也属于p区。
s区和p区的共同特点是:最后1个电子都排布在最外层,最外层电子的总数等于该元素的族数。s区和p区就是按族划分的周期表中的主族。d区元素:它们的价层电子构型是(n-1)d1~9ns1~2,最后1个电子基本都是填充在倒数的第二层(n-1)层d轨道上的元素,位于长周期的中部。这些元素都是金属,常有可变化的化合价,称为过渡元素。它包括ⅢB~Ⅷ族元素。ds区元素:价层电子构型是(n-1)d10ns1~2,
即次外层d轨道是充满的,最外层轨道上有1~2个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括ⅠB和ⅡB族,处于周期表d区和p区之间。它们都是金属,也属过渡元素。f区元素:(n-2)f 0~14ns2,
或(n-2 )f 0~14(n-1)d 0~2ns2,它包括镧系和锕系元素(各有14种元素),由于本区包括的元素较多,故常将其列于周期表之下。它们的最外层电子数目相同,次外层电子数目也大部分相同,只有外数第三层的电子数目不同,所以每个系内各元素的化学性质极为相似,都为金属,将它们称为内过渡元素。
(主族)(主族) (副族)
(过渡元素)三、族(主族、副族):
按传统习惯,周期系分为7个主族(A),7个副族(B)及第Ⅷ族,零族。
方法是:按电子填充顺序,最后一个电子进入的情况决定,有如下具体情况:属s区元素每一个能级组对应于周期表中的一个周期
周期数=最外电子层数n(2) 凡是最后一个电子填入ns或np轨道的都是
主族元素,其价电子的总数等于其族数。例: 元素 S ,原子序数16 核外电子排布:1s2 2s2 2p6 3s2 3p4
价电子为 3s2 3p4
或写作 [Ne] 3s2 3p4第三周期 ⅥA族小结:(3) 凡最后一个电子填入(n-1)d或(n-2)f轨道上的
元素都属于副族(过渡元素)。
ⅢB~ⅦB族元素,价电子(最外层和次外层
电子)总数等于其族数;
ⅠB和ⅡB族元素 ,最外层电子数等于族数例: Mn , 原子序数25, 核外电子排布: 1s2 2s22p6 3s23p6 3d54s2
或写成: [Ar] 3d5 4s2 Cd , 原子序数48,
核外电子排布:1s22s22p63s23p63d104s24p64d105s2
[Kr] 4d105s2第五周期 ⅡB族第四周期 ⅦB族
