分子的空间构型[上学期]
图片预览


文档简介
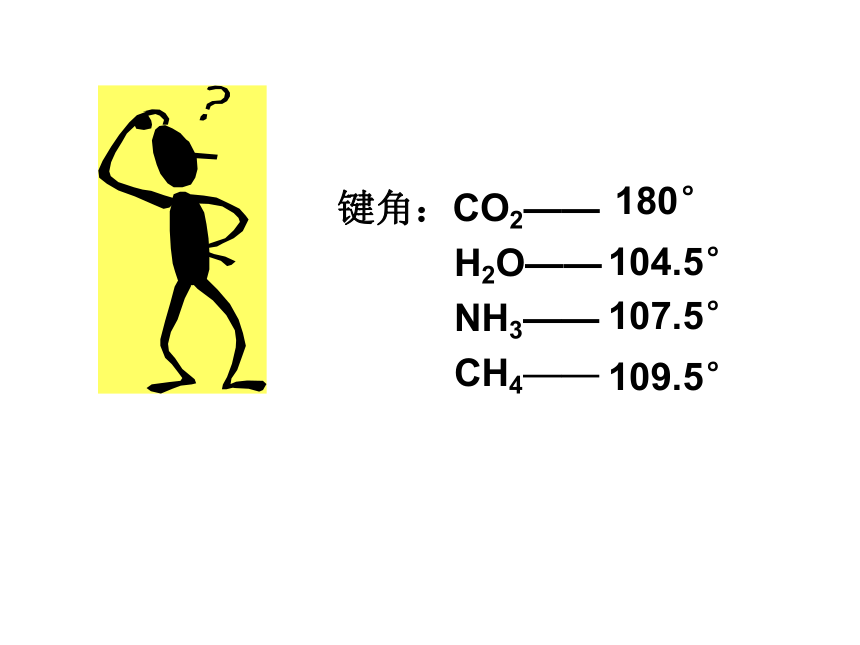
课件24张PPT。分子的空间构型键角:CO2——
H2O——
NH3——
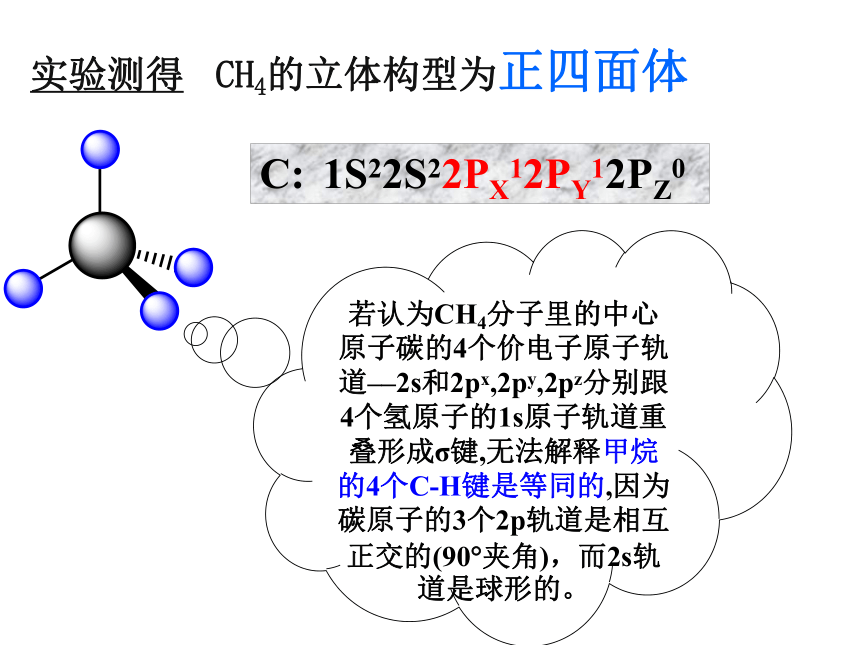
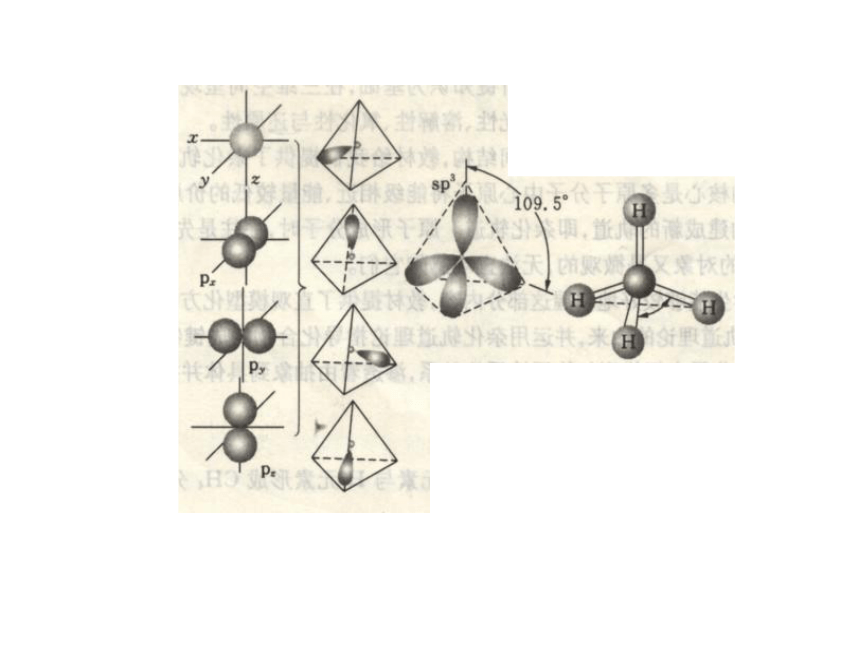
CH4——实验测得 CH4的立体构型为正四面体若认为CH4分子里的中心原子碳的4个价电子原子轨道––2s和2px,2py,2pz分别跟4个氢原子的1s原子轨道重叠形成σ键,无法解释甲烷的4个C-H键是等同的,因为碳原子的3个2p轨道是相互正交的(90?夹角),而2s轨道是球形的。C: 1S22S22PX12PY12PZ0一、杂化轨道理论
1.杂化的定义:
原子在相互结合成键形成分子时,由于原子间的相互作用,使同一原子中能量相近的不同类型原子轨道重新组合为一组新轨道.这种轨道重新组合的过程叫杂化。
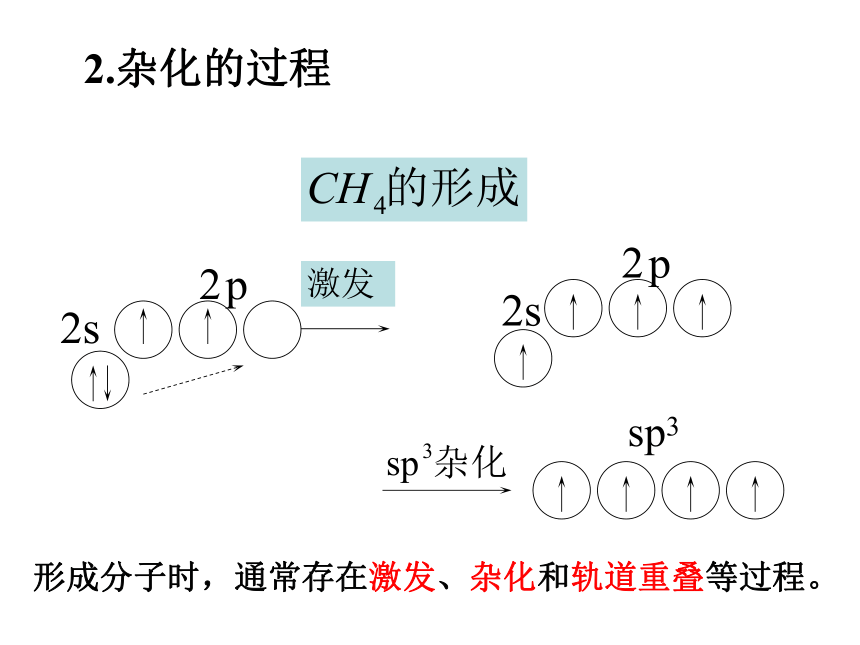
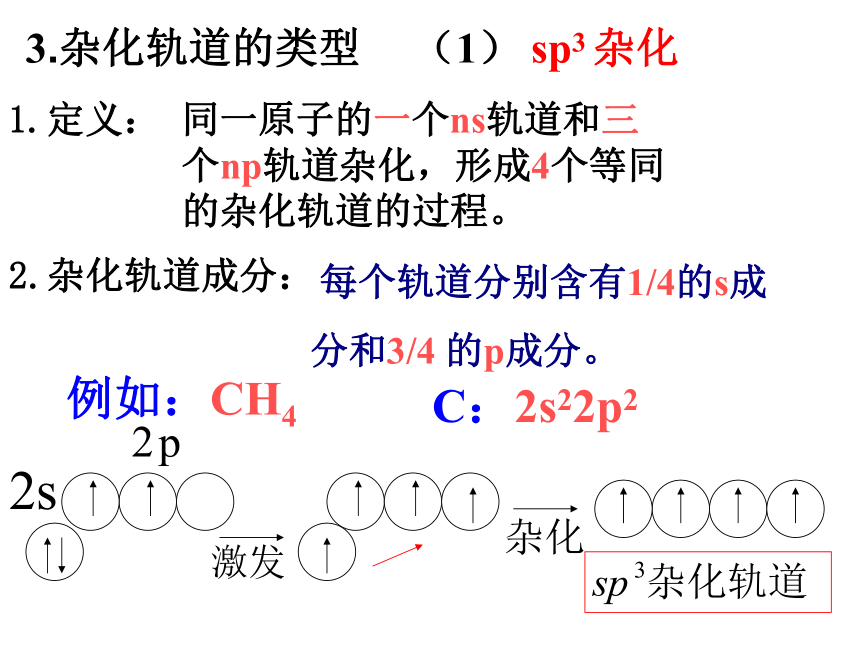
所形成的新轨道称为杂化轨道。2.杂化的过程形成分子时,通常存在激发、杂化和轨道重叠等过程。 1.定义: 同一原子的一个ns轨道和三
个np轨道杂化,形成4个等同
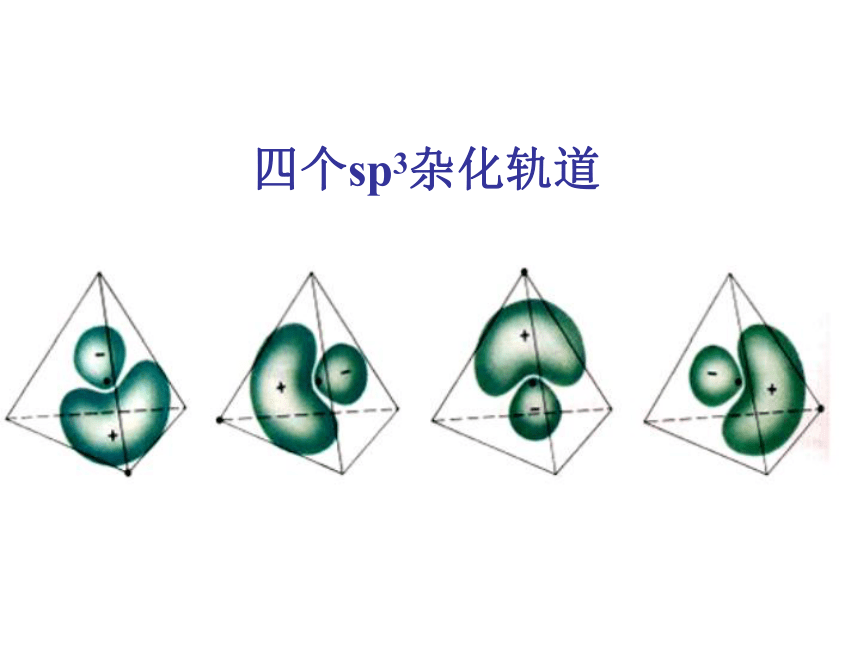
的杂化轨道的过程。 (1) sp3 杂化 例如:CH4 C:2s22p2 2.杂化轨道成分: 每个轨道分别含有1/4的s成
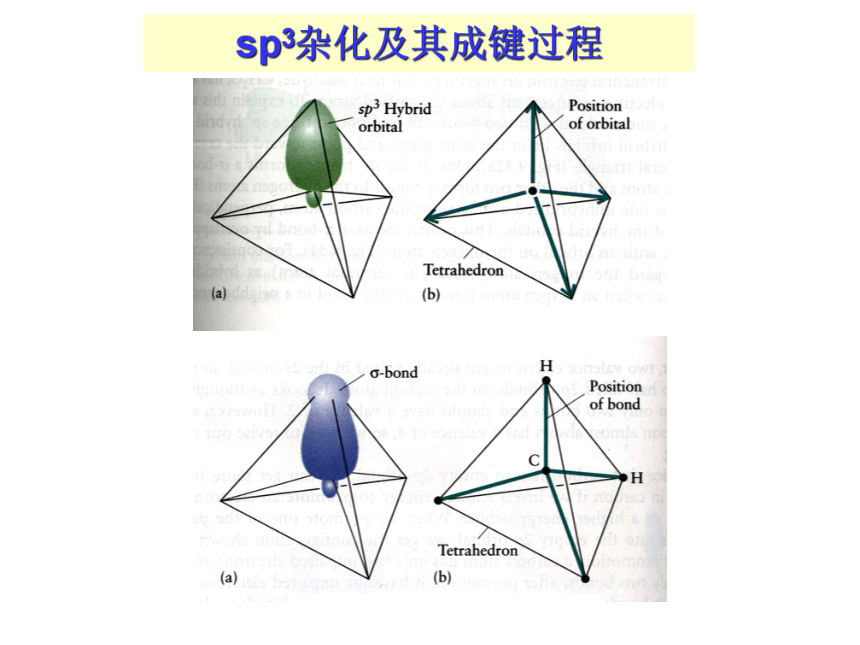
分和3/4 的p成分。 3.杂化轨道的类型四个sp3杂化轨道sp3杂化及其成键过程1. 定义: (2) sp2 杂化: 同一原子的一个ns轨道和二个
np轨道杂化形成3个等同的杂
化轨道的过程。 B:1s22s22p1 例如:BF3 每个轨道分别含有1/3的s成
分和2/3 的p成分。 2.杂化轨道成分: 1. 定义: 同一原子的一个ns轨道和一个
np轨道杂化形成2个等同的杂
化轨道的过程。 (3)sp杂化: 例如:BeF2 Be:1s22s2 2.杂化轨道成分:每个杂化轨道分别含有1/2的
s成分和1/2的p成分。 sp杂化轨道 :BeF2 的空间构型为直线型激发杂化1个s+1个p1个s+2个p1个s+3个p234180。120。109。28,直线型正三角型正四面体型BeF2BF3CH4sp2杂化:乙烯乙炔 甲烷、乙烯、乙炔的结构及sp3、sp2、sp 杂化碳原子的sp2杂化轨道和pz轨道二.杂化轨道的特点1.形成分子时,通常存在激发、杂化和轨道重叠等过程。
2.原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
3.杂化轨道的数目与参与杂化的轨道数目相同。
4.杂化后轨道伸展方向,形状发生改变。5.只有能量相近的轨道才能杂化(如:2s2p)
6.杂化轨道成键时要满足化学键间最小排斥原理 杂化轨道间的夹角→分子空间构型
7.杂化轨道的角度部分一头大,一头小,成键时利用大的一头,可以使轨道重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
8.杂化轨道所形成的化学键全部为σ键.
H2O——
NH3——
CH4——实验测得 CH4的立体构型为正四面体若认为CH4分子里的中心原子碳的4个价电子原子轨道––2s和2px,2py,2pz分别跟4个氢原子的1s原子轨道重叠形成σ键,无法解释甲烷的4个C-H键是等同的,因为碳原子的3个2p轨道是相互正交的(90?夹角),而2s轨道是球形的。C: 1S22S22PX12PY12PZ0一、杂化轨道理论
1.杂化的定义:
原子在相互结合成键形成分子时,由于原子间的相互作用,使同一原子中能量相近的不同类型原子轨道重新组合为一组新轨道.这种轨道重新组合的过程叫杂化。
所形成的新轨道称为杂化轨道。2.杂化的过程形成分子时,通常存在激发、杂化和轨道重叠等过程。 1.定义: 同一原子的一个ns轨道和三
个np轨道杂化,形成4个等同
的杂化轨道的过程。 (1) sp3 杂化 例如:CH4 C:2s22p2 2.杂化轨道成分: 每个轨道分别含有1/4的s成
分和3/4 的p成分。 3.杂化轨道的类型四个sp3杂化轨道sp3杂化及其成键过程1. 定义: (2) sp2 杂化: 同一原子的一个ns轨道和二个
np轨道杂化形成3个等同的杂
化轨道的过程。 B:1s22s22p1 例如:BF3 每个轨道分别含有1/3的s成
分和2/3 的p成分。 2.杂化轨道成分: 1. 定义: 同一原子的一个ns轨道和一个
np轨道杂化形成2个等同的杂
化轨道的过程。 (3)sp杂化: 例如:BeF2 Be:1s22s2 2.杂化轨道成分:每个杂化轨道分别含有1/2的
s成分和1/2的p成分。 sp杂化轨道 :BeF2 的空间构型为直线型激发杂化1个s+1个p1个s+2个p1个s+3个p234180。120。109。28,直线型正三角型正四面体型BeF2BF3CH4sp2杂化:乙烯乙炔 甲烷、乙烯、乙炔的结构及sp3、sp2、sp 杂化碳原子的sp2杂化轨道和pz轨道二.杂化轨道的特点1.形成分子时,通常存在激发、杂化和轨道重叠等过程。
2.原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
3.杂化轨道的数目与参与杂化的轨道数目相同。
4.杂化后轨道伸展方向,形状发生改变。5.只有能量相近的轨道才能杂化(如:2s2p)
6.杂化轨道成键时要满足化学键间最小排斥原理 杂化轨道间的夹角→分子空间构型
7.杂化轨道的角度部分一头大,一头小,成键时利用大的一头,可以使轨道重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
8.杂化轨道所形成的化学键全部为σ键.
