原子核外电子排布的周期性[上学期]
图片预览





文档简介
课件22张PPT。元素性质的递变规律物质结构与性质
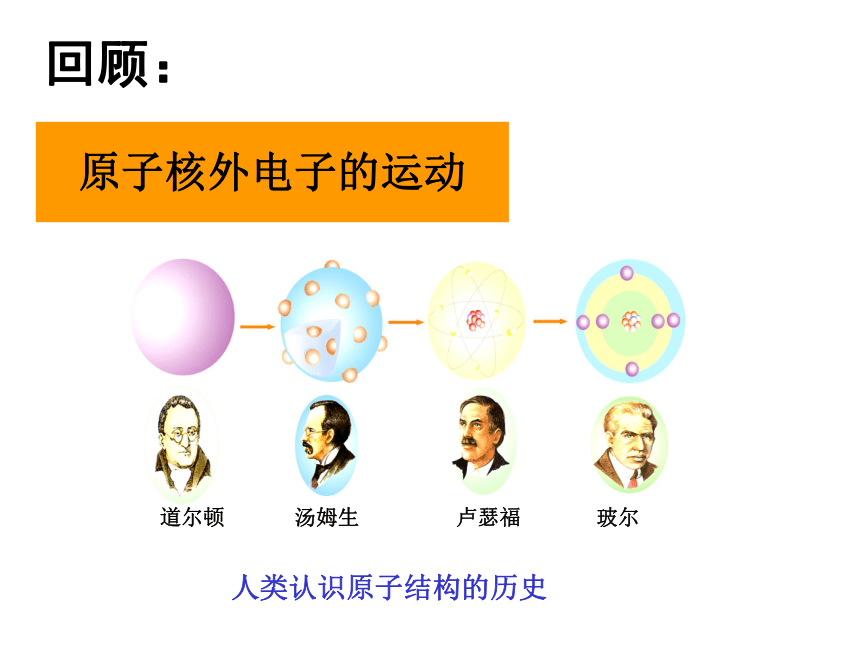
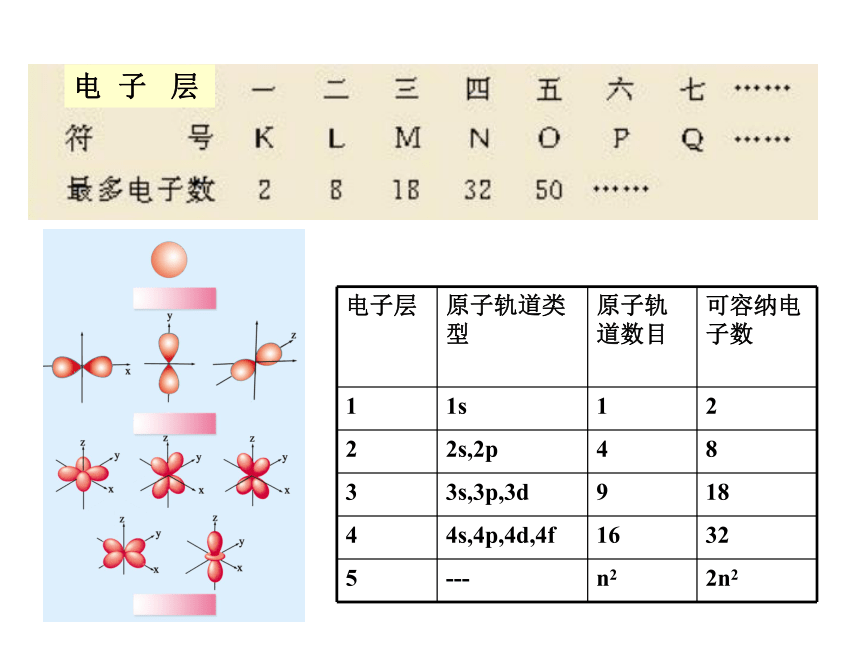
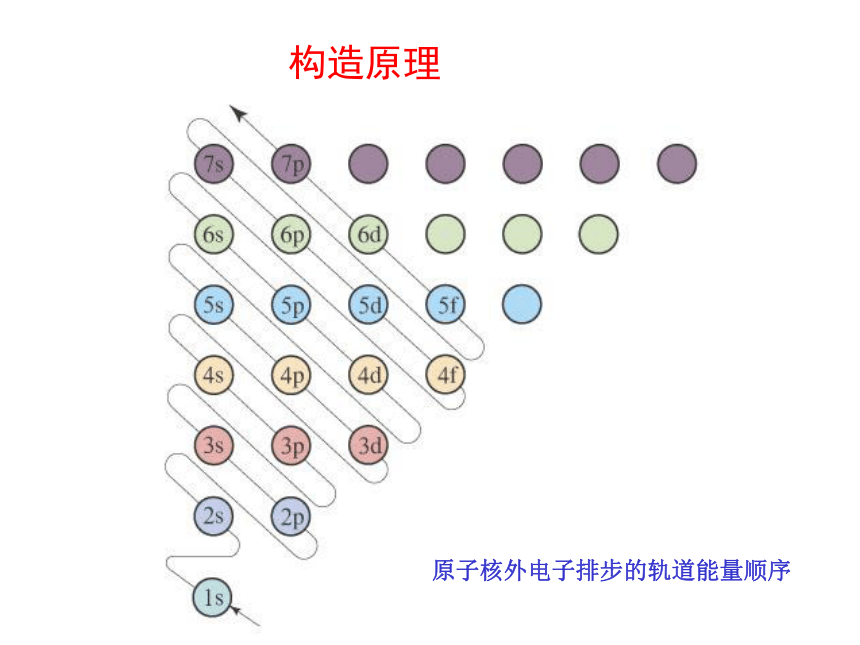
专题二 第二单元:原子核外电子排布的周期性道尔顿 汤姆生 卢瑟福 玻尔人类认识原子结构的历史原子核外电子的运动回顾:电 子 层构造原理原子核外电子排步的轨道能量顺序原子核外电子的排布所遵循的原理:1、能量最低原理
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同 对于能量相同的轨道(同一电子亚层),当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。 洪特规则的特例:练习:写出下列元素的电子排布式:
Na
K
Rb
Cs
Cr
Cu 1s22s2p63s1
1s22s2p63s23p64s1
1s22s2p63s23p63d104s24p65s1
1s22s2p63s23p63d104s24p64d105s25p66s1
或 [Xe]6s1
1s22s2p63s23p63d54s1
1s22s2p63s23p63d104s1回顾
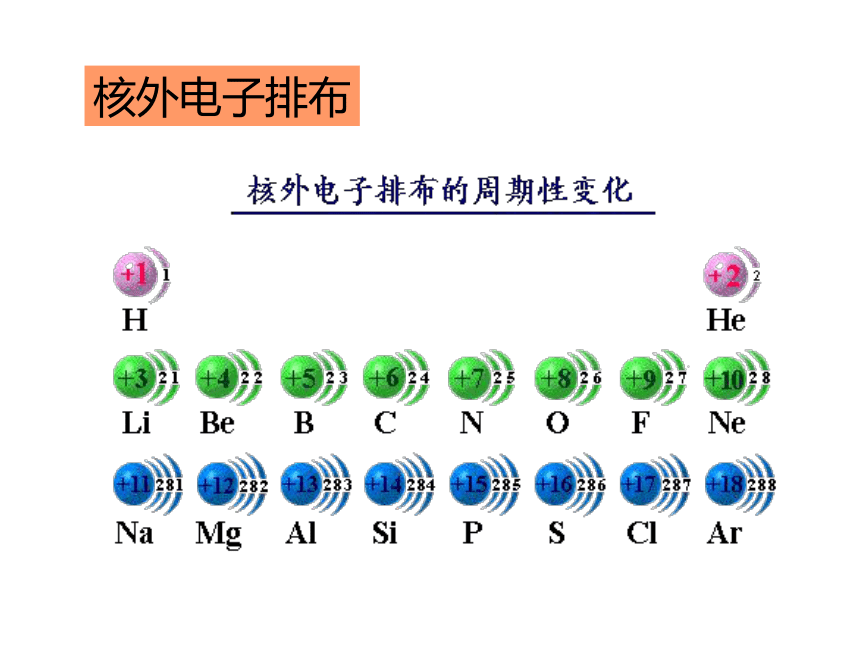
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价
呈现周期性变化核外电子排布原子半径原子的最外层电子排布元素化合价元素主要化合价的周期性变化元素周期表 元素周期律的具体表现形式编排原则: ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行(周期) ⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。(族)周
期
表7个周期(三短、三长、一不完全)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)Ⅷ族(3个纵行):Fe、Co、Ni等
9种元素零族:稀有气体元素Na
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙1234Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪A:主族B:副族Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)金 属 性最 强同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强逐渐增大相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱金属与非金属分界线附近的元素既表现出一定的金属性也表现出一定的非金属性。周期序数等于主族序数的元素具有两性.
Al(OH)3+H+ = Al(OH)3+OH- = .Al 2O3+H+ = Al 2O3 +OH- = .元素分区图
专题二 第二单元:原子核外电子排布的周期性道尔顿 汤姆生 卢瑟福 玻尔人类认识原子结构的历史原子核外电子的运动回顾:电 子 层构造原理原子核外电子排步的轨道能量顺序原子核外电子的排布所遵循的原理:1、能量最低原理
电子先占据能量低的轨道,再依次进入能量高的轨道2、泡利不相容原理
每个轨道最多容纳两个自旋状态不同的电子3、洪特规则
在能量相同的轨道上排布时,电子尽可能分占不同的轨
道,且自旋状态相同 对于能量相同的轨道(同一电子亚层),当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。 洪特规则的特例:练习:写出下列元素的电子排布式:
Na
K
Rb
Cs
Cr
Cu 1s22s2p63s1
1s22s2p63s23p64s1
1s22s2p63s23p63d104s24p65s1
1s22s2p63s23p63d104s24p64d105s25p66s1
或 [Xe]6s1
1s22s2p63s23p63d54s1
1s22s2p63s23p63d104s1回顾
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价
呈现周期性变化核外电子排布原子半径原子的最外层电子排布元素化合价元素主要化合价的周期性变化元素周期表 元素周期律的具体表现形式编排原则: ⑴ 按原子序数的递增顺序从左到右排列 ⑵ 将电子层数相同的元素排列成一个横行(周期) ⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。(族)周
期
表7个周期(三短、三长、一不完全)7个副族:仅由长周期构成的族
(ⅠB~ⅦB)Ⅷ族(3个纵行):Fe、Co、Ni等
9种元素零族:稀有气体元素Na
11钠H
1氢He
2氦Li
3锂Be
4铍B
5硼C
6碳N
7氮O
8氧F
9氟Ne
10氖Mg
12镁Al
13铝Si
14硅P
15磷S
16硫Cl
17氯Ar
18氩K
19钾Ca
20钙1234Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪A:主族B:副族Ga
31镓Ge
32锗As
33砷Se
34硒Br
35溴Kr
36氪元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)金 属 性最 强同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强逐渐增大相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱金属与非金属分界线附近的元素既表现出一定的金属性也表现出一定的非金属性。周期序数等于主族序数的元素具有两性.
Al(OH)3+H+ = Al(OH)3+OH- = .Al 2O3+H+ = Al 2O3 +OH- = .元素分区图
