配合物的结构和性质[上学期]
图片预览


文档简介
课件9张PPT。专题4:分子空间结构与物质性质第二单元 配合物是如何形成的配合物的结构和性质1、配合物的价键理论理论要点:
(1) 中心离子或原子(M):有空轨道
配体(L):有孤电子对
二者形成配位键M?L
(2) 中心离子或原子采用杂化轨道成键.
(3) 杂化方式与空间构型有关
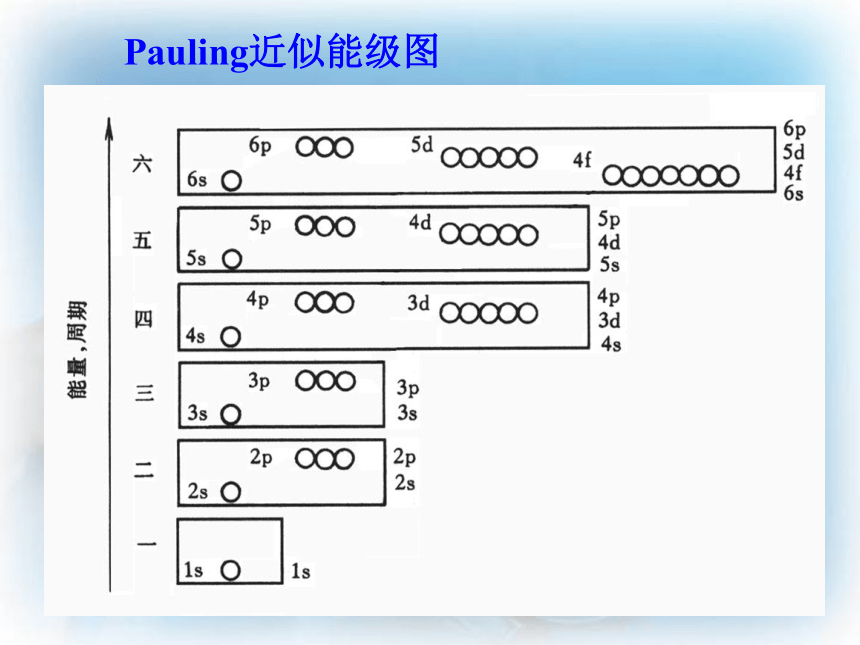
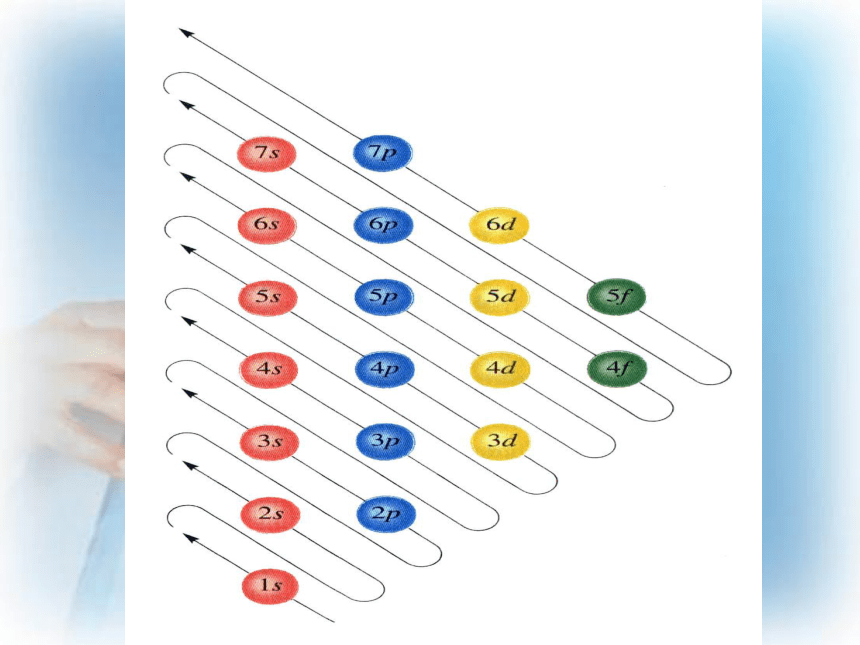
Pauling近似能级图原子中电子排布原理:(两个原理一个规则):
(1)、泡利(Pauli)不相容原理
在同一原子中,每一个轨道内最多只能容纳两个自旋方向相 反的电子。
(2)、能量最低原理
多电子原子处于基态时,核外电子的分布在不违反泡利原理前提下,总是尽先分布在能量较低的轨道,以使原子处于能量最低状态。
(3)、洪特(Hund)规则
原子在同一能层的等价轨道上分布电子时,尽可能单独分布在不同的轨道,而且自旋方向相同(或称自旋平行)。这种分布时,原子的能量较低,体系稳定。如N原子1s22s22p3的轨道表示式[Ag(NH3)2] + [Zn(NH3)4] 2+ [Ni(CN)4] 2- [AlF6] 3-2、配合物的异构现象顺式反式3、配合物的性质颜色
极性
溶解性
稳定性
(1) 中心离子或原子(M):有空轨道
配体(L):有孤电子对
二者形成配位键M?L
(2) 中心离子或原子采用杂化轨道成键.
(3) 杂化方式与空间构型有关
Pauling近似能级图原子中电子排布原理:(两个原理一个规则):
(1)、泡利(Pauli)不相容原理
在同一原子中,每一个轨道内最多只能容纳两个自旋方向相 反的电子。
(2)、能量最低原理
多电子原子处于基态时,核外电子的分布在不违反泡利原理前提下,总是尽先分布在能量较低的轨道,以使原子处于能量最低状态。
(3)、洪特(Hund)规则
原子在同一能层的等价轨道上分布电子时,尽可能单独分布在不同的轨道,而且自旋方向相同(或称自旋平行)。这种分布时,原子的能量较低,体系稳定。如N原子1s22s22p3的轨道表示式[Ag(NH3)2] + [Zn(NH3)4] 2+ [Ni(CN)4] 2- [AlF6] 3-2、配合物的异构现象顺式反式3、配合物的性质颜色
极性
溶解性
稳定性
