合金1[上学期]
图片预览











文档简介
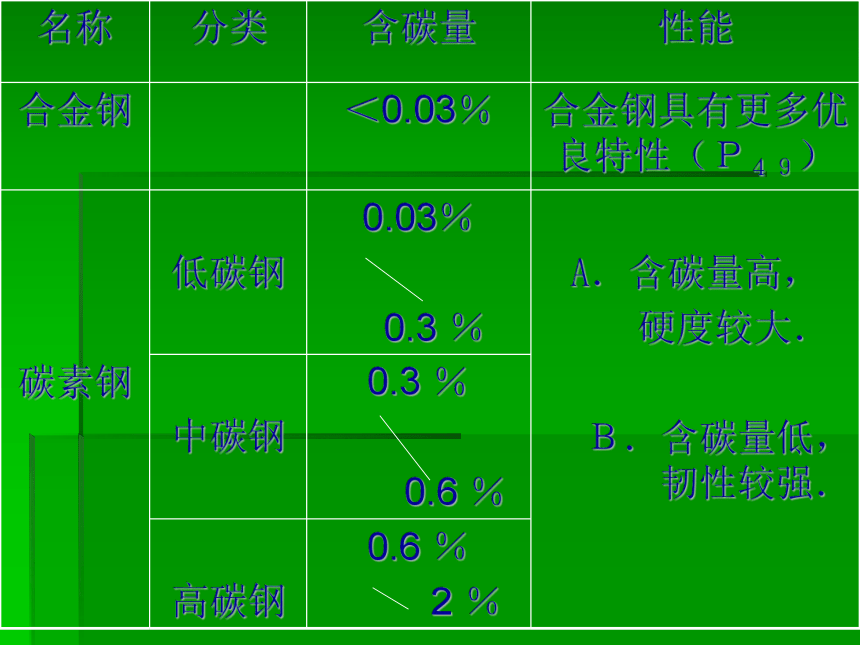
课件32张PPT。 生活中的金属制品合 金1.定义(P48): 由两种金属或两种以上金属(或金属与非金属)熔合而成的具有金属特性的物质叫做合金。2.合金的一般特点:
1.熔点比各成分金属的低。
2.强度、硬度比各成分合金的大。
3.导电性能比各成分金属的都差。
4.一般抗腐蚀性能强。
5.合金具有良好的物理、化学和机械的性能一.认识合金二.使用合金1.铁合金第四周期
第VIII族 还原性
金属性 Fe1423、铁的物理性质:1.银白色,有金属光泽,质软;2.具有良好的延展性;3.是电和热的良导体;5.特性:能被磁体吸引,具铁磁性.4、铁的化学性质:3、与酸反应:4、与水反应:常温下通常不与水反应高温时可以反应,方程式:[练习:]
在烧制砖瓦时,用粘土做成的坯
经过焙烧后,铁的化合物转化成
------而制得红色砖瓦;若烘热后
期从窑顶向下慢慢浇水,窑内会
产生大量的--------气体,它们把该
红色物质还原成黑色的化合物是
---------,同时还原未烧的碳得青
色砖瓦。CO、H2Fe2O3FeO、Fe3O4铁 红磁性氧化铁黑色 粉末红棕色粉末黑色晶体碱 性 氧 化 物5、铁的氧化物:[思考:]若将溶液滴到溶液中有什么现象?若滴加到溶液中呢?请同学们写出相应的化学方程式。6、铁的氢氧化物:Fe(OH)2Fe(OH)3 碱 碱Fe2+ +2OH- == Fe(OH)2Fe3++ 3OH- == Fe(OH)3 白色沉淀 红棕色沉淀 白色固体 红棕色固体 不溶于水 不溶于水Fe(OH)2+2H+= Fe2+ + 2H2O Fe(OH)3+3H+==Fe3++3H2O 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3白色沉淀 灰绿色 红棕色沉淀练习2:在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+分析:解此题要掌握单质铁有还原性能和Cu2+、H+、Fe3+反应.另外,铁能被磁铁吸引是铁的一种重要物理性质.现在Fe单质有剩余则Cu2+、H+、Fe3+分别被还原为H2、Cu、Fe2+故溶液中Fe2+最多,答案为C.C第二课时练 习:有一黄色固体A,经燃烧得红色粉末B和使
溴水褪色的气体,将 B 溶于盐酸得溶液C,
将C分成两份,其中一份加入NaOH溶液后
得红褐色沉淀D;向另一份中加入足量铁粉
得溶液E,将E也分成两份:一份中加入
NaOH溶液得白色沉淀F,F在空气中经一
系列变化最终变为D;另一份中加入氯水又
生成含C的溶液。则
A. B.CD.E.F. 直 接 观 色与KSCN与苯 酚显色反应
利 用与 铜 片与 淀 粉
KI 试 纸鉴 别方 法小结: 浅 绿 色 棕 黄 色血 红 色不显红色不显紫色 显 紫 色无明显现象 Cu被腐蚀
溶液变绿色试纸不变蓝 试纸变蓝色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红褐
色沉淀铁 三 角Fe3+Fe2+ FeⅠ、Fe Fe2+FeS Fe2++ Cu1、Fe Fe2+铁与较弱的氧化剂反应
如:S、Cu2+、非氧化性酸(H+)Fe + Cu2+==Fe + 2H+==Fe2+与具有还原性的物质反应时
可还原成铁,其在炼钢中尤为突出,
如:C、CO、Si、Al、Mn等。2Fe + SiO2Fe + CO22、Fe2+ Fe +3价铁的化合物与H2、Al、
C、CO等还原剂反应均可还
原成铁,如:2、Fe3+ Fe铝热反应:1、Fe2+ Fe3+Ⅲ、 Fe2+ Fe3+ Fe2+具有还原性,当遇到强氧化
剂时如:O2、Cl2、Br2、KMnO4、
HNO3、浓H2SO4、HClO、K2Cr2O7
等均可生成+3价铁。
2FeCl2 + Cl2==
2FeBr2 + Br2==
4Fe(OH)2 + O2 + 2H2O==2FeCl32FeBr34 Fe(OH)3 当Fe3+ 遇到强还原剂,如:Fe、
Cu、S2-(H2S)、SO32-、I-(HI)
等,均可将它还原成Fe2+,如:2、Fe3+ Fe2+ 总结:氧化性
还原性还原性氧化性 铁 三 角二、铝合金和铜合金1.Al是密度较小熔点较低硬度较小的银白色
金属 .其主要用途有:
延展性 制作铝线、铝箔、容器
1.熔点比各成分金属的低。
2.强度、硬度比各成分合金的大。
3.导电性能比各成分金属的都差。
4.一般抗腐蚀性能强。
5.合金具有良好的物理、化学和机械的性能一.认识合金二.使用合金1.铁合金第四周期
第VIII族 还原性
金属性 Fe1423、铁的物理性质:1.银白色,有金属光泽,质软;2.具有良好的延展性;3.是电和热的良导体;5.特性:能被磁体吸引,具铁磁性.4、铁的化学性质:3、与酸反应:4、与水反应:常温下通常不与水反应高温时可以反应,方程式:[练习:]
在烧制砖瓦时,用粘土做成的坯
经过焙烧后,铁的化合物转化成
------而制得红色砖瓦;若烘热后
期从窑顶向下慢慢浇水,窑内会
产生大量的--------气体,它们把该
红色物质还原成黑色的化合物是
---------,同时还原未烧的碳得青
色砖瓦。CO、H2Fe2O3FeO、Fe3O4铁 红磁性氧化铁黑色 粉末红棕色粉末黑色晶体碱 性 氧 化 物5、铁的氧化物:[思考:]若将溶液滴到溶液中有什么现象?若滴加到溶液中呢?请同学们写出相应的化学方程式。6、铁的氢氧化物:Fe(OH)2Fe(OH)3 碱 碱Fe2+ +2OH- == Fe(OH)2Fe3++ 3OH- == Fe(OH)3 白色沉淀 红棕色沉淀 白色固体 红棕色固体 不溶于水 不溶于水Fe(OH)2+2H+= Fe2+ + 2H2O Fe(OH)3+3H+==Fe3++3H2O 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3白色沉淀 灰绿色 红棕色沉淀练习2:在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+分析:解此题要掌握单质铁有还原性能和Cu2+、H+、Fe3+反应.另外,铁能被磁铁吸引是铁的一种重要物理性质.现在Fe单质有剩余则Cu2+、H+、Fe3+分别被还原为H2、Cu、Fe2+故溶液中Fe2+最多,答案为C.C第二课时练 习:有一黄色固体A,经燃烧得红色粉末B和使
溴水褪色的气体,将 B 溶于盐酸得溶液C,
将C分成两份,其中一份加入NaOH溶液后
得红褐色沉淀D;向另一份中加入足量铁粉
得溶液E,将E也分成两份:一份中加入
NaOH溶液得白色沉淀F,F在空气中经一
系列变化最终变为D;另一份中加入氯水又
生成含C的溶液。则
A. B.CD.E.F. 直 接 观 色与KSCN与苯 酚显色反应
利 用与 铜 片与 淀 粉
KI 试 纸鉴 别方 法小结: 浅 绿 色 棕 黄 色血 红 色不显红色不显紫色 显 紫 色无明显现象 Cu被腐蚀
溶液变绿色试纸不变蓝 试纸变蓝色白色沉淀迅速变灰
绿色最后呈红褐色立即产生红褐
色沉淀铁 三 角Fe3+Fe2+ FeⅠ、Fe Fe2+FeS Fe2++ Cu1、Fe Fe2+铁与较弱的氧化剂反应
如:S、Cu2+、非氧化性酸(H+)Fe + Cu2+==Fe + 2H+==Fe2+与具有还原性的物质反应时
可还原成铁,其在炼钢中尤为突出,
如:C、CO、Si、Al、Mn等。2Fe + SiO2Fe + CO22、Fe2+ Fe +3价铁的化合物与H2、Al、
C、CO等还原剂反应均可还
原成铁,如:2、Fe3+ Fe铝热反应:1、Fe2+ Fe3+Ⅲ、 Fe2+ Fe3+ Fe2+具有还原性,当遇到强氧化
剂时如:O2、Cl2、Br2、KMnO4、
HNO3、浓H2SO4、HClO、K2Cr2O7
等均可生成+3价铁。
2FeCl2 + Cl2==
2FeBr2 + Br2==
4Fe(OH)2 + O2 + 2H2O==2FeCl32FeBr34 Fe(OH)3 当Fe3+ 遇到强还原剂,如:Fe、
Cu、S2-(H2S)、SO32-、I-(HI)
等,均可将它还原成Fe2+,如:2、Fe3+ Fe2+ 总结:氧化性
还原性还原性氧化性 铁 三 角二、铝合金和铜合金1.Al是密度较小熔点较低硬度较小的银白色
金属 .其主要用途有:
延展性 制作铝线、铝箔、容器
