走进化学科学[上学期]
图片预览







文档简介
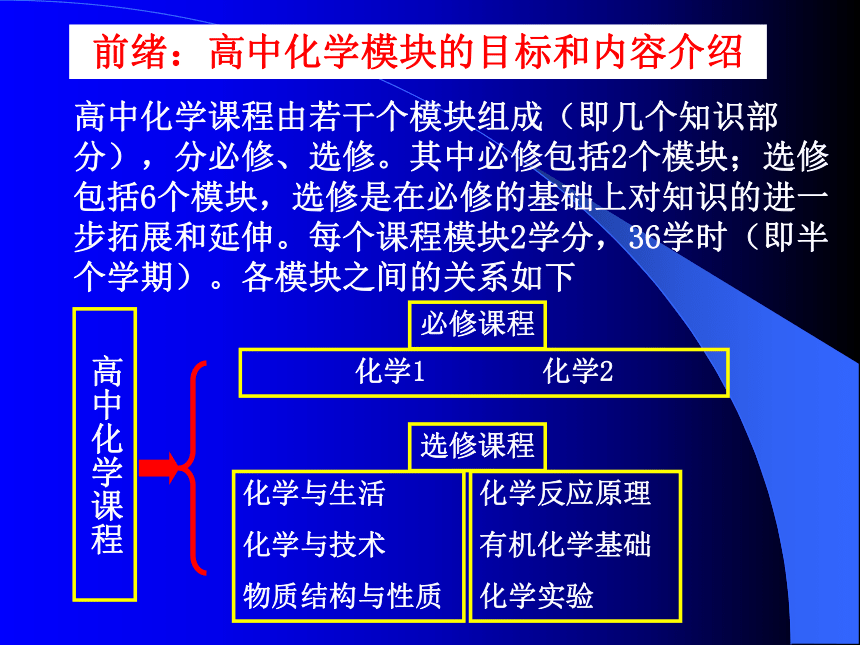
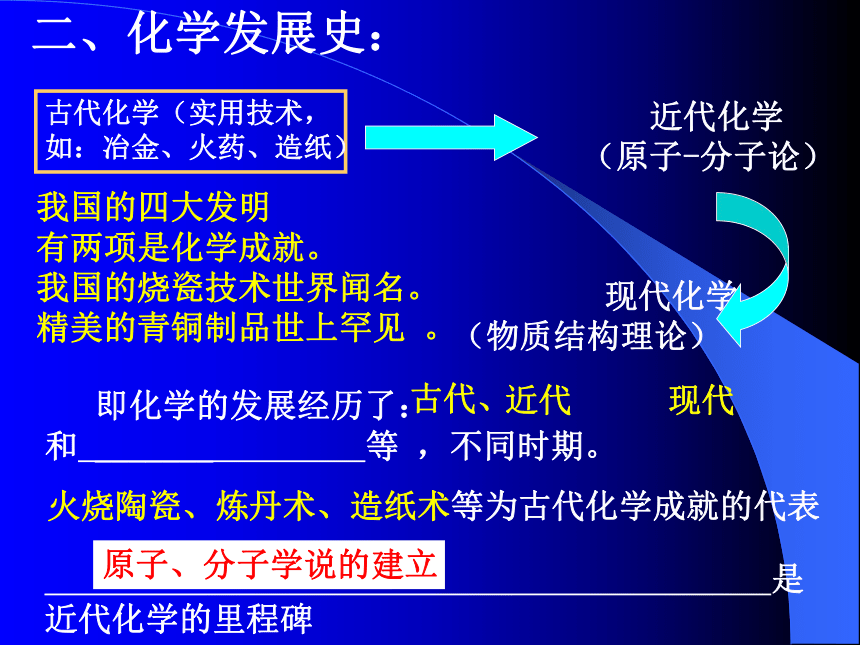
课件25张PPT。高中化学1(必修)第一章认识化学科学前绪:高中化学模块的目标和内容介绍高中化学课程由若干个模块组成(即几个知识部分),分必修、选修。其中必修包括2个模块;选修包括6个模块,选修是在必修的基础上对知识的进一步拓展和延伸。每个课程模块2学分,36学时(即半个学期)。各模块之间的关系如下高中化学课程化学1,化学2 :要求认识常见的化学物质,学习重要的化学概念,形成基本的化学观念和科学探究能力,认识化学对人类生活和社会发展的重要作用及其相互影响,进一步提高学生的科学素养。高中化学对学生的学习要求:学生在高中阶段必须修完6学分,即在学完化学1、化学2之后,再从选修的6个模块中,选修一个模块,并获得2学分,从而达到高中化学课程的毕业要求。有理工专业发展倾向的学生,应该至少修至8学分;将来准备报化学专业的学生,应该修至12学分以上。化学1、化学2的内容是高校招生的考试内容的最基础部分。普通学校招生对不同专业的考生,针对化学内容有不同的要求;报考人文学科或社会科学专业的学生,不超过3个模块;报考理工类专业的学生,不超过4个模块;报考化学及其相关专业的考生,最多不超过6个模块。第一章第1节 走进化学科学一、化学是干什么的?研究对象是什么? 化学是研究物质的组成、结构、性质、变化、制法、存在、用途等方面内容的科学。化学科学具有创造性和实用性。他研究的对象是各种各样的物质。二、化学发展史:古代化学(实用技术,如:冶金、火药、造纸) 近代化学
(原子-分子论) 现代化学
(物质结构理论)我国的四大发明
有两项是化学成就。
我国的烧瓷技术世界闻名。
精美的青铜制品世上罕见 。 即化学的发展经历了: 和 _______ 等 ,不同时期。古代、近代现代火烧陶瓷、炼丹术、造纸术等为古代化学成就的代表 是近代化学的里程碑原子、分子学说的建立波尔第一个提出了元素的概念质量守恒定律由罗蒙诺索夫(1748年)建立分子论的第一个提出人:阿伏加德罗原子论的第一个提出人:道尔顿(1808)元素周期论的第一个提出人:门捷列夫(1869)一般认为:原子论的建立是近代化学的开始,因此认为道尔顿是近代化学的创始人1828年德国化学家韦勒,第一次用人工方法合成了有机物——尿素化学发展史上的著名科学家三、化学科学在人类社会中的地位和作用:化学 ——人类进步的关键现代社会的发展,化学扮演着十分重要的角色:
1、化石能源是有限的,提高燃烧效率,开发新
能源需要化学;
2、保护人类居住的环境需要化学;
3、提高农作物产量,解决吃饭问题需要化学;
4、维护人体健康更离不开化学,
我们不难看出在社会发展中,
化学所起的作用是其他学科无法取代的。
如何运用化学知识研究和解决实际问题呢?四、人类在20世纪取得的重大科技成就:1、诞生了人类思想史上伟大理论——
爱因斯坦狭义相对论(1905)和广义相对论;(1915)
2、发现了铀原子核裂变(1938),制造出原子弹(1945)
氢弹(1954),利用原子能发电;
3、发明三极管(1905)发明雷达(1942)无线电通信迅
速发展,彩色电视机进入家庭生活;
4、制成电子计算机(1946)各种微型机(70年代)
5、试管婴儿诞生(1978)
6、发射人造地球卫星,(1957)人类登上了月球,
(1969)开创了“空间时代”
7、具有致命杀伤力的“生化武器”
…… 我国科学家在近代生物化学方面的重要成就:1965年,第一次用化学方法合成了具有生物活性的蛋白质——结晶牛胰岛素20世纪80年代,合成了具有生物活性的核糖核酸(酵母丙氨酸转移核糖核酸)小知识:化石燃料指的是:煤、石油、天然气五、化学与材料:材料化学组成使用功能非金属材料(如陶瓷)
金属材料(如合金)
有机高分子材料(如橡胶)复合材料 (如多功能)
高功能材料 (如超导)
结构材料 (如耐高温)
信息材料 (如液晶)材料是人类赖以生存和发展的物质基础,
一直是人类进步的重要里程碑。
石器时代、青铜器时代、铁器时代都是以材料作标志。
没有半导体材料就没有计算机技术;
没有耐高温、高强度的特殊材料就没有航天技术;
没有光导纤维就不会有现代通讯;
没有合成材料,今天的生活还会这么丰富多彩吗?高分子材料——聚硅氧烷,具有隔绝强热的功能高分子材料—聚硅氧烷,具有透气不透水的功能六:怎样学好化学:
1、 预习;
2、 提高 课堂效率:
带着问题听课 → 重、难点是什么?
适当做笔记 → 积极思考问题 ,大胆回答问题;
3 、仔细观察演示实验,认真做好学生实验;
4 、独立、认真完成作业;
5 、及时复习、每周小结;
6 、重视试卷分析、并保存好试卷。单位的换算(简谈)
1米(m)=10分米(dm)=100厘米(cm)=1000毫米(mm)1毫米(mm)=103微米= 106纳米(nm)
即1m=109nm (1nm=10-9m)一般情况下:
固体的密度单位采用:克/厘米3
液体的密度单位:克/毫升
气体的密度单位:克/升1分米3=1升 1厘米3=1毫升练习一:写出下列化学方程式:
(1)蓝色沉淀溶于盐酸
(2) 红褐色沉淀溶于硫酸
(3) 碳酸钙沉淀溶于盐酸
(4)碳酸钡沉淀溶于硝酸
(5) 氯化钡+硫酸
(6)硝酸银+盐酸Cu(OH)2+2HCl=CuCl2+H2O2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
CaCO3 +2HCl=CaCl2+H2O+CO2↑
BaCO3 +2HNO3=Ba(NO3)2+H2O+CO2 ↑BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3 +HCl =AgCl ↓ +HNO3(7).两种金属粉末的混合物30克与足量稀硫酸反应,生成1克氢气则这种混合物的组成是( )
A. Mg-Fe B.Zn-Fe C.Mg-Al D.Cu-Fe 混合物---------H2
30克 1克
60克 2克
Mg~H2 Fe ~ H2 Zn ~ H2 2Al ~ 3H2 Cu不反应
24 2 56 2 65 2 18 2B D讨论:
(8).甲、乙两个相邻的化工厂,排放的污水仍有八种离子(Ag+ Ba2+ Fe3+ Na+ Cl- SO42- NO3-
OH-)中各不相同的4种,若单独排放造成环境污染。若将它们按比例混合,沉淀过滤后得到无色澄清的NaNO3溶液,再排放,污染程度大为降低,
经测定甲厂的PH值>7,含两种阳离子两种阴离子,则:
甲厂的4种离子是 ;
乙厂的4种离子是 。
OH- Cl- Ba2+ Na+Ag+ Fe3+ SO42- NO3- 1、某金属元素的氧化物式量为a,其硝酸盐的式量为b,则该金属元素的化合价是 。
2、有Fe2O3 Zn H2 Ba(OH)2溶液 Na2CO3溶液
KOH溶液 H2SO4溶液七种物质,在常温下两种
物质间能发生化学反应最多有几种?写出它 们的化学方程式。(共有六种反应)
3、有 CO和H2的混合气体,且分子总数为n,当它
们完全燃烧时,需氧气的分子数是 。
4、在FeSO4和Fe2(SO4)3混合物中,已知硫元素的质量分数为23%,则铁的质量分数 。 练习二:1、某金属元素的氧化物式量为a,其硝酸盐的式量为b,则该金属元素的化合价是 。 分析:解:设金属元素化合价为x,当化合价为奇数时,
氧化物为R2Ox 硝酸盐 R(NO3)x
2R+16X=a
R +62X=b
X=2b-a108+当金属元素化合价为偶数时,氧化物为Rox/2 硝酸盐为R(NO3)x
R+8X=a
R +62X=bX=b-a54+3、有 CO和H2的混合气体,且分子总数为P,当它 们完全燃烧时,需氧气的分子数是 。2CO+O2 ===== 2 CO2点燃2H2 +O2 ===== 2 H2O点燃P/24、在FeSO4和Fe2(SO4)3混合物中,已知硫元素的
质量分数为23%,则铁的质量分数 。解:在FeSO4和Fe2(SO4)3中,
只有硫原子和氧原子的个数比是一定的(1:4)
元素的质量分数之比=元素的质量之比
元素的质量之比 =(元素的原子量×原子个数)之比S%O%=32 ×116 ×4
O%=46%
Fe%=100%-23%-46%
=31%
31%5、已知浓硫酸的密度与其质量分数成正比,且密度大于1,现有质量分数为50%的硫酸与等体积的水混合后,所得稀硫酸的质量分数为( )
A 大于25% B 小于25%
C 等于25% D不能确定
6、称取17.55克粗盐配成溶液,加入足量的AgNO3溶液,生成不溶于水的白色沉淀42.15克,问粗盐中含有下列物质中( )
A AlCl3 B MgCl2 C FeCl2 D ZnCl2
5、已知硫酸的密度与其质量分数成正比,且密度
大于1,现有质量分数为50%的硫酸与等体积的水
混合后,所得稀硫酸的质量分数为( )
A 大于25% B 小于25%
C 等于25% D不能确定
解:如果是50%的硫酸与等质量的水混合,
所得稀硫酸的质量分数=m.50%m+m=25%由于水的密度=1 小于硫酸的密度
故等体积的水的质量小于硫酸的质量,
所得稀硫酸的质量分数大于25% 。A6、称取17.55克粗盐配成溶液,加入足量的AgNO3
溶液,生成不溶于水的白色沉淀42.15克,问粗盐
中含有下列物质中( )
A AlCl3 B MgCl2 C FeCl2 D ZnCl2解:假设17.55克全部是NaCl,则生成AgCl为X.
NaCl +AgNO3= NaNO3+AgCl↓
58.5 143.5
17.55g X
58.5:17.55g=143.5:X
X=43.05g
而生成的不溶于水的白色沉淀只有42.15克
说明含有的杂质氯元素的质量分数低于NaCl,
则可能是FeCl2 ZnCl2C D
(原子-分子论) 现代化学
(物质结构理论)我国的四大发明
有两项是化学成就。
我国的烧瓷技术世界闻名。
精美的青铜制品世上罕见 。 即化学的发展经历了: 和 _______ 等 ,不同时期。古代、近代现代火烧陶瓷、炼丹术、造纸术等为古代化学成就的代表 是近代化学的里程碑原子、分子学说的建立波尔第一个提出了元素的概念质量守恒定律由罗蒙诺索夫(1748年)建立分子论的第一个提出人:阿伏加德罗原子论的第一个提出人:道尔顿(1808)元素周期论的第一个提出人:门捷列夫(1869)一般认为:原子论的建立是近代化学的开始,因此认为道尔顿是近代化学的创始人1828年德国化学家韦勒,第一次用人工方法合成了有机物——尿素化学发展史上的著名科学家三、化学科学在人类社会中的地位和作用:化学 ——人类进步的关键现代社会的发展,化学扮演着十分重要的角色:
1、化石能源是有限的,提高燃烧效率,开发新
能源需要化学;
2、保护人类居住的环境需要化学;
3、提高农作物产量,解决吃饭问题需要化学;
4、维护人体健康更离不开化学,
我们不难看出在社会发展中,
化学所起的作用是其他学科无法取代的。
如何运用化学知识研究和解决实际问题呢?四、人类在20世纪取得的重大科技成就:1、诞生了人类思想史上伟大理论——
爱因斯坦狭义相对论(1905)和广义相对论;(1915)
2、发现了铀原子核裂变(1938),制造出原子弹(1945)
氢弹(1954),利用原子能发电;
3、发明三极管(1905)发明雷达(1942)无线电通信迅
速发展,彩色电视机进入家庭生活;
4、制成电子计算机(1946)各种微型机(70年代)
5、试管婴儿诞生(1978)
6、发射人造地球卫星,(1957)人类登上了月球,
(1969)开创了“空间时代”
7、具有致命杀伤力的“生化武器”
…… 我国科学家在近代生物化学方面的重要成就:1965年,第一次用化学方法合成了具有生物活性的蛋白质——结晶牛胰岛素20世纪80年代,合成了具有生物活性的核糖核酸(酵母丙氨酸转移核糖核酸)小知识:化石燃料指的是:煤、石油、天然气五、化学与材料:材料化学组成使用功能非金属材料(如陶瓷)
金属材料(如合金)
有机高分子材料(如橡胶)复合材料 (如多功能)
高功能材料 (如超导)
结构材料 (如耐高温)
信息材料 (如液晶)材料是人类赖以生存和发展的物质基础,
一直是人类进步的重要里程碑。
石器时代、青铜器时代、铁器时代都是以材料作标志。
没有半导体材料就没有计算机技术;
没有耐高温、高强度的特殊材料就没有航天技术;
没有光导纤维就不会有现代通讯;
没有合成材料,今天的生活还会这么丰富多彩吗?高分子材料——聚硅氧烷,具有隔绝强热的功能高分子材料—聚硅氧烷,具有透气不透水的功能六:怎样学好化学:
1、 预习;
2、 提高 课堂效率:
带着问题听课 → 重、难点是什么?
适当做笔记 → 积极思考问题 ,大胆回答问题;
3 、仔细观察演示实验,认真做好学生实验;
4 、独立、认真完成作业;
5 、及时复习、每周小结;
6 、重视试卷分析、并保存好试卷。单位的换算(简谈)
1米(m)=10分米(dm)=100厘米(cm)=1000毫米(mm)1毫米(mm)=103微米= 106纳米(nm)
即1m=109nm (1nm=10-9m)一般情况下:
固体的密度单位采用:克/厘米3
液体的密度单位:克/毫升
气体的密度单位:克/升1分米3=1升 1厘米3=1毫升练习一:写出下列化学方程式:
(1)蓝色沉淀溶于盐酸
(2) 红褐色沉淀溶于硫酸
(3) 碳酸钙沉淀溶于盐酸
(4)碳酸钡沉淀溶于硝酸
(5) 氯化钡+硫酸
(6)硝酸银+盐酸Cu(OH)2+2HCl=CuCl2+H2O2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O
CaCO3 +2HCl=CaCl2+H2O+CO2↑
BaCO3 +2HNO3=Ba(NO3)2+H2O+CO2 ↑BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3 +HCl =AgCl ↓ +HNO3(7).两种金属粉末的混合物30克与足量稀硫酸反应,生成1克氢气则这种混合物的组成是( )
A. Mg-Fe B.Zn-Fe C.Mg-Al D.Cu-Fe 混合物---------H2
30克 1克
60克 2克
Mg~H2 Fe ~ H2 Zn ~ H2 2Al ~ 3H2 Cu不反应
24 2 56 2 65 2 18 2B D讨论:
(8).甲、乙两个相邻的化工厂,排放的污水仍有八种离子(Ag+ Ba2+ Fe3+ Na+ Cl- SO42- NO3-
OH-)中各不相同的4种,若单独排放造成环境污染。若将它们按比例混合,沉淀过滤后得到无色澄清的NaNO3溶液,再排放,污染程度大为降低,
经测定甲厂的PH值>7,含两种阳离子两种阴离子,则:
甲厂的4种离子是 ;
乙厂的4种离子是 。
OH- Cl- Ba2+ Na+Ag+ Fe3+ SO42- NO3- 1、某金属元素的氧化物式量为a,其硝酸盐的式量为b,则该金属元素的化合价是 。
2、有Fe2O3 Zn H2 Ba(OH)2溶液 Na2CO3溶液
KOH溶液 H2SO4溶液七种物质,在常温下两种
物质间能发生化学反应最多有几种?写出它 们的化学方程式。(共有六种反应)
3、有 CO和H2的混合气体,且分子总数为n,当它
们完全燃烧时,需氧气的分子数是 。
4、在FeSO4和Fe2(SO4)3混合物中,已知硫元素的质量分数为23%,则铁的质量分数 。 练习二:1、某金属元素的氧化物式量为a,其硝酸盐的式量为b,则该金属元素的化合价是 。 分析:解:设金属元素化合价为x,当化合价为奇数时,
氧化物为R2Ox 硝酸盐 R(NO3)x
2R+16X=a
R +62X=b
X=2b-a108+当金属元素化合价为偶数时,氧化物为Rox/2 硝酸盐为R(NO3)x
R+8X=a
R +62X=bX=b-a54+3、有 CO和H2的混合气体,且分子总数为P,当它 们完全燃烧时,需氧气的分子数是 。2CO+O2 ===== 2 CO2点燃2H2 +O2 ===== 2 H2O点燃P/24、在FeSO4和Fe2(SO4)3混合物中,已知硫元素的
质量分数为23%,则铁的质量分数 。解:在FeSO4和Fe2(SO4)3中,
只有硫原子和氧原子的个数比是一定的(1:4)
元素的质量分数之比=元素的质量之比
元素的质量之比 =(元素的原子量×原子个数)之比S%O%=32 ×116 ×4
O%=46%
Fe%=100%-23%-46%
=31%
31%5、已知浓硫酸的密度与其质量分数成正比,且密度大于1,现有质量分数为50%的硫酸与等体积的水混合后,所得稀硫酸的质量分数为( )
A 大于25% B 小于25%
C 等于25% D不能确定
6、称取17.55克粗盐配成溶液,加入足量的AgNO3溶液,生成不溶于水的白色沉淀42.15克,问粗盐中含有下列物质中( )
A AlCl3 B MgCl2 C FeCl2 D ZnCl2
5、已知硫酸的密度与其质量分数成正比,且密度
大于1,现有质量分数为50%的硫酸与等体积的水
混合后,所得稀硫酸的质量分数为( )
A 大于25% B 小于25%
C 等于25% D不能确定
解:如果是50%的硫酸与等质量的水混合,
所得稀硫酸的质量分数=m.50%m+m=25%由于水的密度=1 小于硫酸的密度
故等体积的水的质量小于硫酸的质量,
所得稀硫酸的质量分数大于25% 。A6、称取17.55克粗盐配成溶液,加入足量的AgNO3
溶液,生成不溶于水的白色沉淀42.15克,问粗盐
中含有下列物质中( )
A AlCl3 B MgCl2 C FeCl2 D ZnCl2解:假设17.55克全部是NaCl,则生成AgCl为X.
NaCl +AgNO3= NaNO3+AgCl↓
58.5 143.5
17.55g X
58.5:17.55g=143.5:X
X=43.05g
而生成的不溶于水的白色沉淀只有42.15克
说明含有的杂质氯元素的质量分数低于NaCl,
则可能是FeCl2 ZnCl2C D
