离子[下学期]
图片预览

文档简介
离 子 键
教学目标:
知识与技能: 1、理解离子键的的概念,学会用电子式表示离子键的形成过程。2、掌握离子键、共价键的区别与联系。3、理解离子化合物、共价化合物的概念,能用电子式表示离子化合物和共价化合物。
过程方法: 1、运用实验,增强探究式教学,发挥学生的主体作用。2、用对比的方法,在学习共价键的基础上,通过原子结构图示分析使学生掌握离子键、离子化合物、共价化合物的相关内容。
情感态度: 1、运用动画,调动学生学习积极性。2、通过对静电作用的理解,加强学生对对立统一规律的认识和理解。
教学分析:
本课内容从原子结构入手,分析为达到稳定结构原子离子,阴阳离子间的静电作用离子键,根据离子键的定义,联系化学中的熟悉物质,引导学生分析离子键的成键微粒、成键本质、成键元素。运用所学离子键、共价键的知识,从化学键的角度,对化合物进行分类,介绍离子化合物、共价化合物的概念,使知识层层深入。
教学重点:离子键的概念及用电子式表示离子键的形成。
教学难点:离子键与共价键的区别。
教具准备:多媒体
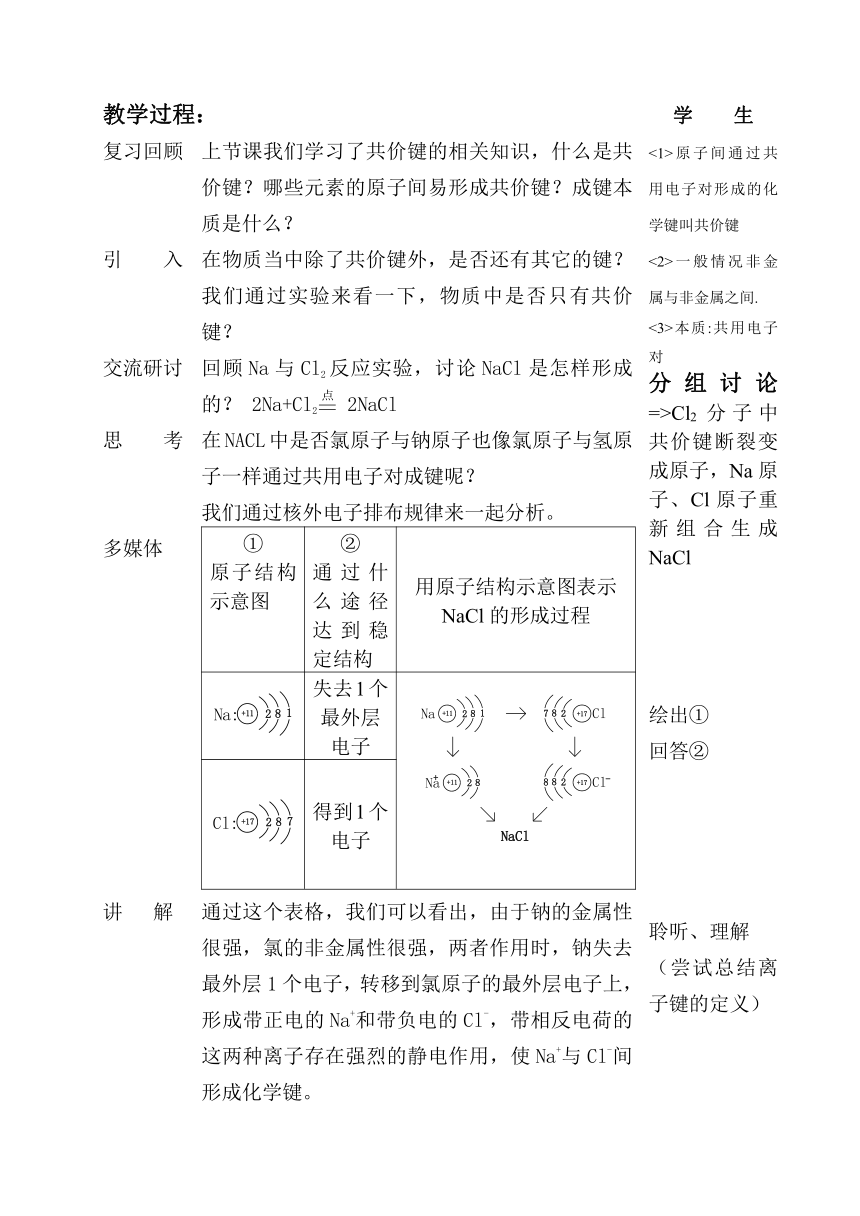
教学过程: 学 生
复习回顾 上节课我们学习了共价键的相关知识,什么是共价键?哪些元素的原子间易形成共价键?成键本质是什么? <1>原子间通过共用电子对形成的化学键叫共价键<2>一般情况非金属与非金属之间.<3>本质:共用电子对分组讨论=>Cl2分子中共价键断裂变成原子,Na原子、Cl原子重新组合生成NaCl
引 入 在物质当中除了共价键外,是否还有其它的键?我们通过实验来看一下,物质中是否只有共价键?
交流研讨 回顾Na与Cl2反应实验,讨论NaCl是怎样形成的? 2Na+Cl2 2NaCl
思 考 在NACL中是否氯原子与钠原子也像氯原子与氢原子一样通过共用电子对成键呢?我们通过核外电子排布规律来一起分析。
多媒体 ①原子结构示意图②通过什么途径达到稳定结构用原子结构示意图表示NaCl的形成过程失去1个最外层电子得到1个电子
绘出①回答②聆听、理解(尝试总结离子键的定义)
讲 解 通过这个表格,我们可以看出,由于钠的金属性很强,氯的非金属性很强,两者作用时,钠失去最外层1个电子,转移到氯原子的最外层电子上,形成带正电的Na+和带负电的Cl-,带相反电荷的这两种离子存在强烈的静电作用,使Na+与Cl-间形成化学键。
板 书 一、离子键 学 生
多媒体 1、定义:阴阳离子之间通过静电作用所形成的化学键叫做离子键。 记忆、叙述
练 习 举出你所学过的含离子键的物质。 举例:Na2O、CaO NH4Cl等
思 考 对于离子键来说
多媒体 成键微粒:阴阳离子2、 成键本质:静电作用活泼金属与活泼非金属成键元素:金属阳离子(或NH4+)与负电的原子团阴离子 作答<1>根据定义回答成键微粒和成键本质<2>讨论作答成键元素
讲 解 注:静电作用包括<1>、阴、阳离子异种电核之间相互吸引。<2>、离子核外电子之间的相互排斥。<3>、原子核内质子和质子之间的相互排斥 理解、记忆
练 习 写出钠原子、氯原子、钠离子、氯离子的电子式 原子:NaX 离子:Na+、
多媒体 3、用电子式表示NaCl的形成过程
讲 解 <1>“+”表示相遇 <2>“”表示电子转移的方向<3>“ ”表示形成
练 习 用电子式表示Na2O、MgCl2的形成过程。 自行练习
多媒体 注意:<1>相同原子、离子单个写<2>不能把“ ”写成“=”<3>要用箭头标明电子转移方向. 对照自己所写,对于错误书写,寻找错误原因,自行订正
讲 解 离子键、共价键将离子、原子按一定的数量结合在一起,形成具有固定组成的物质。根据化合物中所含化学键类型的不同,把化合物分为离子化合物和共价化合物。 聆听、回顾以前所学过的物质分类
多媒体 离子化合物,含有离子键的化4、化合物 合物。共价化合物,只含共价键的化合物 举例:Na2O 、KOH等举例:HCl、 H2SO4等
练 习 判断正误<1>离子化合物中肯定含有离子键,不含共价键<2>共价化合物中有可能含离子键<3>由共价键形成的分子一定是共价化合物分子 分析错误原因×(可以含共价键)×(只含共价键)×(也可以是单质)
课堂小结 通过本节课的学习,我们知道了离子键的相关概念,要会用电子式表示离子化合物的形成过程,以及离子化合物与共价化合物的本质区别
随堂练习 1、下列各元素的原子序数能以离子键结合成稳定化合物的是( C ) A、10和19 B、6和16 C、11和17 D、14和82、下列说法正确的是( AD )A、 离子化合物中可能含有共价键B 、共价化合物中可能含有离子键C 、离子化合物只含离子键D 、共价化合物不含离子键 Ne和KC和S(CS2)Na和Cl(NaCl)Si和O(SiO2)
课下练习 3、试举出2核4电子、12电子、20电子、28电子、36电子的离子型化合物 LiH、(NaH、LiF)(NaF、Mgo)(XlaCl、KF)(KCl、等)
山亭育才中学
杨淑文
06.3.31
教学目标:
知识与技能: 1、理解离子键的的概念,学会用电子式表示离子键的形成过程。2、掌握离子键、共价键的区别与联系。3、理解离子化合物、共价化合物的概念,能用电子式表示离子化合物和共价化合物。
过程方法: 1、运用实验,增强探究式教学,发挥学生的主体作用。2、用对比的方法,在学习共价键的基础上,通过原子结构图示分析使学生掌握离子键、离子化合物、共价化合物的相关内容。
情感态度: 1、运用动画,调动学生学习积极性。2、通过对静电作用的理解,加强学生对对立统一规律的认识和理解。
教学分析:
本课内容从原子结构入手,分析为达到稳定结构原子离子,阴阳离子间的静电作用离子键,根据离子键的定义,联系化学中的熟悉物质,引导学生分析离子键的成键微粒、成键本质、成键元素。运用所学离子键、共价键的知识,从化学键的角度,对化合物进行分类,介绍离子化合物、共价化合物的概念,使知识层层深入。
教学重点:离子键的概念及用电子式表示离子键的形成。
教学难点:离子键与共价键的区别。
教具准备:多媒体
教学过程: 学 生
复习回顾 上节课我们学习了共价键的相关知识,什么是共价键?哪些元素的原子间易形成共价键?成键本质是什么? <1>原子间通过共用电子对形成的化学键叫共价键<2>一般情况非金属与非金属之间.<3>本质:共用电子对分组讨论=>Cl2分子中共价键断裂变成原子,Na原子、Cl原子重新组合生成NaCl
引 入 在物质当中除了共价键外,是否还有其它的键?我们通过实验来看一下,物质中是否只有共价键?
交流研讨 回顾Na与Cl2反应实验,讨论NaCl是怎样形成的? 2Na+Cl2 2NaCl
思 考 在NACL中是否氯原子与钠原子也像氯原子与氢原子一样通过共用电子对成键呢?我们通过核外电子排布规律来一起分析。
多媒体 ①原子结构示意图②通过什么途径达到稳定结构用原子结构示意图表示NaCl的形成过程失去1个最外层电子得到1个电子
绘出①回答②聆听、理解(尝试总结离子键的定义)
讲 解 通过这个表格,我们可以看出,由于钠的金属性很强,氯的非金属性很强,两者作用时,钠失去最外层1个电子,转移到氯原子的最外层电子上,形成带正电的Na+和带负电的Cl-,带相反电荷的这两种离子存在强烈的静电作用,使Na+与Cl-间形成化学键。
板 书 一、离子键 学 生
多媒体 1、定义:阴阳离子之间通过静电作用所形成的化学键叫做离子键。 记忆、叙述
练 习 举出你所学过的含离子键的物质。 举例:Na2O、CaO NH4Cl等
思 考 对于离子键来说
多媒体 成键微粒:阴阳离子2、 成键本质:静电作用活泼金属与活泼非金属成键元素:金属阳离子(或NH4+)与负电的原子团阴离子 作答<1>根据定义回答成键微粒和成键本质<2>讨论作答成键元素
讲 解 注:静电作用包括<1>、阴、阳离子异种电核之间相互吸引。<2>、离子核外电子之间的相互排斥。<3>、原子核内质子和质子之间的相互排斥 理解、记忆
练 习 写出钠原子、氯原子、钠离子、氯离子的电子式 原子:NaX 离子:Na+、
多媒体 3、用电子式表示NaCl的形成过程
讲 解 <1>“+”表示相遇 <2>“”表示电子转移的方向<3>“ ”表示形成
练 习 用电子式表示Na2O、MgCl2的形成过程。 自行练习
多媒体 注意:<1>相同原子、离子单个写<2>不能把“ ”写成“=”<3>要用箭头标明电子转移方向. 对照自己所写,对于错误书写,寻找错误原因,自行订正
讲 解 离子键、共价键将离子、原子按一定的数量结合在一起,形成具有固定组成的物质。根据化合物中所含化学键类型的不同,把化合物分为离子化合物和共价化合物。 聆听、回顾以前所学过的物质分类
多媒体 离子化合物,含有离子键的化4、化合物 合物。共价化合物,只含共价键的化合物 举例:Na2O 、KOH等举例:HCl、 H2SO4等
练 习 判断正误<1>离子化合物中肯定含有离子键,不含共价键<2>共价化合物中有可能含离子键<3>由共价键形成的分子一定是共价化合物分子 分析错误原因×(可以含共价键)×(只含共价键)×(也可以是单质)
课堂小结 通过本节课的学习,我们知道了离子键的相关概念,要会用电子式表示离子化合物的形成过程,以及离子化合物与共价化合物的本质区别
随堂练习 1、下列各元素的原子序数能以离子键结合成稳定化合物的是( C ) A、10和19 B、6和16 C、11和17 D、14和82、下列说法正确的是( AD )A、 离子化合物中可能含有共价键B 、共价化合物中可能含有离子键C 、离子化合物只含离子键D 、共价化合物不含离子键 Ne和KC和S(CS2)Na和Cl(NaCl)Si和O(SiO2)
课下练习 3、试举出2核4电子、12电子、20电子、28电子、36电子的离子型化合物 LiH、(NaH、LiF)(NaF、Mgo)(XlaCl、KF)(KCl、等)
山亭育才中学
杨淑文
06.3.31
