第2章第2节化学反应的限度[下学期]
文档属性
| 名称 | 第2章第2节化学反应的限度[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 275.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-29 10:24:00 | ||
图片预览










文档简介
课件31张PPT。第2节 化学的限度大亚湾澳头中学
聂思良联想.质疑我们已经学习过许多可逆反应,如
这些反应在一定条件下不可能进行完全,即存在一定的限度,为什么?如何定量地描述化学反应的限度呢?
在一定条件下,可逆反应进行一段时间后,一定
会达到化学平衡状态,反应体系的组成不再随时
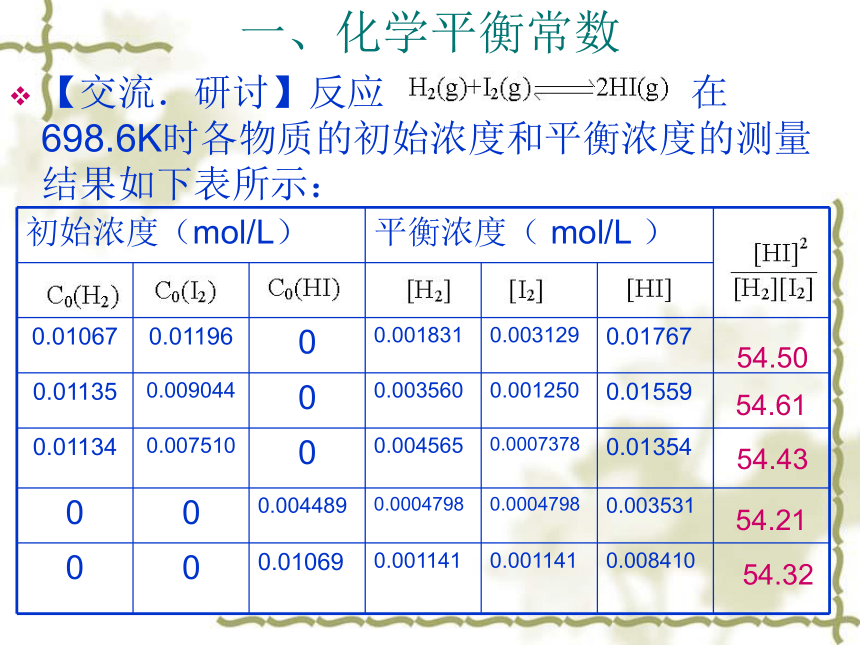
间而变化,即反应达到一定限度。可用化学平衡常数来定量地描述化学反应的限度一、化学平衡常数【交流.研讨】反应 在698.6K时各物质的初始浓度和平衡浓度的测量结果如下表所示:
54.5054.6154.4354.2154.32一、化学平衡常数(续1)分析计算数据,得出规律:
1、化学平衡常数
(1)定义:
在一定温度下,可逆反应无论从正反应开始,还
是从逆反应开始,或从正逆反应同时开始,最后
都能达到平衡,这时各生成物浓度方次积与反应
物浓度方次积的比值是一个常数。这个常数叫该
反应的化学平衡常数(平衡常数),符号:K(1)不管 、 、 的初始浓度多少,只要温度
不变,达平衡时, 为常数。(2)研究其他平衡体系也有相似的结论。一、化学平衡常数(续2)(2)数学表达式:
对于一般可逆反应:
温度一定时,则有 为常数。
【注意】
①对于在溶液中进行的反应,溶剂的浓度是一常数,此
常数归并到平衡常数中去。故在K的表达式中不出现溶
剂的浓度项。如,②当反应中有固体物质时,固体物质的浓度看作
常数,在K的表达式中不出现固体的浓度。如,一、化学平衡常数(续3)【注意】③如果产物和反应物均为气体,即使改变各组分
的初始分压,当反应:
达到平衡时 为常数,以Kp表示。浓度平衡常数(Kc):各物质平衡浓度计算得的平衡常数。
压强平衡常数(Kp):各物质平衡分压计算得的
平衡常数。Kc与Kp都称为化学平衡常数。一、化学平衡常数(续4)【注意】④平衡常数的表达式与化学方程式的书写方式有
关。同一个化学反应,化学方程式的书写方式不
同,平衡常数不同。如,一个化学反应的某一浓度平衡常数或压强平衡常数表达式与该反应的化学方程式的一种表示形式相对应,因此不能笼统地说某一反应的平衡常数的数值是多少。且平衡常数的单位也与化学方程式的表示形式一一对应。对于给定的化学反
应,正,逆反应的
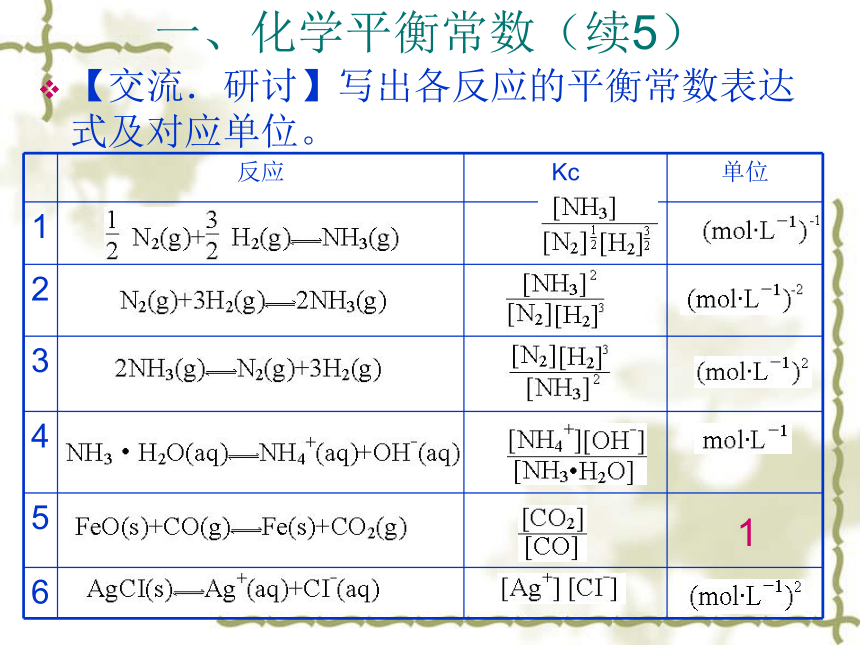
平衡常数互为倒数。一、化学平衡常数(续5)【交流.研讨】写出各反应的平衡常数表达式及对应单位。
1一、化学平衡常数(续6)(2)平衡常数K值的意义:K值的大小表示可逆反应的进行程度。K值大,反
应进行程度大,反应物的转化率在,反之亦然。
一般:当K= 左右,认为反应进行得较“完全”。
当K= 左右,认为这个反应很难进行。如,一、化学平衡常数(续7)(3)应用:
(4)影响K值大小的因素:借助平衡常数,可以判别一个 化学反应是否达化
学平衡状态。对于可逆反应:
在一定温度下的任
意时刻,生成物和反应物的浓度有如下关系:
Qc叫做反应的浓度商
=Kc,反应达平衡状态,V(正)=V(逆)
QcV(逆)
>Kc, 反应向逆反应方向进行,V(正)则反应A的转化率 表示为:注:说平衡转化率时应指明具体反应物。原因(因为反应物的平衡转化率因反应物不同而不同。因此脱离具体的反应物谈化学反应的平衡转化率是没有意义。)二、平衡转化率(续1)2、关于化学平衡的计算
例题1,化学反应 是硫酸制造工业的基本反应。将0.050mol二氧化硫和0.030mol氧气注入体积为1.0L的密闭反应器,并置于温度为850K的恒温环境中,达化学平衡后,测得反应器中有0.044mol三氧化硫,求850K时该反应的平衡常数及各反应物的平衡转化率。
解: 二、平衡转化率(续2)例题2,1200 时测得反应
的平衡常数Kc为2.25。若反应从氢气和二氧化碳开始,且氢气和二氧化碳初始浓度分别为下列A、B、C三种情况。试计算A情况下各物质的平衡浓度及氢气和二氧化碳的平衡转化率。
交流.研讨.总结根据例2另外两组数据,将计算结果填入下表
0.0054680.0034680.0065320.00653254.4365.320.00380.00580.00420.004252.542.0结论:①增加一种反应物的量,使另一反应物平衡转化率提高;减少一种反应物的量,使另一反应物的平衡转化率降低 。②化学平衡常数与平衡转化率密切相关。归纳:化学平衡的计算步骤:
等量关系:①写出化学平衡的化学方程式;
②找出各物质的初始量、转化量、平衡量;
③根据已知条件列方程计算。①反应物:初始浓度-转化浓度=平衡浓度。
生成物:初始浓度+转化浓度=平衡浓度。
②各物质的转化浓度之比等于化学方程式中各物
质前面的计量数之比。小结:1、化学平衡常数
(1)定义
(2)K值的意义
(3)应用
(4)影响K值大小的因素
2、平衡转化率
(1)定义
(2)有关化学平衡的计算:①步骤 ②等量关系
③结论
作业课本 P58 3,4三、反应条件对化学平衡的影响1、化学平衡的移动
(1)概念:
如果一个可逆反应达到平衡状态以后,反应条件(如C、T、P等)改变,平衡混合物里各
组成物质的质量分数随着改变而达到新的平衡
状态。这种由旧平衡状态向新的平衡状态变化
的过程叫~。平衡移动过程表示为:外界条 件改变V(正)>V(逆),正反应占优,平衡正向移动。V(正)〖活动.探究〗分别将两只充有二氧化氮的密闭烧瓶浸入盛有冷水和热水的烧杯中,持续一段时间到颜色不再变化时止,观察现象,分析原因。
【规律】气体颜色变浅气体颜色变深二氧化氮浓度减少,
平衡右移。二氧化氮浓度增大,
平衡左移。升高温度,化学平衡向吸热反应方向移
动;降低温度,化学平衡向放热反应移动。2、影响化学平衡移动的因素(续1)(2)浓度
〖活动.探究〗阅读课本P53的(活动、探究)内容,填表:
【规律】 【应用】两溶液等体积混合后,溶液呈血红
色,加入KSCN溶液红色加深。两溶液等体积混合后,溶液呈血红
色,加入氯化铁溶液红色加深。增大硫氰酸根浓度,
平衡正向移动。增大铁离子浓度,
平衡正向移动。温度一定时,增大反应物浓度或减少生成物的浓度,则QcKc,平衡逆向移动。2、影响化学平衡移动的因素(续2)【应用】
①化工生产中,常通过增大某一廉价、易得反应
物的浓度来提高另一贵重的反应物的转化率。
②生产过程中常将产物及时从体系中移走,使化
学平衡不断向右移动。例如1,在硫酸工业里,常用过量的空气使二氧化
硫充分氧化,以生成更多的三氧化硫。例如2,合成氨工业里,及时从平衡体系中移走
氨,从而使平衡不断向右移动。2、影响化学平衡移动的因素(续3)(3)压强
【交流.研讨】填表:
①气态物质系数的改变量:△Vg=气态产物系数和减去气态反应物系数和。
0-2(<0)1(>0)2、影响化学平衡移动的因素(续4)(3)压强
【结论】
【说明】
在其他条件不变情况下,增大压强,平衡向气体
体积减少的方向移动;减少压强,平衡向气体体
积增大的方向移动。①只涉及固体或液体的反应,改变压强,平衡不
会移动。②对于△Vg=0的化学平衡,改变压强,平衡不
会移动。2、影响化学平衡移动的因素(续5)(3)压强
【说明】例如,③恒温、恒容的密闭容器中,已达平衡的气体反
应,若向该容器中充入一种不与体系中各物质发
生反应的气体(如希有气体),化学平衡不移动。
(原因:尽管容器内总压强增大了,但原平衡体系
中各物质的分压不变)
2、影响化学平衡移动的因素(续6)(3)压强
【说明】④恒温、恒压体积可变的密闭容器中,向已达平
衡的气体反应中充入一种不与体系中各物质发生
反应的气体,化学平衡会向气体体积增大的方向
移动(相当于减少压强对平衡移动的影响。)
(原因:尽管此时体系的总压不变,但原来平衡体
系中各物质的分压都减少。)
⑤若把气体分压当成T一定时的浓度,浓度对化学
平衡的影响规律同样适用于压强的影响。2、影响化学平衡移动的因素(续7)(3)压强
【说明】⑥溶液稀释或浓缩与气体减压或增压的化学平衡
移动规律相似。3、化学平衡移动规律总结【分述】①温度:升温,化学平衡向吸热方向移动;降温,化学平衡向放热方向移动。②浓度:增大反应物或减少生成物的浓度(Qc因此它对化学平衡的移动没有影响。3、化学平衡移动规律总结(续1)【总述】
说明:如果改变影响平衡的一个条件(如C、T、P等),平衡就向能够减弱这种改变的方向移动,这个原理叫平衡移动原理(勒.夏特列原理)。①适用范围:所有的动态平衡封闭体系(电离平衡,水解平衡,溶解平衡等),只改变其中一个条件(如C、T、P等)时,平衡移动才适用。②优缺点:该原理可用来判断平衡移动的方向,但不能判断建立新平衡所需要的时间,以及在平衡建立过程中各物质间的数量关系等。③平衡移动原理有分述和总述之分,但其涵义完全相同。例题讲解1、将2mol二氧化硫和1mol氧气充入一容积固定密闭容器中,在一定条件下发生反应: ,下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
A、混合气体的密度
B、混合气体的压强
C、混合气体的总物质的量
D、混合气体的平均相对分子质量A例题讲解2、在密闭容器中进行下列反应
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡 ,c(CO) ;
(2)减少密闭容器体积,保持温度不变,则平衡
, ;
(3)通入 ,保持密闭容器体积和温度不变,则平衡 , ;
(4)保持密闭容器体积不变,升温,则平衡
, c(CO) 。
不移动不变逆向移动增大不移动不变正向移动增大作业:在一密闭容器中进行的如下反应:
二氧化硫和氧气的起始浓度是0.4mol/L、1mol/L,当80%的二氧化硫转化为三氧化硫时,反应达平衡,求平衡时三种气体的浓度及平衡常数.
聂思良联想.质疑我们已经学习过许多可逆反应,如
这些反应在一定条件下不可能进行完全,即存在一定的限度,为什么?如何定量地描述化学反应的限度呢?
在一定条件下,可逆反应进行一段时间后,一定
会达到化学平衡状态,反应体系的组成不再随时
间而变化,即反应达到一定限度。可用化学平衡常数来定量地描述化学反应的限度一、化学平衡常数【交流.研讨】反应 在698.6K时各物质的初始浓度和平衡浓度的测量结果如下表所示:
54.5054.6154.4354.2154.32一、化学平衡常数(续1)分析计算数据,得出规律:
1、化学平衡常数
(1)定义:
在一定温度下,可逆反应无论从正反应开始,还
是从逆反应开始,或从正逆反应同时开始,最后
都能达到平衡,这时各生成物浓度方次积与反应
物浓度方次积的比值是一个常数。这个常数叫该
反应的化学平衡常数(平衡常数),符号:K(1)不管 、 、 的初始浓度多少,只要温度
不变,达平衡时, 为常数。(2)研究其他平衡体系也有相似的结论。一、化学平衡常数(续2)(2)数学表达式:
对于一般可逆反应:
温度一定时,则有 为常数。
【注意】
①对于在溶液中进行的反应,溶剂的浓度是一常数,此
常数归并到平衡常数中去。故在K的表达式中不出现溶
剂的浓度项。如,②当反应中有固体物质时,固体物质的浓度看作
常数,在K的表达式中不出现固体的浓度。如,一、化学平衡常数(续3)【注意】③如果产物和反应物均为气体,即使改变各组分
的初始分压,当反应:
达到平衡时 为常数,以Kp表示。浓度平衡常数(Kc):各物质平衡浓度计算得的平衡常数。
压强平衡常数(Kp):各物质平衡分压计算得的
平衡常数。Kc与Kp都称为化学平衡常数。一、化学平衡常数(续4)【注意】④平衡常数的表达式与化学方程式的书写方式有
关。同一个化学反应,化学方程式的书写方式不
同,平衡常数不同。如,一个化学反应的某一浓度平衡常数或压强平衡常数表达式与该反应的化学方程式的一种表示形式相对应,因此不能笼统地说某一反应的平衡常数的数值是多少。且平衡常数的单位也与化学方程式的表示形式一一对应。对于给定的化学反
应,正,逆反应的
平衡常数互为倒数。一、化学平衡常数(续5)【交流.研讨】写出各反应的平衡常数表达式及对应单位。
1一、化学平衡常数(续6)(2)平衡常数K值的意义:K值的大小表示可逆反应的进行程度。K值大,反
应进行程度大,反应物的转化率在,反之亦然。
一般:当K= 左右,认为反应进行得较“完全”。
当K= 左右,认为这个反应很难进行。如,一、化学平衡常数(续7)(3)应用:
(4)影响K值大小的因素:借助平衡常数,可以判别一个 化学反应是否达化
学平衡状态。对于可逆反应:
在一定温度下的任
意时刻,生成物和反应物的浓度有如下关系:
Qc叫做反应的浓度商
=Kc,反应达平衡状态,V(正)=V(逆)
Qc
>Kc, 反应向逆反应方向进行,V(正)
例题1,化学反应 是硫酸制造工业的基本反应。将0.050mol二氧化硫和0.030mol氧气注入体积为1.0L的密闭反应器,并置于温度为850K的恒温环境中,达化学平衡后,测得反应器中有0.044mol三氧化硫,求850K时该反应的平衡常数及各反应物的平衡转化率。
解: 二、平衡转化率(续2)例题2,1200 时测得反应
的平衡常数Kc为2.25。若反应从氢气和二氧化碳开始,且氢气和二氧化碳初始浓度分别为下列A、B、C三种情况。试计算A情况下各物质的平衡浓度及氢气和二氧化碳的平衡转化率。
交流.研讨.总结根据例2另外两组数据,将计算结果填入下表
0.0054680.0034680.0065320.00653254.4365.320.00380.00580.00420.004252.542.0结论:①增加一种反应物的量,使另一反应物平衡转化率提高;减少一种反应物的量,使另一反应物的平衡转化率降低 。②化学平衡常数与平衡转化率密切相关。归纳:化学平衡的计算步骤:
等量关系:①写出化学平衡的化学方程式;
②找出各物质的初始量、转化量、平衡量;
③根据已知条件列方程计算。①反应物:初始浓度-转化浓度=平衡浓度。
生成物:初始浓度+转化浓度=平衡浓度。
②各物质的转化浓度之比等于化学方程式中各物
质前面的计量数之比。小结:1、化学平衡常数
(1)定义
(2)K值的意义
(3)应用
(4)影响K值大小的因素
2、平衡转化率
(1)定义
(2)有关化学平衡的计算:①步骤 ②等量关系
③结论
作业课本 P58 3,4三、反应条件对化学平衡的影响1、化学平衡的移动
(1)概念:
如果一个可逆反应达到平衡状态以后,反应条件(如C、T、P等)改变,平衡混合物里各
组成物质的质量分数随着改变而达到新的平衡
状态。这种由旧平衡状态向新的平衡状态变化
的过程叫~。平衡移动过程表示为:外界条 件改变V(正)>V(逆),正反应占优,平衡正向移动。V(正)
【规律】气体颜色变浅气体颜色变深二氧化氮浓度减少,
平衡右移。二氧化氮浓度增大,
平衡左移。升高温度,化学平衡向吸热反应方向移
动;降低温度,化学平衡向放热反应移动。2、影响化学平衡移动的因素(续1)(2)浓度
〖活动.探究〗阅读课本P53的(活动、探究)内容,填表:
【规律】 【应用】两溶液等体积混合后,溶液呈血红
色,加入KSCN溶液红色加深。两溶液等体积混合后,溶液呈血红
色,加入氯化铁溶液红色加深。增大硫氰酸根浓度,
平衡正向移动。增大铁离子浓度,
平衡正向移动。温度一定时,增大反应物浓度或减少生成物的浓度,则Qc
①化工生产中,常通过增大某一廉价、易得反应
物的浓度来提高另一贵重的反应物的转化率。
②生产过程中常将产物及时从体系中移走,使化
学平衡不断向右移动。例如1,在硫酸工业里,常用过量的空气使二氧化
硫充分氧化,以生成更多的三氧化硫。例如2,合成氨工业里,及时从平衡体系中移走
氨,从而使平衡不断向右移动。2、影响化学平衡移动的因素(续3)(3)压强
【交流.研讨】填表:
①气态物质系数的改变量:△Vg=气态产物系数和减去气态反应物系数和。
0-2(<0)1(>0)2、影响化学平衡移动的因素(续4)(3)压强
【结论】
【说明】
在其他条件不变情况下,增大压强,平衡向气体
体积减少的方向移动;减少压强,平衡向气体体
积增大的方向移动。①只涉及固体或液体的反应,改变压强,平衡不
会移动。②对于△Vg=0的化学平衡,改变压强,平衡不
会移动。2、影响化学平衡移动的因素(续5)(3)压强
【说明】例如,③恒温、恒容的密闭容器中,已达平衡的气体反
应,若向该容器中充入一种不与体系中各物质发
生反应的气体(如希有气体),化学平衡不移动。
(原因:尽管容器内总压强增大了,但原平衡体系
中各物质的分压不变)
2、影响化学平衡移动的因素(续6)(3)压强
【说明】④恒温、恒压体积可变的密闭容器中,向已达平
衡的气体反应中充入一种不与体系中各物质发生
反应的气体,化学平衡会向气体体积增大的方向
移动(相当于减少压强对平衡移动的影响。)
(原因:尽管此时体系的总压不变,但原来平衡体
系中各物质的分压都减少。)
⑤若把气体分压当成T一定时的浓度,浓度对化学
平衡的影响规律同样适用于压强的影响。2、影响化学平衡移动的因素(续7)(3)压强
【说明】⑥溶液稀释或浓缩与气体减压或增压的化学平衡
移动规律相似。3、化学平衡移动规律总结【分述】①温度:升温,化学平衡向吸热方向移动;降温,化学平衡向放热方向移动。②浓度:增大反应物或减少生成物的浓度(Qc
说明:如果改变影响平衡的一个条件(如C、T、P等),平衡就向能够减弱这种改变的方向移动,这个原理叫平衡移动原理(勒.夏特列原理)。①适用范围:所有的动态平衡封闭体系(电离平衡,水解平衡,溶解平衡等),只改变其中一个条件(如C、T、P等)时,平衡移动才适用。②优缺点:该原理可用来判断平衡移动的方向,但不能判断建立新平衡所需要的时间,以及在平衡建立过程中各物质间的数量关系等。③平衡移动原理有分述和总述之分,但其涵义完全相同。例题讲解1、将2mol二氧化硫和1mol氧气充入一容积固定密闭容器中,在一定条件下发生反应: ,下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
A、混合气体的密度
B、混合气体的压强
C、混合气体的总物质的量
D、混合气体的平均相对分子质量A例题讲解2、在密闭容器中进行下列反应
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡 ,c(CO) ;
(2)减少密闭容器体积,保持温度不变,则平衡
, ;
(3)通入 ,保持密闭容器体积和温度不变,则平衡 , ;
(4)保持密闭容器体积不变,升温,则平衡
, c(CO) 。
不移动不变逆向移动增大不移动不变正向移动增大作业:在一密闭容器中进行的如下反应:
二氧化硫和氧气的起始浓度是0.4mol/L、1mol/L,当80%的二氧化硫转化为三氧化硫时,反应达平衡,求平衡时三种气体的浓度及平衡常数.
