原电池的原理及应用[下学期]
图片预览

文档简介
原电池 金属的腐蚀与防护
目的要求:1. 使学生了解原电池的化学原理
2. 了解金属腐蚀,特别是电化腐蚀和金属防护的一般方法。
重点、难点:原电池的化学原理和金属的电化腐蚀
教学方法:探索法(启发引导)
引入 我们知道,物质发生化学反应时必然要有能量的变化,也就是说化学能常常与热能、光能等相互转化。比如在一般化学反应里,常表现出放热或吸热的现象,有的化学反应还伴随有发光,产生电流等等。今天我们主要探讨的是有关化学能是如何转变为电能。
实验 初中我们就已经学习过,活泼金属能与酸反应放出氢气,而不活泼金属就不能与酸反应置换氢气。(1)把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯中,观察现象。
Zn Cu H2SO4 现象:锌片上有气体放出,铜片上无明显现象。
分析 Zn + 2H+ === Zn2+ + H2 2e
板书 金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属单质失电子能力:强 弱(还原性)金属离子得电子能力:弱 强(氧化性)
实验 Zn Cu H2SO4 现象:锌片不断溶解、铜片上有气泡、灵敏电流计指针发生偏转。
结论 两极发生氧化还原反应,产生电流。
明确 (1) 锌比铜活泼(2) 氢离子在铜片上获得电子
板书 电极名称 锌片(负极)Zn – 2e === Zn2+(氧化反应) 电极材料 铜片(正极)2H+ + 2e === H2(还原反应)(电极反应式)总化学方程式:Zn + 2H+ === Zn2+ + H2
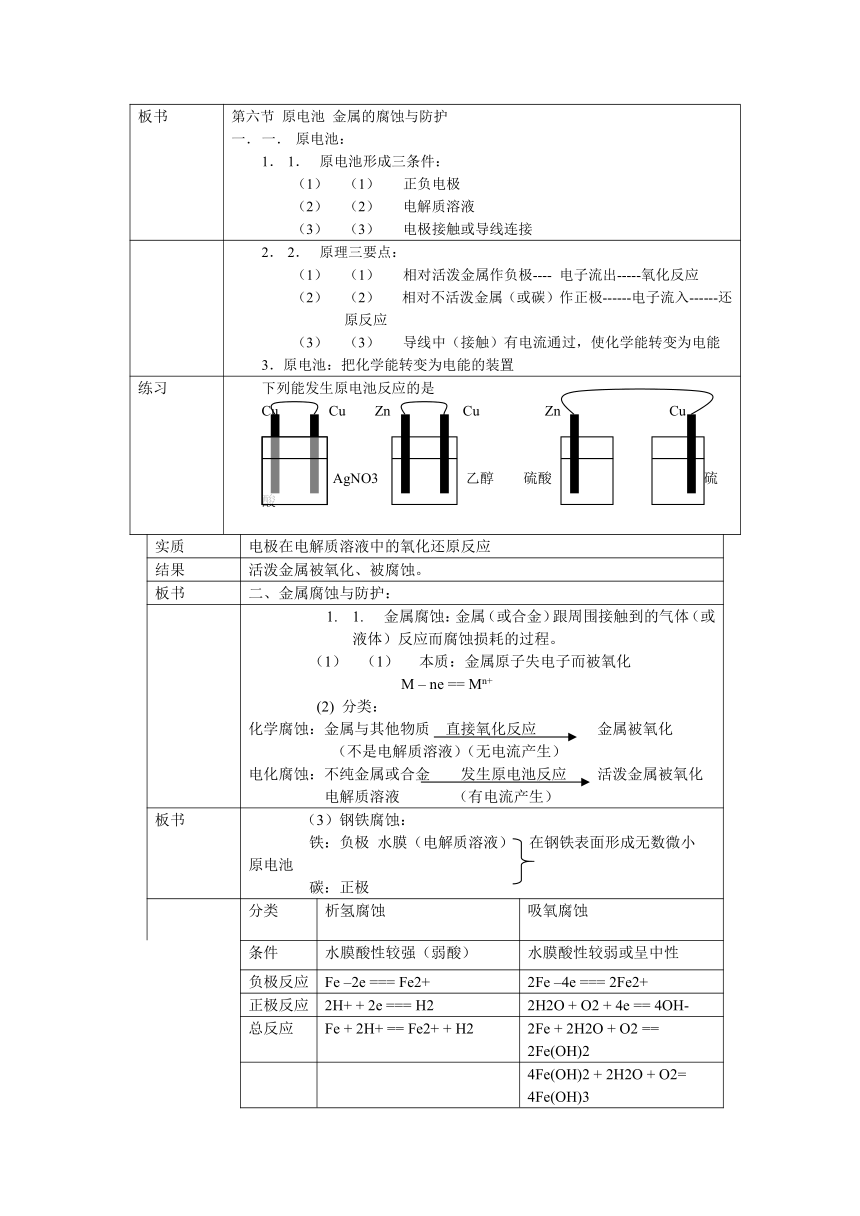
板书 第六节 原电池 金属的腐蚀与防护一. 原电池:1. 原电池形成三条件:(1) 正负电极(2) 电解质溶液(3) 电极接触或导线连接
2. 原理三要点:(1) 相对活泼金属作负极---- 电子流出-----氧化反应(2) 相对不活泼金属(或碳)作正极------电子流入------还原反应(3) 导线中(接触)有电流通过,使化学能转变为电能3.原电池:把化学能转变为电能的装置
练习 下列能发生原电池反应的是Cu Cu Zn Cu Zn Cu AgNO3 乙醇 硫酸 硫酸
实质 电极在电解质溶液中的氧化还原反应
结果 活泼金属被氧化、被腐蚀。
板书 二、金属腐蚀与防护:
1. 金属腐蚀:金属(或合金)跟周围接触到的气体(或液体)反应而腐蚀损耗的过程。(1) 本质:金属原子失电子而被氧化M – ne == Mn+ (2) 分类:化学腐蚀:金属与其他物质 直接氧化反应 金属被氧化 (不是电解质溶液)(无电流产生)电化腐蚀:不纯金属或合金 发生原电池反应 活泼金属被氧化 电解质溶液 (有电流产生)
板书 (3)钢铁腐蚀: 铁:负极 水膜(电解质溶液) 在钢铁表面形成无数微小原电池 碳:正极
分类 析氢腐蚀 吸氧腐蚀
条件 水膜酸性较强(弱酸) 水膜酸性较弱或呈中性
负极反应 Fe –2e === Fe2+ 2Fe –4e === 2Fe2+
正极反应 2H+ + 2e === H2 2H2O + O2 + 4e == 4OH-
总反应 Fe + 2H+ == Fe2+ + H2 2Fe + 2H2O + O2 == 2Fe(OH)2
4Fe(OH)2 + 2H2O + O2= 4Fe(OH)3 Fe2O3.xH2O
次要 主要
4. 金属的化学腐蚀:例如:铁在高温下与氧气直接化合而被腐蚀,在工业生产中氯气跟铁或与其他金属化合使金属锈蚀。概念:金属跟接触到的物质直接发生化学反应而引起的腐蚀。特点:反应简单、金属与氧化剂之间的氧化还原反应。 5.化学腐蚀与电化腐蚀的对比(1) 相同点:金属原子失电子而被氧化的过程,即金属原子转化为阳离子的过程。(2) 不同点: 条件 金属与氧化剂直接反应 不纯金属与电解质溶液接触 现象 无电流 有电流 本质 金属被氧化 活泼金属被氧化(3) 相互关系:往往同时发生,电化腐蚀要比化学腐蚀普遍得多。
讨论 原电池中的电荷移动方向:
e 阴离子 阳离子
板书 几种常见新型原电池1. 铅蓄电池Pb + PbO2 + 2H2SO4 ==== 2PbSO4 + 2H2O(-) (+)2. 燃料电池新型电池中,电极的导电材料一般多孔的金属板,负极是通入还原剂的一方,正极是通入氧化剂的一方。如:氢氧燃料电池,电解质溶液为30%的氢氧化钾溶液:正极: O2+ 4e + 2H2O === 4OH-负极: 2H2 –4e + 4OH-=== 4H2O又如:甲烷燃料电池;电解质溶液为氢氧化钾溶液:正极:2O2 + 8e + 4H2O === 8OH-负极: CH4 + 10OH- -8e === CO32- + 7H2O总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O
介绍 白口铁马口铁
板书 金属腐蚀的防护1. 金属腐蚀的原因:金属本身的组成和结构是锈蚀的根据;外界条件(如:温度、湿度、与金属接触的物质)是促使金属锈蚀的客观因素。2. 防护:(1) 改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。(2) 在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)(3) 电化学保护法:牺牲阳极阴极保护法、外加电流阴极保护法。
作业 教材:1、2、3、4、5练习册
目的要求:1. 使学生了解原电池的化学原理
2. 了解金属腐蚀,特别是电化腐蚀和金属防护的一般方法。
重点、难点:原电池的化学原理和金属的电化腐蚀
教学方法:探索法(启发引导)
引入 我们知道,物质发生化学反应时必然要有能量的变化,也就是说化学能常常与热能、光能等相互转化。比如在一般化学反应里,常表现出放热或吸热的现象,有的化学反应还伴随有发光,产生电流等等。今天我们主要探讨的是有关化学能是如何转变为电能。
实验 初中我们就已经学习过,活泼金属能与酸反应放出氢气,而不活泼金属就不能与酸反应置换氢气。(1)把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯中,观察现象。
Zn Cu H2SO4 现象:锌片上有气体放出,铜片上无明显现象。
分析 Zn + 2H+ === Zn2+ + H2 2e
板书 金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属单质失电子能力:强 弱(还原性)金属离子得电子能力:弱 强(氧化性)
实验 Zn Cu H2SO4 现象:锌片不断溶解、铜片上有气泡、灵敏电流计指针发生偏转。
结论 两极发生氧化还原反应,产生电流。
明确 (1) 锌比铜活泼(2) 氢离子在铜片上获得电子
板书 电极名称 锌片(负极)Zn – 2e === Zn2+(氧化反应) 电极材料 铜片(正极)2H+ + 2e === H2(还原反应)(电极反应式)总化学方程式:Zn + 2H+ === Zn2+ + H2
板书 第六节 原电池 金属的腐蚀与防护一. 原电池:1. 原电池形成三条件:(1) 正负电极(2) 电解质溶液(3) 电极接触或导线连接
2. 原理三要点:(1) 相对活泼金属作负极---- 电子流出-----氧化反应(2) 相对不活泼金属(或碳)作正极------电子流入------还原反应(3) 导线中(接触)有电流通过,使化学能转变为电能3.原电池:把化学能转变为电能的装置
练习 下列能发生原电池反应的是Cu Cu Zn Cu Zn Cu AgNO3 乙醇 硫酸 硫酸
实质 电极在电解质溶液中的氧化还原反应
结果 活泼金属被氧化、被腐蚀。
板书 二、金属腐蚀与防护:
1. 金属腐蚀:金属(或合金)跟周围接触到的气体(或液体)反应而腐蚀损耗的过程。(1) 本质:金属原子失电子而被氧化M – ne == Mn+ (2) 分类:化学腐蚀:金属与其他物质 直接氧化反应 金属被氧化 (不是电解质溶液)(无电流产生)电化腐蚀:不纯金属或合金 发生原电池反应 活泼金属被氧化 电解质溶液 (有电流产生)
板书 (3)钢铁腐蚀: 铁:负极 水膜(电解质溶液) 在钢铁表面形成无数微小原电池 碳:正极
分类 析氢腐蚀 吸氧腐蚀
条件 水膜酸性较强(弱酸) 水膜酸性较弱或呈中性
负极反应 Fe –2e === Fe2+ 2Fe –4e === 2Fe2+
正极反应 2H+ + 2e === H2 2H2O + O2 + 4e == 4OH-
总反应 Fe + 2H+ == Fe2+ + H2 2Fe + 2H2O + O2 == 2Fe(OH)2
4Fe(OH)2 + 2H2O + O2= 4Fe(OH)3 Fe2O3.xH2O
次要 主要
4. 金属的化学腐蚀:例如:铁在高温下与氧气直接化合而被腐蚀,在工业生产中氯气跟铁或与其他金属化合使金属锈蚀。概念:金属跟接触到的物质直接发生化学反应而引起的腐蚀。特点:反应简单、金属与氧化剂之间的氧化还原反应。 5.化学腐蚀与电化腐蚀的对比(1) 相同点:金属原子失电子而被氧化的过程,即金属原子转化为阳离子的过程。(2) 不同点: 条件 金属与氧化剂直接反应 不纯金属与电解质溶液接触 现象 无电流 有电流 本质 金属被氧化 活泼金属被氧化(3) 相互关系:往往同时发生,电化腐蚀要比化学腐蚀普遍得多。
讨论 原电池中的电荷移动方向:
e 阴离子 阳离子
板书 几种常见新型原电池1. 铅蓄电池Pb + PbO2 + 2H2SO4 ==== 2PbSO4 + 2H2O(-) (+)2. 燃料电池新型电池中,电极的导电材料一般多孔的金属板,负极是通入还原剂的一方,正极是通入氧化剂的一方。如:氢氧燃料电池,电解质溶液为30%的氢氧化钾溶液:正极: O2+ 4e + 2H2O === 4OH-负极: 2H2 –4e + 4OH-=== 4H2O又如:甲烷燃料电池;电解质溶液为氢氧化钾溶液:正极:2O2 + 8e + 4H2O === 8OH-负极: CH4 + 10OH- -8e === CO32- + 7H2O总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O
介绍 白口铁马口铁
板书 金属腐蚀的防护1. 金属腐蚀的原因:金属本身的组成和结构是锈蚀的根据;外界条件(如:温度、湿度、与金属接触的物质)是促使金属锈蚀的客观因素。2. 防护:(1) 改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。(2) 在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)(3) 电化学保护法:牺牲阳极阴极保护法、外加电流阴极保护法。
作业 教材:1、2、3、4、5练习册
