平衡移动[上学期]
图片预览



文档简介
课件28张PPT。影响化学平衡的条件一) 化学平衡的移动1、定义:
如果一个可逆反应达到平衡状态以后,反应条件(浓度、压强、温度)改变了,平衡混合物是各组成的含量也就随着改变,而达到新平衡状态2、特征旧的化学平衡原平衡被破坏条件改变一定时间新的化学平衡 新平衡状态和原平衡状态相比,反应混合物中各组分的含量是不相同的化学平衡的移动的原因:外界条件的改变;
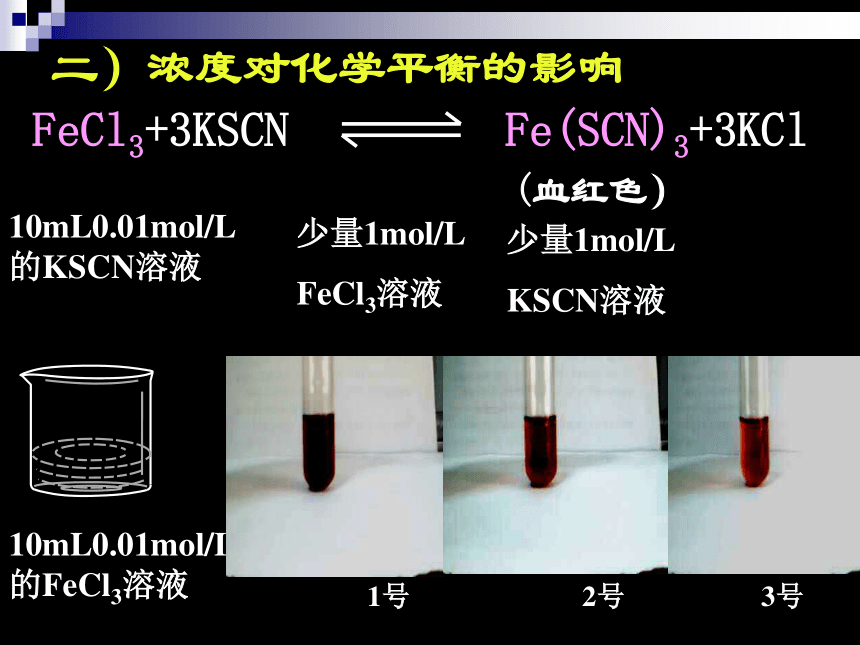
平衡的移动的结果:原平衡混合物中各组分的含量发生变化二)浓度对化学平衡的影响10mL0.01mol/L
的FeCl3溶液1号3号2号少量1mol/L
FeCl3溶液少量1mol/L
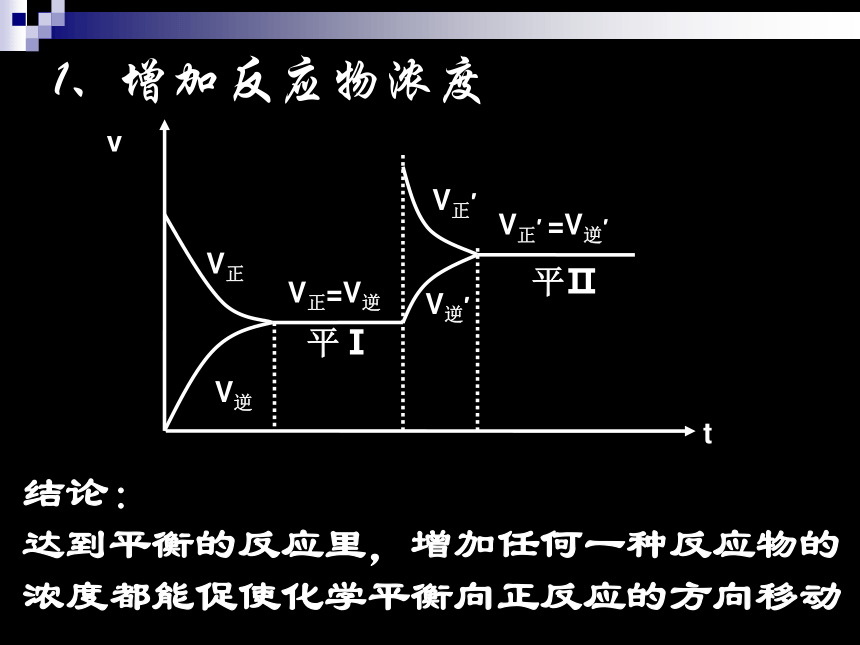
KSCN溶液V正V逆V正′V逆′1、增加反应物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
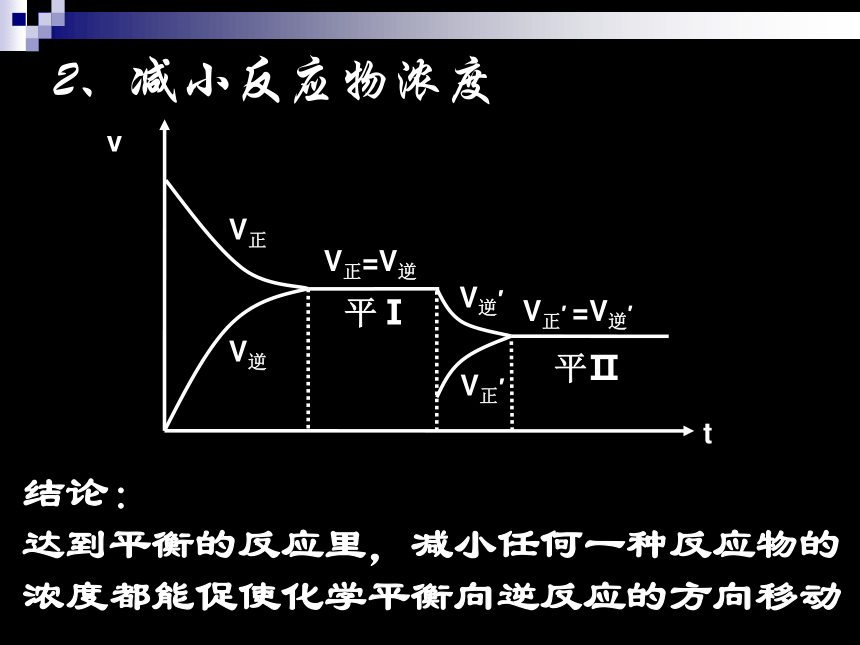
达到平衡的反应里,增加任何一种反应物的浓度都能促使化学平衡向正反应的方向移动少量NaOH溶液V正V逆V正′V逆′2、减小反应物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
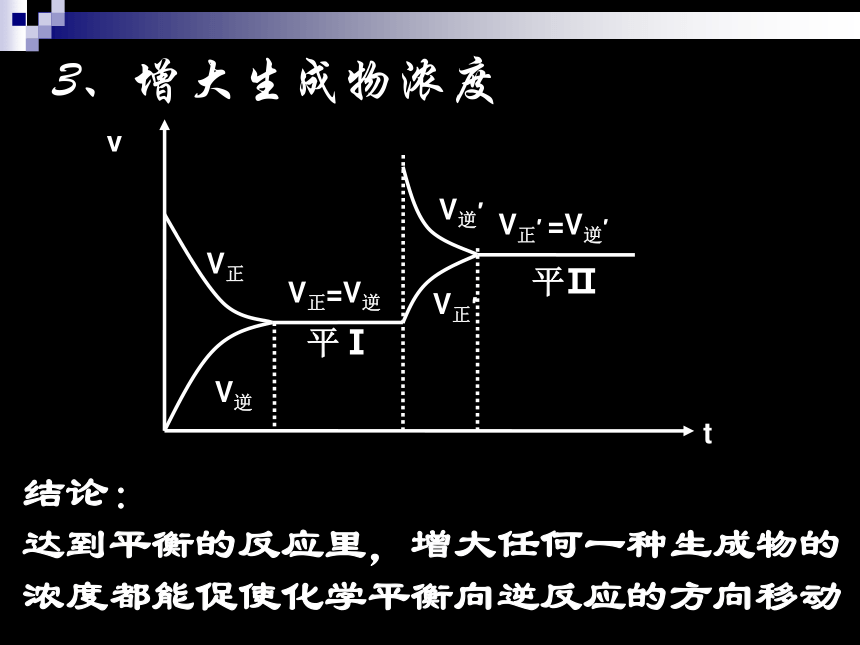
达到平衡的反应里,减小任何一种反应物的浓度都能促使化学平衡向逆反应的方向移动V正V逆V正′V逆′3、增大生成物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
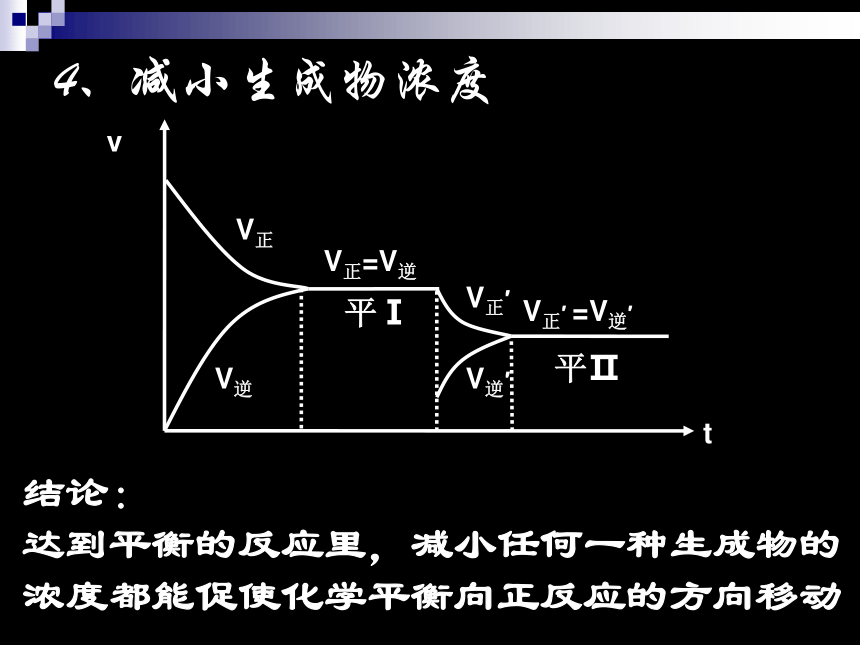
达到平衡的反应里,增大任何一种生成物的浓度都能促使化学平衡向逆反应的方向移动4、减小生成物浓度V正V逆V正′V逆′V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
达到平衡的反应里,减小任何一种生成物的浓度都能促使化学平衡向正反应的方向移动少量水5、反应物,生成物浓度均同时减小 达到平衡后,加水稀释,平衡左移,(向化学计量数大的方向移动)5 、转化率与浓度变化的关系:密闭体系:
增加A的浓度,化学平衡向右移动(正向),B转化率升高,A转化率下降,生成C、D物质的量增加,但是物质的量的分数却不一定增加 如果A,B浓度都增加,就要比较系数,看哪种物质浓度增加的多些,另一种物质的转化率上升.例1:20℃,容器体积均为1L的甲、乙两容器,分别充入1gSO2、1gO2和1.5gSO2、1gO2,反应一段时间达到平衡后,二者比较正确的是:
A、化学反应速率 乙>甲
B、平衡后O2浓度 乙>甲
C、SO2转化率 乙>甲
D、平衡后SO2的体积分数乙>甲速率增大速率减小速率增大速率减小V正> V逆V逆> V正V逆> V正V正> V逆正正逆逆增大增大减小减小增加反应物的浓度或减小产物的浓度,平衡向正反应方向移动 减小反应物的浓度或增加产物的浓度,平衡向逆反应方向移动三)、压强对化学平衡的影响 处于平衡状态的反应混合物里,不管是反应物或是生成物,只要有气态物质存在,那么改变压强也常常会使化学平衡移动1、反应前后气体计量数不等的反应起始 1 3 21atm 2.0%
5atm 9.2%
60atm 53.6%
100atm 69.4%增大压强,对体积缩小的反应有利,减小压强,对体积增大的反应有利。1)加压V正V逆V缩′V增′V正V逆V增′V缩′2)减压平衡向体积缩小的方向移动平衡向体积增大的方向移动 在合成氨工业中,采用高压好,还是低压好?1、往里推,颜色变化:先_____后_____
2、往外拉,颜色变化:先_____后_____2、反应前后气体计量数相等的反应 反应前后体积无变化的反应,增大压强,减小压强均不能使平衡移动1)加压V正V逆V正′= V逆′V正V逆V正′= V逆′2)减压练习:
在固定体积为V的密闭容器中,充入1molH2与1molI2蒸气。已达到平衡后,改变以下条件,判断平衡移动的方向
1)再充入1molH2,2)压缩为V/23、平衡混合物都是固体、液体,改变压强不能使平衡移动因为压强对体积影响小,浓度影响,速率影响均很小m+n=p+qm+n=p+qm+n减小压强
m+n>p+qm+np+q 增大压强A的转化率移动方向反应特点速率变化改变条件mA(g)+nB(g) pC(g)+qD(g)正逆不移动逆V正增大
V逆增大正不移动增大减小不变减小增大不变V正减小
V逆减小结论增大体系的压强,平衡向气体体积减小的方向移动 减小体系的压强,平衡向气体体积增大的方向移动 对于一种物质参加反应的情况来说(分解反应),要看反应前后物质计量数而定反应物的转化率是上升还是下降. (但是对于有气体参加的反应,如果改 变浓度平衡移动方向与改变压强平衡移动方向相冲突时,主要以压强为主来确定) 四) 反应物的转化率与浓度 ,压强变化关系 有多种物质参加(不是一种)反应的情况, 增加一种反应物的浓度,化学平衡向正向移动,另一种反应物转化率升高,这种反应物转化率降低.1、前后计量数相等的反应:2、前后计量数不等的反应:2HI(g) H2(g)+I2(g) 不论如何改变HI浓度,HI的转化率均不变。(平衡不移动)① 加压,平衡不移动② 加入HI,平衡不移动(以压强考虑)③加入H2或I2,平衡逆向移动(HI转化率下降)① 前小后大:(可以逆向写)在密闭体系里,增加NH3的量增加氨气浓度,平衡右移动增加压强时,平衡左移动以压强为准平衡逆向移动,NH3分解率下降② 前大后小:增加NO2浓度加压右移右移颜色先深后浅增加NO2浓度时,NO2转化率升高 结论:
①气体计量数不变的分解反应,改变反应物浓度,转化率不变,平衡不移动
②气体计量数增加的分解反应,增大反应物浓度,平衡朝体积缩小的方向移动,转化率降低(逆向)
③气体计量数减小的分解反应,增大反应物浓度,平衡朝体积缩小的方向移动,转化率升高(正向)例1:在相同条件下(T=500K),容器体积相等的甲、乙两容器,甲充入1gSO2、1gO2乙充入2gSO2、2gO2,反应一段时间达到平衡后,错误的说法是:( )
A、化学反应速率 乙>甲
B、平衡后O2浓度 乙>甲
C、SO2转化率 乙>甲
D、平衡后SO2的体积分数乙>甲1gSO2
1gO21gSO2
1gO21gSO2
1gO2相当于加压平衡正向移动例2:装有1molHI的容器密封并加热,部分HI分解成H2和I2,并达到平衡,此时I2的体积百分率为x%,若在该容器中加入2molHI后封住,加热到相同温度使之平衡,设此时I2的体积百分率为y%,,则x与y的关系为……( )A x >y B x<y C x=y D x≥yC例3:装有1molNH3的容器密封并加热,部分NH3分解并达到平衡,此时混合气中NH3的体积百分率为x%,若在同一容器中加入2molNH3后封住,加热到相同温度使之平衡,设此时NH3的体积百分率为y%,,则x与y的关系为……( )A x >y B x<y C x=y D x≥y
如果一个可逆反应达到平衡状态以后,反应条件(浓度、压强、温度)改变了,平衡混合物是各组成的含量也就随着改变,而达到新平衡状态2、特征旧的化学平衡原平衡被破坏条件改变一定时间新的化学平衡 新平衡状态和原平衡状态相比,反应混合物中各组分的含量是不相同的化学平衡的移动的原因:外界条件的改变;
平衡的移动的结果:原平衡混合物中各组分的含量发生变化二)浓度对化学平衡的影响10mL0.01mol/L
的FeCl3溶液1号3号2号少量1mol/L
FeCl3溶液少量1mol/L
KSCN溶液V正V逆V正′V逆′1、增加反应物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
达到平衡的反应里,增加任何一种反应物的浓度都能促使化学平衡向正反应的方向移动少量NaOH溶液V正V逆V正′V逆′2、减小反应物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
达到平衡的反应里,减小任何一种反应物的浓度都能促使化学平衡向逆反应的方向移动V正V逆V正′V逆′3、增大生成物浓度V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
达到平衡的反应里,增大任何一种生成物的浓度都能促使化学平衡向逆反应的方向移动4、减小生成物浓度V正V逆V正′V逆′V正=V逆平Ⅰ平ⅡV正′ =V逆′结论:
达到平衡的反应里,减小任何一种生成物的浓度都能促使化学平衡向正反应的方向移动少量水5、反应物,生成物浓度均同时减小 达到平衡后,加水稀释,平衡左移,(向化学计量数大的方向移动)5 、转化率与浓度变化的关系:密闭体系:
增加A的浓度,化学平衡向右移动(正向),B转化率升高,A转化率下降,生成C、D物质的量增加,但是物质的量的分数却不一定增加 如果A,B浓度都增加,就要比较系数,看哪种物质浓度增加的多些,另一种物质的转化率上升.例1:20℃,容器体积均为1L的甲、乙两容器,分别充入1gSO2、1gO2和1.5gSO2、1gO2,反应一段时间达到平衡后,二者比较正确的是:
A、化学反应速率 乙>甲
B、平衡后O2浓度 乙>甲
C、SO2转化率 乙>甲
D、平衡后SO2的体积分数乙>甲速率增大速率减小速率增大速率减小V正> V逆V逆> V正V逆> V正V正> V逆正正逆逆增大增大减小减小增加反应物的浓度或减小产物的浓度,平衡向正反应方向移动 减小反应物的浓度或增加产物的浓度,平衡向逆反应方向移动三)、压强对化学平衡的影响 处于平衡状态的反应混合物里,不管是反应物或是生成物,只要有气态物质存在,那么改变压强也常常会使化学平衡移动1、反应前后气体计量数不等的反应起始 1 3 21atm 2.0%
5atm 9.2%
60atm 53.6%
100atm 69.4%增大压强,对体积缩小的反应有利,减小压强,对体积增大的反应有利。1)加压V正V逆V缩′V增′V正V逆V增′V缩′2)减压平衡向体积缩小的方向移动平衡向体积增大的方向移动 在合成氨工业中,采用高压好,还是低压好?1、往里推,颜色变化:先_____后_____
2、往外拉,颜色变化:先_____后_____2、反应前后气体计量数相等的反应 反应前后体积无变化的反应,增大压强,减小压强均不能使平衡移动1)加压V正V逆V正′= V逆′V正V逆V正′= V逆′2)减压练习:
在固定体积为V的密闭容器中,充入1molH2与1molI2蒸气。已达到平衡后,改变以下条件,判断平衡移动的方向
1)再充入1molH2,2)压缩为V/23、平衡混合物都是固体、液体,改变压强不能使平衡移动因为压强对体积影响小,浓度影响,速率影响均很小m+n=p+qm+n=p+qm+n
m+n>p+qm+n
V逆增大正不移动增大减小不变减小增大不变V正减小
V逆减小结论增大体系的压强,平衡向气体体积减小的方向移动 减小体系的压强,平衡向气体体积增大的方向移动 对于一种物质参加反应的情况来说(分解反应),要看反应前后物质计量数而定反应物的转化率是上升还是下降. (但是对于有气体参加的反应,如果改 变浓度平衡移动方向与改变压强平衡移动方向相冲突时,主要以压强为主来确定) 四) 反应物的转化率与浓度 ,压强变化关系 有多种物质参加(不是一种)反应的情况, 增加一种反应物的浓度,化学平衡向正向移动,另一种反应物转化率升高,这种反应物转化率降低.1、前后计量数相等的反应:2、前后计量数不等的反应:2HI(g) H2(g)+I2(g) 不论如何改变HI浓度,HI的转化率均不变。(平衡不移动)① 加压,平衡不移动② 加入HI,平衡不移动(以压强考虑)③加入H2或I2,平衡逆向移动(HI转化率下降)① 前小后大:(可以逆向写)在密闭体系里,增加NH3的量增加氨气浓度,平衡右移动增加压强时,平衡左移动以压强为准平衡逆向移动,NH3分解率下降② 前大后小:增加NO2浓度加压右移右移颜色先深后浅增加NO2浓度时,NO2转化率升高 结论:
①气体计量数不变的分解反应,改变反应物浓度,转化率不变,平衡不移动
②气体计量数增加的分解反应,增大反应物浓度,平衡朝体积缩小的方向移动,转化率降低(逆向)
③气体计量数减小的分解反应,增大反应物浓度,平衡朝体积缩小的方向移动,转化率升高(正向)例1:在相同条件下(T=500K),容器体积相等的甲、乙两容器,甲充入1gSO2、1gO2乙充入2gSO2、2gO2,反应一段时间达到平衡后,错误的说法是:( )
A、化学反应速率 乙>甲
B、平衡后O2浓度 乙>甲
C、SO2转化率 乙>甲
D、平衡后SO2的体积分数乙>甲1gSO2
1gO21gSO2
1gO21gSO2
1gO2相当于加压平衡正向移动例2:装有1molHI的容器密封并加热,部分HI分解成H2和I2,并达到平衡,此时I2的体积百分率为x%,若在该容器中加入2molHI后封住,加热到相同温度使之平衡,设此时I2的体积百分率为y%,,则x与y的关系为……( )A x >y B x<y C x=y D x≥yC例3:装有1molNH3的容器密封并加热,部分NH3分解并达到平衡,此时混合气中NH3的体积百分率为x%,若在同一容器中加入2molNH3后封住,加热到相同温度使之平衡,设此时NH3的体积百分率为y%,,则x与y的关系为……( )A x >y B x<y C x=y D x≥y
