元素第一电离能的周期性变化[上学期]
图片预览


文档简介
课件6张PPT。元素性质的递变规律物质结构与性质
专题二 第二单元:元素第一电离能的周期性变化电离能 电离能反映了原子失去电子倾向的大小。电离能越大,越难失去电子。 气态原子失去一个电子形成+1价气态阳离子所需的最低能量,叫做该元素的第一电离能,用符号I1表示,失去第二个电子所需要的能量叫做第二电离能I2……
M(g,基态)→M+(g)+ e I1
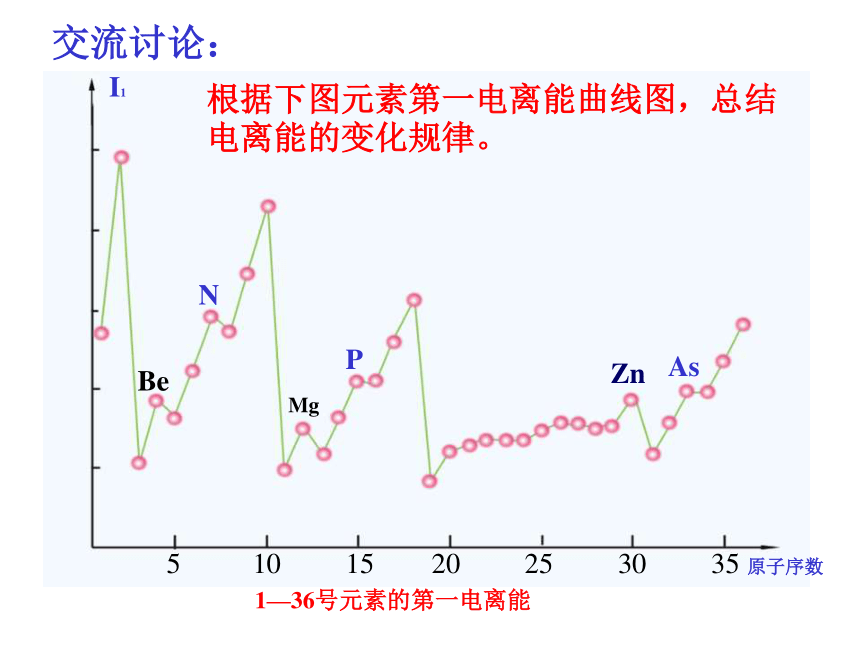
M+(g,基态)→M2+(g)+ e I2交流讨论:根据下图元素第一电离能曲线图,总结电离能的变化规律。NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能电离能的变化规律:
同周期,主族元素从左到右,电离能呈逐渐增大的趋势;
同主族,主族元素从上到下,电离能逐渐减小;
特殊: IBe>IB, IMg>IAl
IN>Io, IP>IS,
IZn>IGa钠、镁、铝的逐级电离能数据表电离能及应用M(g) –e- = M+(g) △H=I1 电离能是原子核外电子分层排布的实验验证。
第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。
元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。
专题二 第二单元:元素第一电离能的周期性变化电离能 电离能反映了原子失去电子倾向的大小。电离能越大,越难失去电子。 气态原子失去一个电子形成+1价气态阳离子所需的最低能量,叫做该元素的第一电离能,用符号I1表示,失去第二个电子所需要的能量叫做第二电离能I2……
M(g,基态)→M+(g)+ e I1
M+(g,基态)→M2+(g)+ e I2交流讨论:根据下图元素第一电离能曲线图,总结电离能的变化规律。NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能电离能的变化规律:
同周期,主族元素从左到右,电离能呈逐渐增大的趋势;
同主族,主族元素从上到下,电离能逐渐减小;
特殊: IBe>IB, IMg>IAl
IN>Io, IP>IS,
IZn>IGa钠、镁、铝的逐级电离能数据表电离能及应用M(g) –e- = M+(g) △H=I1 电离能是原子核外电子分层排布的实验验证。
第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。
元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。
