元素电负性的周期性变化[上学期]
图片预览


文档简介
课件6张PPT。元素性质的递变规律物质结构与性质
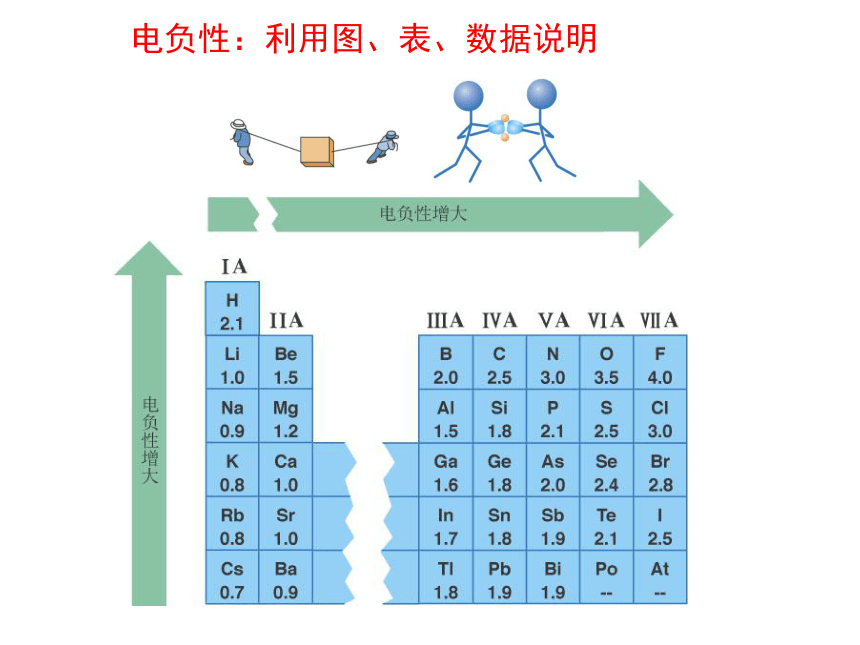
专题二 第二单元:元素电负性的周期性变化元素的电负性(X) 鲍林(L.Pauling)首先提出了元素的电负性的概念,并指出:电负性就是表示某元素原子在化合物分子中吸引成键电子能力大小的相对数值。根据热化学数据建立了元素的定量标度,指定氟的电负性为4.0,然后求出其它元素的电负性。电负性:利用图、表、数据说明 元素电负性的变化规律:
同周期,从左到右,电负性增加;
同族,从上到下,电负性下降;1 元素的金属性的判别
一般来说金属元素的电负性在1.8以下,非金属元素的电负性在1.8以上,利用电负性这一概念,结合其它键参数可以判断不同元素的原子(或离子)之间相互结合形成化合键的类型。
2 化学键型判别
电负性相差较大(△x≥1.7)的两种元素的原子结合形成化合物, 通常形成离子键。电负性相差较小(△x<1.7)的两种元素的原子结合形成化合物, 通常形成共价键,且电负性不相等的元素原子间一般形成极性共价健。
3 判断分子中元素的正负化合价:
X 大者,化合价为负;
X 小者, 化合价 为正;
△X = 0, 化合价 为零;
电负性及其应用位、构、性三者关系
专题二 第二单元:元素电负性的周期性变化元素的电负性(X) 鲍林(L.Pauling)首先提出了元素的电负性的概念,并指出:电负性就是表示某元素原子在化合物分子中吸引成键电子能力大小的相对数值。根据热化学数据建立了元素的定量标度,指定氟的电负性为4.0,然后求出其它元素的电负性。电负性:利用图、表、数据说明 元素电负性的变化规律:
同周期,从左到右,电负性增加;
同族,从上到下,电负性下降;1 元素的金属性的判别
一般来说金属元素的电负性在1.8以下,非金属元素的电负性在1.8以上,利用电负性这一概念,结合其它键参数可以判断不同元素的原子(或离子)之间相互结合形成化合键的类型。
2 化学键型判别
电负性相差较大(△x≥1.7)的两种元素的原子结合形成化合物, 通常形成离子键。电负性相差较小(△x<1.7)的两种元素的原子结合形成化合物, 通常形成共价键,且电负性不相等的元素原子间一般形成极性共价健。
3 判断分子中元素的正负化合价:
X 大者,化合价为负;
X 小者, 化合价 为正;
△X = 0, 化合价 为零;
电负性及其应用位、构、性三者关系
