高一化学必修2第二章教材分析[下学期]
文档属性
| 名称 | 高一化学必修2第二章教材分析[下学期] |
|
|
| 格式 | rar | ||
| 文件大小 | 19.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-05 00:00:00 | ||
图片预览


文档简介
第二章 《化学反应与能量》教材分析
一、教材的编排特点和主线
1.主要内容
(1)了解化学键的断裂、形成与化学反应中能量变化的关系。
(2)通过实例和实验了解能量的转化,在已知化学反应中质量守恒基础上,建立“能量也是守恒”的观点。了解化学能转化为热能在生产、生活中的应用及其对人类文明发展的贡献。
(3)通过实验和实例了解化学能与电能的转化关系。初步认识原电池概念、原理、组成及应用。通过介绍新型电池体现化学电池的改进和创新,初步形成科学技术的发展观。
(4)通过实验认识化学反应的速率和化学反应的限度,初步掌握影响化学反应速率的外界因素。了解控制反应条件在生产和科研中的作用。
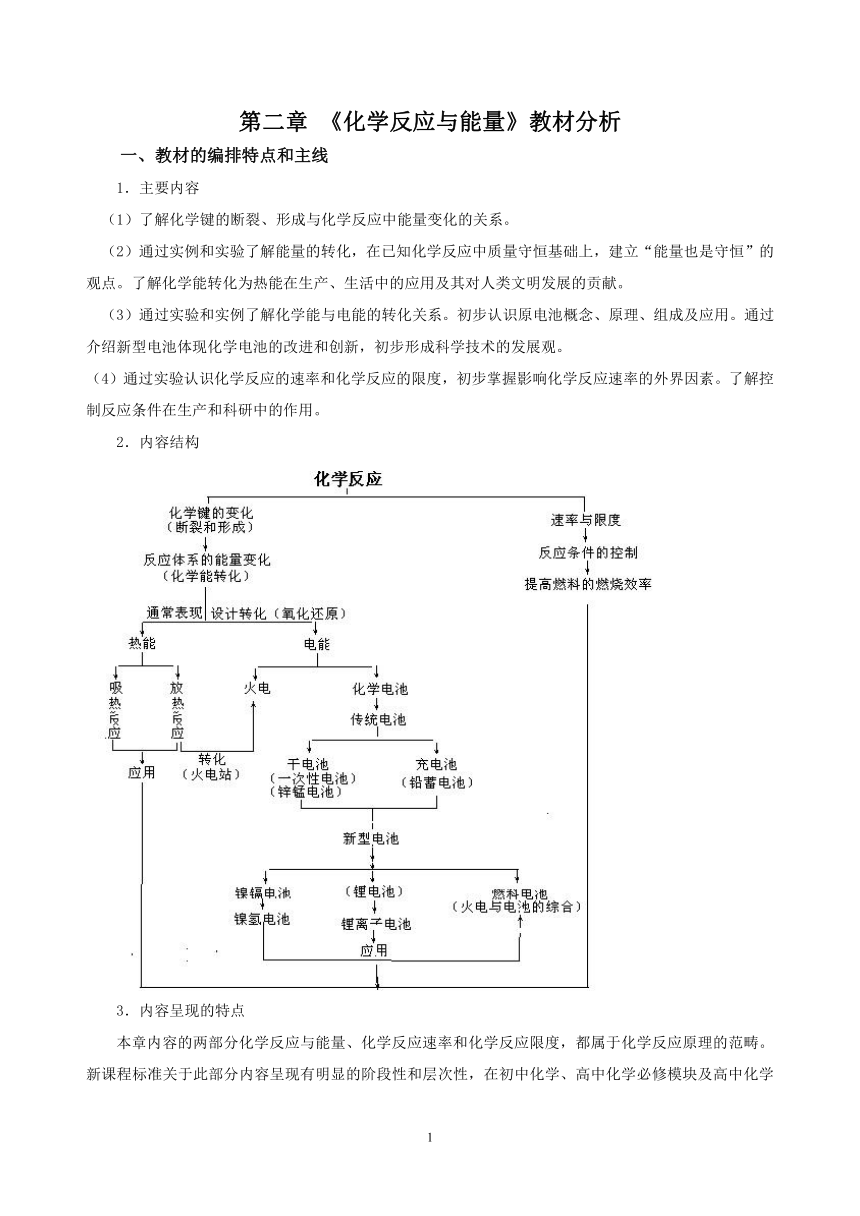
2.内容结构
3.内容呈现的特点
本章内容的两部分化学反应与能量、化学反应速率和化学反应限度,都属于化学反应原理的范畴。新课程标准关于此部分内容呈现有明显的阶段性和层次性,在初中化学、高中化学必修模块及高中化学选修模块中均有出现,在初中化学已从燃烧的角度初步涉及了“化学与能源”的一些知识,在选修模块“化学反应原理”中,将从科学概念的层面和定量的角度比较深入地学习。
对于化学反应的认识在必修1、必修2教材中,按以下方面进行呈现的:知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。知道化学键的断裂和形成是化学反应中能量变化的主要原因。举例说明化学能与电能的转化关系及其应用。通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
在本章中,教材结合实验,让感受化学能与热能的相互转化,通过一定数据理解化学反应中能量变化的主要原因是化学键的断裂和形成。利用学生已有的初中燃烧知识的学习经验,结合实验和实例,从学生熟悉的煤燃烧发电原理体会化学能向热能、电能的转化,通过实验引入化学能直接转化为电能的装置——原电池,初步认识原电池的化学原理和结构,为部分同学将来的选修打下基础,但并不要求学生总结其规律性。关于化学反应速率和限度,教材仍然是通过生活实例与实验,让学生对化学反应速率及影响因素和化学反应限度有定性的认识,有关定量计算及一些概念则放在选修模块再学习。
二、教学目标
知识与技能 1.了解化学键的断裂和形成是化学反应中能量变化的主要原因——化学键的断裂要吸收能量,化学键的形成要放出能量。2.了解化学反应过程中质量守恒,能量也守恒。了解吸热反应和放热反应的概念3.通过生产、生活实例了解化学能与热能的相互转化4.了解化学能与电能的转化关系及其应用。初步认识原电池概念、原理、组成及应用,书写简单原电池电极反应方程式。5.通过试验认识化学反应速率的概念,知道温度、浓度、反应物状态、催化剂等因素对一个化学反应速率的影响。6.通过试验认识到任何化学反应的进程都有一定的限度,可以通过改变反应条件控制化学反应的限度7.了解控制反应条件在生产和科学研究中的作用
过程与方法 1.通过教材中实验了解化学能与热能、化学能与电能的转化。2.通过对原电池的设计及实验探究,总结出原电池的组成条件。使学生了解探究学习是建构化学核心观念的有效途径。掌握科学的学习方法。3.通过“提高煤的燃烧效率”的课题研究,使学生在阅读、查阅资料、反思、讨论和概括等过程中,提高自主学习的主动性,培养学生获取知识及信息加工能力。
情感态度与价值观 1.体会通过实验认识和研究化学反应原理的方法和价值。2.通过本章的许多实例,认识并欣赏化学科学对提高人类生活质量和促进社会发展的重大作用。感受到化学学习的乐趣。增进学生对化学的兴趣与情感,体会化学的价值3.通过对新型电池与常见电池的了解,体会原电池的改进与创新,形成科学技术的发展观。4.通过课堂讨论活动学习与人合作与交流,共同研究、探讨科学问题。
三、教学建议
高中化学新课程改革,打破了按化学科学体系组织化学教学内容的传统课程结构,对化学课程体系进行了重新改组,使不同的学生能学习不同的化学课程模块。各课程模块都注重激发学生的学习兴趣,贴近社会生活,让学生在实践活动中,主动地学习知识、技能和方法,形成正确的价值观和社会责任感。这种变化也要求化学教学方式必须改变长期以来教师过分依赖系统讲授和强化训练的教学方式,着重开发和使用讲授、讨论、合作、探究性、网络等各种各样的适合中学生心理发展特点的教学的方式和手段,让学生在生动的探究活动过程中学习、体验和应用科学。
1.注意发挥实验功能,帮助学生建构化学核心观念
本章内容的核心观念是:在初中的基础上进一步发展物质的微粒观,初步建立起以化学键为中心的化学反应及其能量变化的微观认识框架,扩展对于化学反应的认识,认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
主题的学习要求不高,但是比较强调观念的建构对化学反应的认识发展。本章共有7个实验,一个科学探究。这些实验对学生建构知识体系很有帮助,例如学生对能量的转化就可以直接来自于实验的感受,教学中应充分发挥实验的教育功能,认真对待每一个实验验,有条件的学校尽量开设学生实验,让学生体会从实验事实分析上升到理论认识的思维方法与过程。[中和反应与中和热的测定是课标中建议的探究活动,但整个人教版教材并没有安排实验(山东版和江苏版在《化学反应原理》中都安排了实验),而是在P30的“思考与交流”中要求进行实验设计,这里不但涉及到实验装置设计,还有操作设计,建议在做好实验2-3的基础上,认真组织学生讨论,由于学生缺乏相关的物理知识,可把问题转化为“设计实验准确测定盐酸与氢氧化钠溶液反应生成1molH2O时的温度变化”]
2.严格控制必修课程知识内容的深广度,保护学生的学习积极性
课程标准的教学要求是螺旋上升的,对于《高中化学标准》中不同模块都出现的内容,特别要注意目标要求的水平差异,准确把握内容的不同要求。本章内容在选修模块中将会再次出现,在教学过程中,要避免一步到位的做法,人为造成学生学习困难。例如:原电池的电极反应的书写,仅要求学生会写最基本的(铜、锌原电池)电极反应式,目的是助学生理解原电池中化学能与电能转化,甚至可以不提“电极反应式”这个名词。在山东版中就没有出现电极反应式。再例如:反应速率和化学反应限度的教学处理,反应速率和反应限度的概念,是首次进入面向全体学生的必修课程,在选修教材中学生将会系统地进行学习,因此此部分内容教师一定要把握好深度、难度。尤其是化学反应限度,知识技能目标仅要求学生通过试验认识到任何化学反应的进程都有一定的限度,可以通过改变反应条件控制化学反应的限度,不宜拓展化学平衡的概念,化学平衡状态的判断、化学平衡的移动知识,本人认为教参对此部分知识要求过高。
在控制教学内容和教学要求的深广度时要合理借鉴其他版本教材要求。以课程标准为最高指导,以三套教材的共同部分为基本要求,以有利于学生对知识的理解和接受为原则,为结合自己学生实际,参考其他教材。如化学反应中能量变化的定量计算,虽然其他两个版本都涉及热化学方程式的简单计算,但课标中并没要求,且拓展后学生负担明显增加,这时就不应拓展,况且有兴趣的同学在《化学反应原理》中还将继续学习相关内容。而关于化学反应速率及其影响因素的教学中,江苏版教材中“一定温度下,测量6%H2O2在氯化铜溶液催化作用下分解的速率,并画出时间-速率曲线图”的活动让学生真切体会浓度对反应速率的影响,同时对化学反应过程中速率的变化有了感性的认识,有利于学生理解化学反应的限度问题,建议有条件的学校增加该探究实验。
3.联系生活实际和生产实际,欣赏化学科学对促进社会发展的重大作用
本章教材中涉及大量实例,反映化学学科与个人、与工农业生产、社会发展以及科学技术之间的相互影响和相互联系。教学中应充分利用这些素材,培养学生学以致用的意识和能力,让学生体会和感受化学科学对提高人类生活质量和促进社会发展的重大作用,热爱科学,这也是培养学生情感态度价值观的有效途径和生动载体。
4.重视基础知识的落实,保证教学质量
在新课标中强调了过程与方法、情感态度价值观,原因是旧教材中过于强调了知识与技能,但我们切不要矫枉过正,知识与技能仍是我们的教学目标之一,本章中有许多的实验、实例和图片,在组织好学生活动的同时,一定要重视知识的落实。如:放热反应、吸热反应与生成物、反应物化学能成怎样的关系,原电池的组成条件。影响化学反应速率的条件等等。
四、课时安排
第一节 化学能与热能(2课时)
第2节 化学能与电能(2课时)
第3节 化学反应速率与限度(3课时)
复习、测验、讲评(各1课时)
附件:某些知识在三套教材中的比较
人教版 山东版 江苏版
化学反应中的能量变化与化学键的关系 叙述H2、CH4的断裂与形成过程中能量的变化 通过交流与讨论的形式研究反应2H2+O2==2H2O中的能量变化
化学反应中能量变化的定量计算 没有定量计算,在作业中涉及定性判断 习题中设计定量判断 涉及热化学方程式及其简单计算
原电池 提出原电池的概念 写出铜、锌原电池的电极反应式 在“化学反应的应用”中探究铜、锌原电池的原电池的工作原理,没有明确提出原电池概念,无电极反应式 提出原电池的概念写出铜、锌原电池的电极反应式
影响化学反应速率因素 只给出温度和催化剂的影响的实验 通过实验探究自己归纳总结影响化学反应速率的因素。并通过实验测定不同催化剂对H2O2分解速率的影响。 给出温度、催化剂、浓度的影响实验,同时测量6%H2O2在一定温度下分解的速率,并画出时间-速率曲线图
化学反应限度 没有提出化学平衡、化学平衡移动概念, 提出可逆反应、化学平衡、化学平衡移动概念。 提出可逆反应、化学平衡状态的概念。
PAGE
1
一、教材的编排特点和主线
1.主要内容
(1)了解化学键的断裂、形成与化学反应中能量变化的关系。
(2)通过实例和实验了解能量的转化,在已知化学反应中质量守恒基础上,建立“能量也是守恒”的观点。了解化学能转化为热能在生产、生活中的应用及其对人类文明发展的贡献。
(3)通过实验和实例了解化学能与电能的转化关系。初步认识原电池概念、原理、组成及应用。通过介绍新型电池体现化学电池的改进和创新,初步形成科学技术的发展观。
(4)通过实验认识化学反应的速率和化学反应的限度,初步掌握影响化学反应速率的外界因素。了解控制反应条件在生产和科研中的作用。
2.内容结构
3.内容呈现的特点
本章内容的两部分化学反应与能量、化学反应速率和化学反应限度,都属于化学反应原理的范畴。新课程标准关于此部分内容呈现有明显的阶段性和层次性,在初中化学、高中化学必修模块及高中化学选修模块中均有出现,在初中化学已从燃烧的角度初步涉及了“化学与能源”的一些知识,在选修模块“化学反应原理”中,将从科学概念的层面和定量的角度比较深入地学习。
对于化学反应的认识在必修1、必修2教材中,按以下方面进行呈现的:知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。知道化学键的断裂和形成是化学反应中能量变化的主要原因。举例说明化学能与电能的转化关系及其应用。通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
在本章中,教材结合实验,让感受化学能与热能的相互转化,通过一定数据理解化学反应中能量变化的主要原因是化学键的断裂和形成。利用学生已有的初中燃烧知识的学习经验,结合实验和实例,从学生熟悉的煤燃烧发电原理体会化学能向热能、电能的转化,通过实验引入化学能直接转化为电能的装置——原电池,初步认识原电池的化学原理和结构,为部分同学将来的选修打下基础,但并不要求学生总结其规律性。关于化学反应速率和限度,教材仍然是通过生活实例与实验,让学生对化学反应速率及影响因素和化学反应限度有定性的认识,有关定量计算及一些概念则放在选修模块再学习。
二、教学目标
知识与技能 1.了解化学键的断裂和形成是化学反应中能量变化的主要原因——化学键的断裂要吸收能量,化学键的形成要放出能量。2.了解化学反应过程中质量守恒,能量也守恒。了解吸热反应和放热反应的概念3.通过生产、生活实例了解化学能与热能的相互转化4.了解化学能与电能的转化关系及其应用。初步认识原电池概念、原理、组成及应用,书写简单原电池电极反应方程式。5.通过试验认识化学反应速率的概念,知道温度、浓度、反应物状态、催化剂等因素对一个化学反应速率的影响。6.通过试验认识到任何化学反应的进程都有一定的限度,可以通过改变反应条件控制化学反应的限度7.了解控制反应条件在生产和科学研究中的作用
过程与方法 1.通过教材中实验了解化学能与热能、化学能与电能的转化。2.通过对原电池的设计及实验探究,总结出原电池的组成条件。使学生了解探究学习是建构化学核心观念的有效途径。掌握科学的学习方法。3.通过“提高煤的燃烧效率”的课题研究,使学生在阅读、查阅资料、反思、讨论和概括等过程中,提高自主学习的主动性,培养学生获取知识及信息加工能力。
情感态度与价值观 1.体会通过实验认识和研究化学反应原理的方法和价值。2.通过本章的许多实例,认识并欣赏化学科学对提高人类生活质量和促进社会发展的重大作用。感受到化学学习的乐趣。增进学生对化学的兴趣与情感,体会化学的价值3.通过对新型电池与常见电池的了解,体会原电池的改进与创新,形成科学技术的发展观。4.通过课堂讨论活动学习与人合作与交流,共同研究、探讨科学问题。
三、教学建议
高中化学新课程改革,打破了按化学科学体系组织化学教学内容的传统课程结构,对化学课程体系进行了重新改组,使不同的学生能学习不同的化学课程模块。各课程模块都注重激发学生的学习兴趣,贴近社会生活,让学生在实践活动中,主动地学习知识、技能和方法,形成正确的价值观和社会责任感。这种变化也要求化学教学方式必须改变长期以来教师过分依赖系统讲授和强化训练的教学方式,着重开发和使用讲授、讨论、合作、探究性、网络等各种各样的适合中学生心理发展特点的教学的方式和手段,让学生在生动的探究活动过程中学习、体验和应用科学。
1.注意发挥实验功能,帮助学生建构化学核心观念
本章内容的核心观念是:在初中的基础上进一步发展物质的微粒观,初步建立起以化学键为中心的化学反应及其能量变化的微观认识框架,扩展对于化学反应的认识,认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。
主题的学习要求不高,但是比较强调观念的建构对化学反应的认识发展。本章共有7个实验,一个科学探究。这些实验对学生建构知识体系很有帮助,例如学生对能量的转化就可以直接来自于实验的感受,教学中应充分发挥实验的教育功能,认真对待每一个实验验,有条件的学校尽量开设学生实验,让学生体会从实验事实分析上升到理论认识的思维方法与过程。[中和反应与中和热的测定是课标中建议的探究活动,但整个人教版教材并没有安排实验(山东版和江苏版在《化学反应原理》中都安排了实验),而是在P30的“思考与交流”中要求进行实验设计,这里不但涉及到实验装置设计,还有操作设计,建议在做好实验2-3的基础上,认真组织学生讨论,由于学生缺乏相关的物理知识,可把问题转化为“设计实验准确测定盐酸与氢氧化钠溶液反应生成1molH2O时的温度变化”]
2.严格控制必修课程知识内容的深广度,保护学生的学习积极性
课程标准的教学要求是螺旋上升的,对于《高中化学标准》中不同模块都出现的内容,特别要注意目标要求的水平差异,准确把握内容的不同要求。本章内容在选修模块中将会再次出现,在教学过程中,要避免一步到位的做法,人为造成学生学习困难。例如:原电池的电极反应的书写,仅要求学生会写最基本的(铜、锌原电池)电极反应式,目的是助学生理解原电池中化学能与电能转化,甚至可以不提“电极反应式”这个名词。在山东版中就没有出现电极反应式。再例如:反应速率和化学反应限度的教学处理,反应速率和反应限度的概念,是首次进入面向全体学生的必修课程,在选修教材中学生将会系统地进行学习,因此此部分内容教师一定要把握好深度、难度。尤其是化学反应限度,知识技能目标仅要求学生通过试验认识到任何化学反应的进程都有一定的限度,可以通过改变反应条件控制化学反应的限度,不宜拓展化学平衡的概念,化学平衡状态的判断、化学平衡的移动知识,本人认为教参对此部分知识要求过高。
在控制教学内容和教学要求的深广度时要合理借鉴其他版本教材要求。以课程标准为最高指导,以三套教材的共同部分为基本要求,以有利于学生对知识的理解和接受为原则,为结合自己学生实际,参考其他教材。如化学反应中能量变化的定量计算,虽然其他两个版本都涉及热化学方程式的简单计算,但课标中并没要求,且拓展后学生负担明显增加,这时就不应拓展,况且有兴趣的同学在《化学反应原理》中还将继续学习相关内容。而关于化学反应速率及其影响因素的教学中,江苏版教材中“一定温度下,测量6%H2O2在氯化铜溶液催化作用下分解的速率,并画出时间-速率曲线图”的活动让学生真切体会浓度对反应速率的影响,同时对化学反应过程中速率的变化有了感性的认识,有利于学生理解化学反应的限度问题,建议有条件的学校增加该探究实验。
3.联系生活实际和生产实际,欣赏化学科学对促进社会发展的重大作用
本章教材中涉及大量实例,反映化学学科与个人、与工农业生产、社会发展以及科学技术之间的相互影响和相互联系。教学中应充分利用这些素材,培养学生学以致用的意识和能力,让学生体会和感受化学科学对提高人类生活质量和促进社会发展的重大作用,热爱科学,这也是培养学生情感态度价值观的有效途径和生动载体。
4.重视基础知识的落实,保证教学质量
在新课标中强调了过程与方法、情感态度价值观,原因是旧教材中过于强调了知识与技能,但我们切不要矫枉过正,知识与技能仍是我们的教学目标之一,本章中有许多的实验、实例和图片,在组织好学生活动的同时,一定要重视知识的落实。如:放热反应、吸热反应与生成物、反应物化学能成怎样的关系,原电池的组成条件。影响化学反应速率的条件等等。
四、课时安排
第一节 化学能与热能(2课时)
第2节 化学能与电能(2课时)
第3节 化学反应速率与限度(3课时)
复习、测验、讲评(各1课时)
附件:某些知识在三套教材中的比较
人教版 山东版 江苏版
化学反应中的能量变化与化学键的关系 叙述H2、CH4的断裂与形成过程中能量的变化 通过交流与讨论的形式研究反应2H2+O2==2H2O中的能量变化
化学反应中能量变化的定量计算 没有定量计算,在作业中涉及定性判断 习题中设计定量判断 涉及热化学方程式及其简单计算
原电池 提出原电池的概念 写出铜、锌原电池的电极反应式 在“化学反应的应用”中探究铜、锌原电池的原电池的工作原理,没有明确提出原电池概念,无电极反应式 提出原电池的概念写出铜、锌原电池的电极反应式
影响化学反应速率因素 只给出温度和催化剂的影响的实验 通过实验探究自己归纳总结影响化学反应速率的因素。并通过实验测定不同催化剂对H2O2分解速率的影响。 给出温度、催化剂、浓度的影响实验,同时测量6%H2O2在一定温度下分解的速率,并画出时间-速率曲线图
化学反应限度 没有提出化学平衡、化学平衡移动概念, 提出可逆反应、化学平衡、化学平衡移动概念。 提出可逆反应、化学平衡状态的概念。
PAGE
1
