化学计量在实验中的应用[上学期]
文档属性
| 名称 | 化学计量在实验中的应用[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-10-04 00:00:00 | ||
图片预览








文档简介
课件85张PPT。第一章从实验学化学 第二节
化学计量在实验中的应用【复习】 熟悉的知识
2H2+O2 2H2O
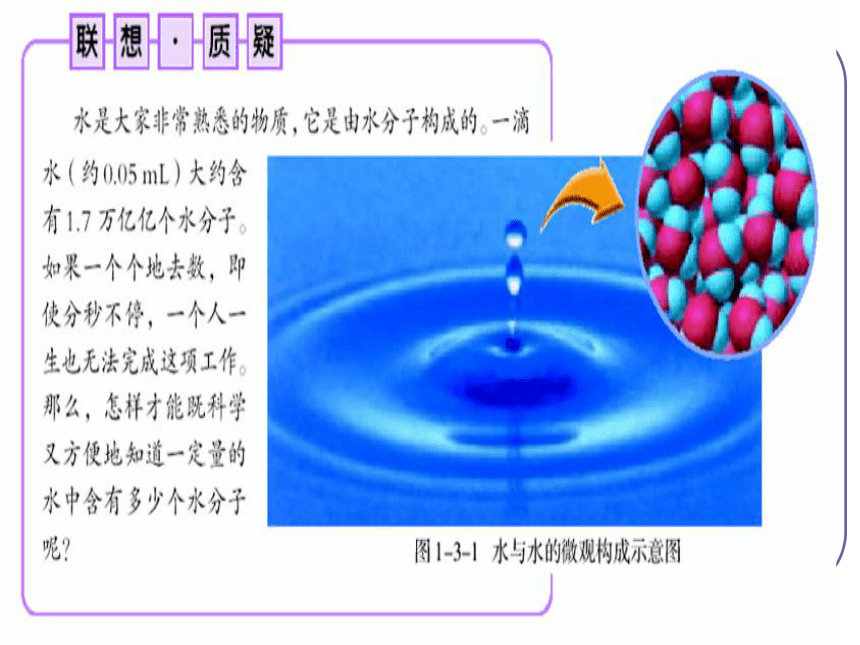
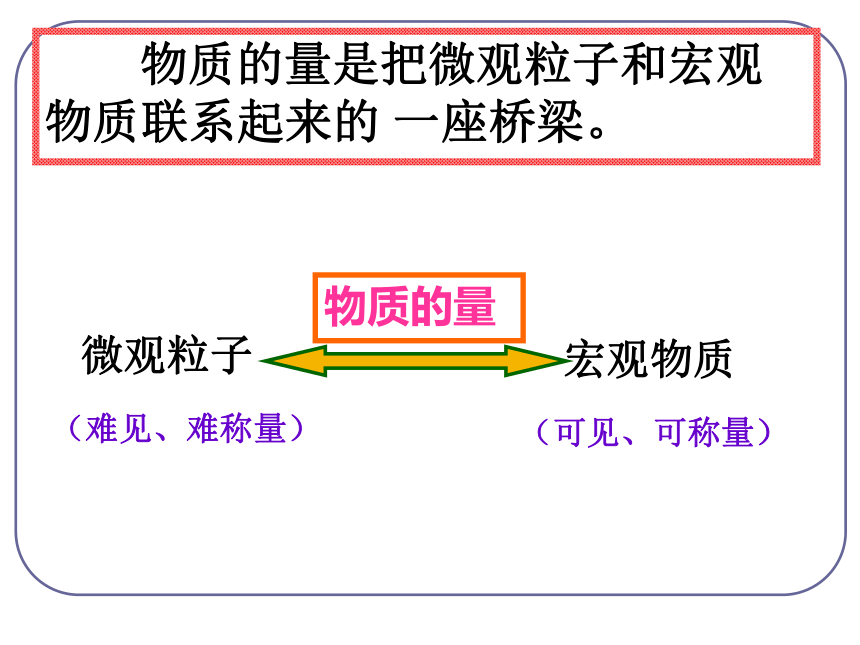
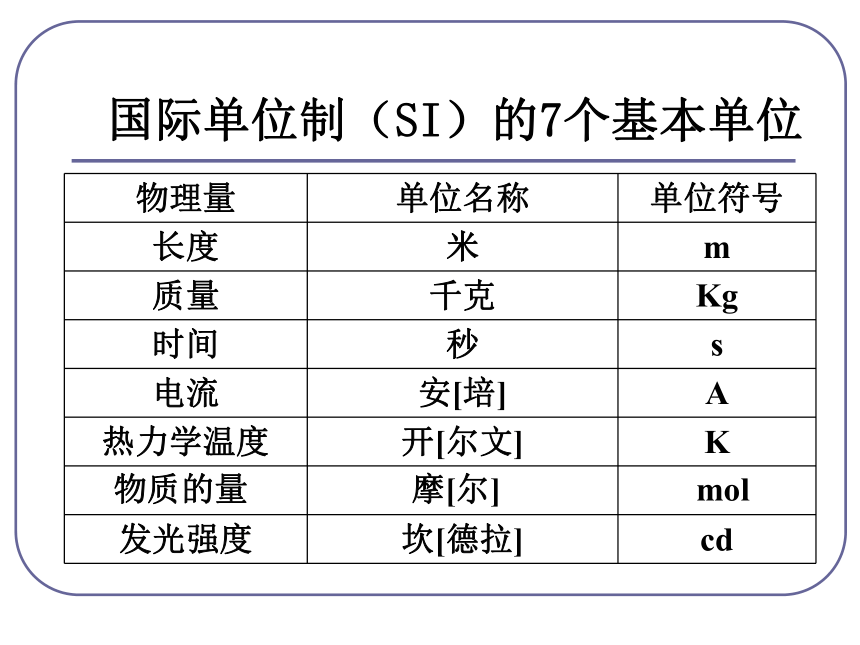
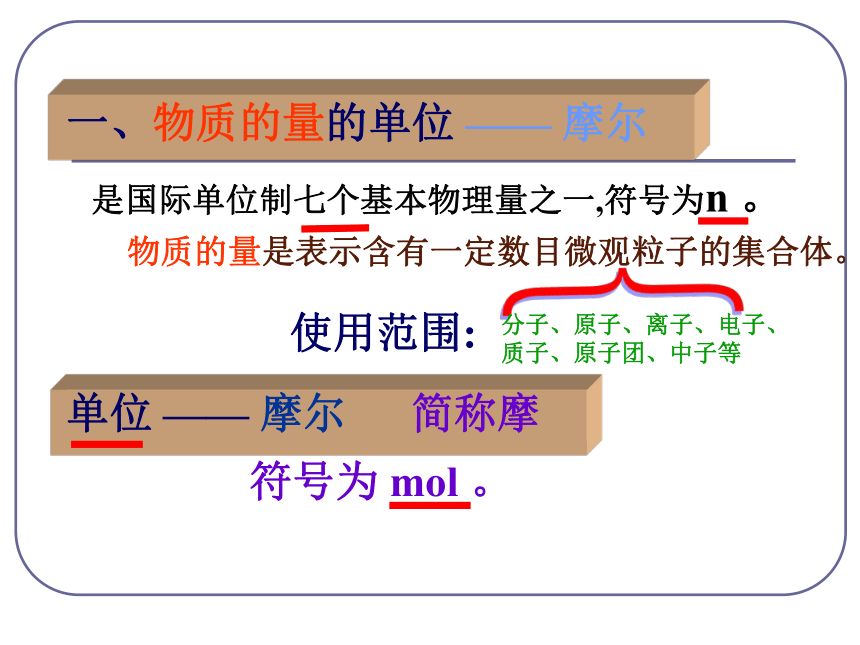
4g 32g 36g 2个 1个 2个质 量比:分子个数比:点燃 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量国际单位制(SI)的7个基本单位物质的量摩[尔]mol 是国际单位制七个基本物理量之一,符号为n 。物质的量是表示含有一定数目微观粒子的集合体。{分子、原子、离子、电子、质子、原子团、中子等一、物质的量的单位 —— 摩尔使用范围:单位 —— 摩尔 简称摩符号为 mol 。生活小常识12支铅笔称一打使用物质的量注意事项:①物质的量这四个字是一个整体,是一个专用名词,不得简化或增添任何字。③物质的量计量的是粒子的集合体,不是单个粒子。
②物质的量只适用于微观粒子,使用摩作单位时,所指粒子必须指明粒子的种类,如原子、分子、离子等。,且粒子的种类一般都要用化学符号表示。
回答问题
物质的量的含义是什么?符号是什么?单位是什么?
【课堂练习】 1.判断正误,并说明理由。
A.1mol氢
B. 1mol CO2
C. 1mol大米错误。没有指出是分子、原子或离子正确。错误。大米不是微观粒子 必须指明粒子的种类,如原子、分子、离子等。注意 (近似值: 6.02ㄨ1023个粒子)
同0.012千克12C中所含的碳原子的数目相同 1摩尔1mol任何粒子的集合体都含有约6.02×1023 个粒子。规定:6.02×1023 mol-1叫做阿伏加德罗常数,它是个物理量,其是单位是mol-1,符号为NA 。2.阿伏加德罗常数 NA≈ 6.02×1023 mol-1?阿伏加德罗常数物质的量粒子个数(约6.02×1023mol-1)N =NA× n物质的量( n ) 、粒子个数( N )和阿伏加德罗常数( NA )三者之间的关系:公式一:n=NNA粒 子个数
(N) ×NA ÷ NA物质的量(n) 变换为 N= n × NA【规律】物质的粒子数之比 = 物质的量之比
例1:在0.5mol O2中含有的氧分子数目
是多少?解:O2的分子数为N = n × NA =0.5 mol× 6.02 ×1023mol-1= 3.01 × 1023 答:O2的分子数为3.01 × 1023个。例2:在0.5mol O2中含有的氧原子数目
是多少?解:O2的氧原子数为N = n ×2 × NA =0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。练习 1 、0.5molH2约含有氢分子数 个2、 1molNaCl约含有氯离子数_____________ 个3 、 1mol硫酸分子约含有氧原子数____________个4、 1. 204?1024 个水分子物质的量为_____mol3.01 ? 10236.02 ? 10232.408 ? 10242
5、2mol CO2中含有 mol C和 mol O,
含有 个CO2分子。
6、 mol H2O中含有的氧原子数
1.5mol CO2中含有的氧原子数相同241.204 ? 10243练习1.判断下列说法是否正确 ,并说明理由。(1)1mol氧。( )(2)0.25molH2O 。( )(3)摩尔是7个基本物理量之一 。( )(4)1mol小麦约含有6.02×1023个麦粒 。( ) (5)0.5molH2 含有3.01×1023 个氢原子。( )(6)3molNH3 中含有3molN原子,9molH原子。
( )×√×××√2.选择题⑴ 摩尔是( )
A.物质的数量单位
B.表示物质的质量单位
C.表示物质的量的单位
D.既是物质的数量单位又是物质的质量单位C(2)0.5molNa2SO4中所含的Na+离子数为( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1B3.填空题 (4)1mol H2SO4中含______________个S原子,_____________个O原子,_____________个H原子,_________ mol O 。(1)1mol O中约含有_______________个O原子;
(2)4mol O2中约含有_________molO原子;
(3)3mol H2SO4中约含_________________个H2SO4 分子,可解离出_______molH+;6.02ㄨ102383×6.02ㄨ102366.02ㄨ10234×6.02ㄨ10232×6.02ㄨ10234(5)1molNaOH中约含有_______molNa+、____molOH-113.摩尔质量定义:单位物质的量(即1mol)的物质所具有的质量叫做该物质的摩尔质量符号:M单位:g · mol-1182712569818g27g12g56g98g结论: 1mol任何粒子或物质的质量以g为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。1、 M(H2O)= 。
2、M( NaCl)= 。
3、M(SO42-)= 。
4 、M(OH-)=_________________练习摩尔质量物质的量质量m = M× n物质的量( n ) 、质量( m )和摩尔质量( M )三者之间的关系:公式二:n=mM质量
(m) ×M ÷ M物质的量(n) 变换为 m= n × M例题、 71gNa2SO4中含有的Na+和SO42-的物质的量多少?【练习】1.课本P13学与问2.等质量的下列物质中,所含分子数最少的是 ( )
A、Cl2 B、 HCl C、NH3 D、H2SO4
D3、1g H2O中含有a个氢原子,则阿伏加德罗常数为( )
A、(a/9)mol-1 B、 9a mol-1
C、 2a mol-1 D、a mol-1B 【讨论】你给摩尔体积下一个定义? 单位物质的量(1mol)的物质具有的体积叫做摩尔体积。1mol物质体积 相同吗???1mol下列气体在00C、1.01×105Pa下的体积22.422.422.422.4课本14【科学探究】1mol 固体和液体物质在200C、1.01×105Pa下的体积由体积数据结合物质状态你得出什么结论? 在相同条件下,等物质的量(如1mol )
固体或液体的体积一般各不相同,
但气体的体积却几乎完全相同。 结论:物体体积大小取决于什么因素呢?影响物质体积的因素1.粒子数目2.粒子的大小3.粒子之间的距离二、气体摩尔体积概念:单位物质的量(1mol)气体所占的体积
叫做气体摩尔体积。 符号: Vm 标准状况下,1mol 任何气体的体积都约是22.4L 。 单位: L/mol (L·mol-1) 和 m3/mol 。≈22.4L/mol (标况下) 0.282m标准状况下的气体
摩尔体积示意图理解要点:条件:标准状况(STP)
0℃、 1.01×105 Pa
对象:任何气体
物质的量:1mol结论体积约为22.4L因为Vm的大小与温度和压强有关。Attention: 1摩尔任何气体,可以是单一纯净的气体,也可以是混合气体。CO2 的摩尔体积是22.4L/mol是对是错解释:未说是标况下标况下NO2 的体积约是22.4L解释:未说是1mol是对是错标准状况下,1mol任何物质的体积都约是22.4L解释:物质应是气体是对是错标准状况下,气体的摩尔体积都是22.4L。 解释:单位应为L/mol是对是错气体摩尔体积物质的量气体体积V =Vm× n物质的量( n ) 、气体体积( V )和气体摩尔体积( Vm )三者之间的关系:公式三:n=VVm气体体积
(V) ×Vm ÷ Vm物质的量(n) 变换为 V= n × Vm例题:标准状况下, 112 mL 某气体的质量为 0 . 14 g , 则其摩尔质量为 ,相对分子质量为 。解:= 0 . 005 mol n = m / M= 28 g / mol1.在标况下
1) 0.5mol HCl气体占有的体积是多少?
2) 33.6LH2 的物质的量是多少?
练习11.2L1.5mol [阿伏加德罗定律]
在相同的温度和压强下,相同体积的任何气体都含相同数目的粒子(相同物质的量)。三、物质的量在化学实验中的应用定义:表示单位体积(1L)溶液里所含溶质B的物质的量,叫做B的物质的量浓度。公式四:CB=单位:nB: molV: L CB: mol/L 1、物质的量浓度溶液的体积[练习]1.判断题(1)将1gNaCl溶于水制成1L溶液 ,则c=1mol/L ; ( )
(2)将1molNaCl溶于1L水中,则c=1mol/L; ( )
(3)若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol/L;( )
(4)同体积 、同物质的量浓度的不同溶液中,含溶质的物质的量相等;( )xx√ √ 注意:1L是溶液的体积,不是水的体积。例题课本P162. 填空题(1)0.2mol/L的H2SO4的含义是__________;
(2)将1L NaOH溶液中含有40g NaOH,其物质的量浓度为_________;
(3)200mL的NaOH溶液中含有20gNaOH,其物质的量浓度为_________;
(4) 0.2mol/L Al2(SO4)3溶液中含有c(Al3+)=_________, c(SO42-)=_________;
(5)已知c(Cl-)=1mol/L ,则c(CaCl2)=_________________。[练习] 下列各溶液中:其中Na+的物质的量浓度分别是多少?
(1)0.8L 0.4mol/L的NaOH溶液
(2)2L 0.15mol/L的Na3PO4溶液
(3)1L 0.3mol/L的Na2SO4溶液
(4)2L 0.5mol/L的NaCl溶液mol/L0.40.450.60.5如:1mol/LMgCl2溶液中,
MgCl2 = Mg2++ 2Cl-
1mol/L公式:离子浓度=溶液浓度×溶质化学式中该离子的个数1mol/L 2mol/L2.容量瓶简介:①容量瓶②使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:50mL , 100mL,250mL,500mL,1000mL;③不能在其中溶解(有吸热或放热现象),不能将热的溶
液倒入,会影响体积的准确性。④读数时 ,应平视,使溶液的凹液面正好与刻度相切;不能作反应容器,不能长期存放溶液,只能用作配制的量具。移动容量瓶,应手握刻度线以上部分。 容量瓶需标有:
(1)温度 (2)浓度
(3)容积 (4)压强
(5)刻度线 (6)酸式或碱式
六项中的( )
A、(1)(3)(5) B、(3)(5)(6)
C、(1)(2)(4) D、(2)(4)(6)[随堂练习]A3.一定物质的量浓度溶液的配制①配制步骤八字方针:计→量→溶→转→洗→定→摇→(装)⑴计算⑵称量(或量取)⑶溶解(冷却)⑷转移 ⑸洗涤⑹定容⑺摇匀(8)装瓶5.9gNaCl【实验1-5】配制100mL 1.00mol/L 的NaCl溶液②配制物质的量浓度溶液的主要仪器 烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用) 线4.配制一定物质的量浓度溶液的误差分析公式分析自由交流 讨论1药品的量取(固体的称量与液体的量取)是否准确;
→ 如果药品(溶质)取量超过应取量,则配制的溶液的物质的量浓度会( ) 。
→ 如果药品(溶质)取量小于应取量,则配制的溶液的物质的量浓度( )。偏大偏小把溶液向容量瓶中转移,溶液洒了,溶液的浓度会( ) 。
→因为溶液洒了,溶质有损失,故配制的溶液的浓度会偏小。自由交流 讨论2偏小自由交流 讨论3定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯视仰视俯视或仰视刻度线对溶液浓度的影响俯视或仰视刻度线对溶液浓度的影响俯视刻度线,实际加水量未到刻度线 (相当于n不变,V偏小) ,使溶液的物质的量浓度( );
仰视刻度线,实际加水量超过刻度线(相当于n不变,V偏大) ,使溶液的物质的量浓度( )。 偏大偏小《随堂优化训练》P9 知识点8课本P17【学与问】[练习]小结:容量瓶的使用六忌 一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏小)
四忌读数仰视或俯视(仰视浓度偏小, 俯视浓度偏大)
五忌不洗涤玻璃棒和烧杯(浓度偏小)
六忌配制好的溶液存放于容量瓶中(容量瓶是量器,不是容器) [练习]
下列操作,对实验结果有何影响(偏高、偏低、无影响)?
1、称量时,NaCl 固体与砝码的位置颠倒。
2、未用蒸馏水洗涤烧杯内壁。
3、转移溶液时有部分溶液溅出。
4、转移溶液前容量瓶内有水。
5、摇匀后,液面低于刻度线,再加水至刻度线。
6、定容时加水不慎超过刻度线,将超过部分吸走。(偏低)(偏低)(偏低)(偏低)(偏低)(无影响)C(浓溶液) ·V(浓溶液)= C(稀溶液) ·V(稀溶液)公式五:课本P17【思考与交流】原则:溶液在稀释前后,溶质的质量或物质的量保持不变。
【练习】 1. 选择题下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成AD 将10mL 2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少mL? 2. 计算题 【知识归纳】 《随堂优化训练》P8 知识点7 作业:课本P18
2、3、 4、 6 题
配制2.0mol/L 的NaCl溶液100mL(1)计算
n(NaCl)=c(NaCl) ×V[(NaCl(aq)]=
1.00mol/L×0.1L=0.1mol
m(NaCl)=n(NaCl) × M(NaCl)=
0.1mol×58.5g/mol=5.85g(4)转移
注意事项:
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。配制2.0mol/L 的NaCl溶液100mL(5)洗涤
[提问]
将烧杯中的氯化钠溶液转移到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?还有残留在烧杯壁和玻璃棒上的氯化钠未被
转移。因此要用蒸馏水洗涤用过的烧杯和玻
璃棒2-3次。配制2.0mol/L 的NaCl溶液100mL(6)定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。为何要改用胶头滴管滴加蒸馏水至刻度?答:用胶头滴管是为了防止加水过量,超过刻度线。若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?必须重新配制(7)摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。摇匀后发现液面低于刻线,能否补充水?不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。 容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。(8)装瓶容量瓶使用前应查是否检漏水,其方法是:
往瓶内加水,塞好瓶塞(瓶口和瓶塞要干,且不涂任何油脂等),用食指顶住瓶塞,另一只手托住瓶底把瓶倒立过来,观察瓶塞周围是否有水漏出,如不漏水,把瓶塞旋转180°塞紧,仍把瓶倒立过来,再检查是否漏水,经检查不漏水的容量瓶才能使用。
化学计量在实验中的应用【复习】 熟悉的知识
2H2+O2 2H2O
4g 32g 36g 2个 1个 2个质 量比:分子个数比:点燃 物质的量是把微观粒子和宏观物质联系起来的 一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量国际单位制(SI)的7个基本单位物质的量摩[尔]mol 是国际单位制七个基本物理量之一,符号为n 。物质的量是表示含有一定数目微观粒子的集合体。{分子、原子、离子、电子、质子、原子团、中子等一、物质的量的单位 —— 摩尔使用范围:单位 —— 摩尔 简称摩符号为 mol 。生活小常识12支铅笔称一打使用物质的量注意事项:①物质的量这四个字是一个整体,是一个专用名词,不得简化或增添任何字。③物质的量计量的是粒子的集合体,不是单个粒子。
②物质的量只适用于微观粒子,使用摩作单位时,所指粒子必须指明粒子的种类,如原子、分子、离子等。,且粒子的种类一般都要用化学符号表示。
回答问题
物质的量的含义是什么?符号是什么?单位是什么?
【课堂练习】 1.判断正误,并说明理由。
A.1mol氢
B. 1mol CO2
C. 1mol大米错误。没有指出是分子、原子或离子正确。错误。大米不是微观粒子 必须指明粒子的种类,如原子、分子、离子等。注意 (近似值: 6.02ㄨ1023个粒子)
同0.012千克12C中所含的碳原子的数目相同 1摩尔1mol任何粒子的集合体都含有约6.02×1023 个粒子。规定:6.02×1023 mol-1叫做阿伏加德罗常数,它是个物理量,其是单位是mol-1,符号为NA 。2.阿伏加德罗常数 NA≈ 6.02×1023 mol-1?阿伏加德罗常数物质的量粒子个数(约6.02×1023mol-1)N =NA× n物质的量( n ) 、粒子个数( N )和阿伏加德罗常数( NA )三者之间的关系:公式一:n=NNA粒 子个数
(N) ×NA ÷ NA物质的量(n) 变换为 N= n × NA【规律】物质的粒子数之比 = 物质的量之比
例1:在0.5mol O2中含有的氧分子数目
是多少?解:O2的分子数为N = n × NA =0.5 mol× 6.02 ×1023mol-1= 3.01 × 1023 答:O2的分子数为3.01 × 1023个。例2:在0.5mol O2中含有的氧原子数目
是多少?解:O2的氧原子数为N = n ×2 × NA =0.5 mol×2× 6.02 ×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。练习 1 、0.5molH2约含有氢分子数 个2、 1molNaCl约含有氯离子数_____________ 个3 、 1mol硫酸分子约含有氧原子数____________个4、 1. 204?1024 个水分子物质的量为_____mol3.01 ? 10236.02 ? 10232.408 ? 10242
5、2mol CO2中含有 mol C和 mol O,
含有 个CO2分子。
6、 mol H2O中含有的氧原子数
1.5mol CO2中含有的氧原子数相同241.204 ? 10243练习1.判断下列说法是否正确 ,并说明理由。(1)1mol氧。( )(2)0.25molH2O 。( )(3)摩尔是7个基本物理量之一 。( )(4)1mol小麦约含有6.02×1023个麦粒 。( ) (5)0.5molH2 含有3.01×1023 个氢原子。( )(6)3molNH3 中含有3molN原子,9molH原子。
( )×√×××√2.选择题⑴ 摩尔是( )
A.物质的数量单位
B.表示物质的质量单位
C.表示物质的量的单位
D.既是物质的数量单位又是物质的质量单位C(2)0.5molNa2SO4中所含的Na+离子数为( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1B3.填空题 (4)1mol H2SO4中含______________个S原子,_____________个O原子,_____________个H原子,_________ mol O 。(1)1mol O中约含有_______________个O原子;
(2)4mol O2中约含有_________molO原子;
(3)3mol H2SO4中约含_________________个H2SO4 分子,可解离出_______molH+;6.02ㄨ102383×6.02ㄨ102366.02ㄨ10234×6.02ㄨ10232×6.02ㄨ10234(5)1molNaOH中约含有_______molNa+、____molOH-113.摩尔质量定义:单位物质的量(即1mol)的物质所具有的质量叫做该物质的摩尔质量符号:M单位:g · mol-1182712569818g27g12g56g98g结论: 1mol任何粒子或物质的质量以g为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。1、 M(H2O)= 。
2、M( NaCl)= 。
3、M(SO42-)= 。
4 、M(OH-)=_________________练习摩尔质量物质的量质量m = M× n物质的量( n ) 、质量( m )和摩尔质量( M )三者之间的关系:公式二:n=mM质量
(m) ×M ÷ M物质的量(n) 变换为 m= n × M例题、 71gNa2SO4中含有的Na+和SO42-的物质的量多少?【练习】1.课本P13学与问2.等质量的下列物质中,所含分子数最少的是 ( )
A、Cl2 B、 HCl C、NH3 D、H2SO4
D3、1g H2O中含有a个氢原子,则阿伏加德罗常数为( )
A、(a/9)mol-1 B、 9a mol-1
C、 2a mol-1 D、a mol-1B 【讨论】你给摩尔体积下一个定义? 单位物质的量(1mol)的物质具有的体积叫做摩尔体积。1mol物质体积 相同吗???1mol下列气体在00C、1.01×105Pa下的体积22.422.422.422.4课本14【科学探究】1mol 固体和液体物质在200C、1.01×105Pa下的体积由体积数据结合物质状态你得出什么结论? 在相同条件下,等物质的量(如1mol )
固体或液体的体积一般各不相同,
但气体的体积却几乎完全相同。 结论:物体体积大小取决于什么因素呢?影响物质体积的因素1.粒子数目2.粒子的大小3.粒子之间的距离二、气体摩尔体积概念:单位物质的量(1mol)气体所占的体积
叫做气体摩尔体积。 符号: Vm 标准状况下,1mol 任何气体的体积都约是22.4L 。 单位: L/mol (L·mol-1) 和 m3/mol 。≈22.4L/mol (标况下) 0.282m标准状况下的气体
摩尔体积示意图理解要点:条件:标准状况(STP)
0℃、 1.01×105 Pa
对象:任何气体
物质的量:1mol结论体积约为22.4L因为Vm的大小与温度和压强有关。Attention: 1摩尔任何气体,可以是单一纯净的气体,也可以是混合气体。CO2 的摩尔体积是22.4L/mol是对是错解释:未说是标况下标况下NO2 的体积约是22.4L解释:未说是1mol是对是错标准状况下,1mol任何物质的体积都约是22.4L解释:物质应是气体是对是错标准状况下,气体的摩尔体积都是22.4L。 解释:单位应为L/mol是对是错气体摩尔体积物质的量气体体积V =Vm× n物质的量( n ) 、气体体积( V )和气体摩尔体积( Vm )三者之间的关系:公式三:n=VVm气体体积
(V) ×Vm ÷ Vm物质的量(n) 变换为 V= n × Vm例题:标准状况下, 112 mL 某气体的质量为 0 . 14 g , 则其摩尔质量为 ,相对分子质量为 。解:= 0 . 005 mol n = m / M= 28 g / mol1.在标况下
1) 0.5mol HCl气体占有的体积是多少?
2) 33.6LH2 的物质的量是多少?
练习11.2L1.5mol [阿伏加德罗定律]
在相同的温度和压强下,相同体积的任何气体都含相同数目的粒子(相同物质的量)。三、物质的量在化学实验中的应用定义:表示单位体积(1L)溶液里所含溶质B的物质的量,叫做B的物质的量浓度。公式四:CB=单位:nB: molV: L CB: mol/L 1、物质的量浓度溶液的体积[练习]1.判断题(1)将1gNaCl溶于水制成1L溶液 ,则c=1mol/L ; ( )
(2)将1molNaCl溶于1L水中,则c=1mol/L; ( )
(3)若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的NaOH溶液c=1mol/L;( )
(4)同体积 、同物质的量浓度的不同溶液中,含溶质的物质的量相等;( )xx√ √ 注意:1L是溶液的体积,不是水的体积。例题课本P162. 填空题(1)0.2mol/L的H2SO4的含义是__________;
(2)将1L NaOH溶液中含有40g NaOH,其物质的量浓度为_________;
(3)200mL的NaOH溶液中含有20gNaOH,其物质的量浓度为_________;
(4) 0.2mol/L Al2(SO4)3溶液中含有c(Al3+)=_________, c(SO42-)=_________;
(5)已知c(Cl-)=1mol/L ,则c(CaCl2)=_________________。[练习] 下列各溶液中:其中Na+的物质的量浓度分别是多少?
(1)0.8L 0.4mol/L的NaOH溶液
(2)2L 0.15mol/L的Na3PO4溶液
(3)1L 0.3mol/L的Na2SO4溶液
(4)2L 0.5mol/L的NaCl溶液mol/L0.40.450.60.5如:1mol/LMgCl2溶液中,
MgCl2 = Mg2++ 2Cl-
1mol/L公式:离子浓度=溶液浓度×溶质化学式中该离子的个数1mol/L 2mol/L2.容量瓶简介:①容量瓶②使用之前要检查是否漏水.如何检漏? 加水倒立观察瓶塞旋转180o倒立观察形状:细颈,梨形,平底的玻璃瓶;构造:瓶上标有容积,温度,颈部标有刻度线;规格:50mL , 100mL,250mL,500mL,1000mL;③不能在其中溶解(有吸热或放热现象),不能将热的溶
液倒入,会影响体积的准确性。④读数时 ,应平视,使溶液的凹液面正好与刻度相切;不能作反应容器,不能长期存放溶液,只能用作配制的量具。移动容量瓶,应手握刻度线以上部分。 容量瓶需标有:
(1)温度 (2)浓度
(3)容积 (4)压强
(5)刻度线 (6)酸式或碱式
六项中的( )
A、(1)(3)(5) B、(3)(5)(6)
C、(1)(2)(4) D、(2)(4)(6)[随堂练习]A3.一定物质的量浓度溶液的配制①配制步骤八字方针:计→量→溶→转→洗→定→摇→(装)⑴计算⑵称量(或量取)⑶溶解(冷却)⑷转移 ⑸洗涤⑹定容⑺摇匀(8)装瓶5.9gNaCl【实验1-5】配制100mL 1.00mol/L 的NaCl溶液②配制物质的量浓度溶液的主要仪器 烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用) 线4.配制一定物质的量浓度溶液的误差分析公式分析自由交流 讨论1药品的量取(固体的称量与液体的量取)是否准确;
→ 如果药品(溶质)取量超过应取量,则配制的溶液的物质的量浓度会( ) 。
→ 如果药品(溶质)取量小于应取量,则配制的溶液的物质的量浓度( )。偏大偏小把溶液向容量瓶中转移,溶液洒了,溶液的浓度会( ) 。
→因为溶液洒了,溶质有损失,故配制的溶液的浓度会偏小。自由交流 讨论2偏小自由交流 讨论3定容时俯视或仰视刻度线,对溶液的浓度有何影响? ?俯视仰视俯视或仰视刻度线对溶液浓度的影响俯视或仰视刻度线对溶液浓度的影响俯视刻度线,实际加水量未到刻度线 (相当于n不变,V偏小) ,使溶液的物质的量浓度( );
仰视刻度线,实际加水量超过刻度线(相当于n不变,V偏大) ,使溶液的物质的量浓度( )。 偏大偏小《随堂优化训练》P9 知识点8课本P17【学与问】[练习]小结:容量瓶的使用六忌 一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏小)
四忌读数仰视或俯视(仰视浓度偏小, 俯视浓度偏大)
五忌不洗涤玻璃棒和烧杯(浓度偏小)
六忌配制好的溶液存放于容量瓶中(容量瓶是量器,不是容器) [练习]
下列操作,对实验结果有何影响(偏高、偏低、无影响)?
1、称量时,NaCl 固体与砝码的位置颠倒。
2、未用蒸馏水洗涤烧杯内壁。
3、转移溶液时有部分溶液溅出。
4、转移溶液前容量瓶内有水。
5、摇匀后,液面低于刻度线,再加水至刻度线。
6、定容时加水不慎超过刻度线,将超过部分吸走。(偏低)(偏低)(偏低)(偏低)(偏低)(无影响)C(浓溶液) ·V(浓溶液)= C(稀溶液) ·V(稀溶液)公式五:课本P17【思考与交流】原则:溶液在稀释前后,溶质的质量或物质的量保持不变。
【练习】 1. 选择题下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成AD 将10mL 2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少mL? 2. 计算题 【知识归纳】 《随堂优化训练》P8 知识点7 作业:课本P18
2、3、 4、 6 题
配制2.0mol/L 的NaCl溶液100mL(1)计算
n(NaCl)=c(NaCl) ×V[(NaCl(aq)]=
1.00mol/L×0.1L=0.1mol
m(NaCl)=n(NaCl) × M(NaCl)=
0.1mol×58.5g/mol=5.85g(4)转移
注意事项:
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。配制2.0mol/L 的NaCl溶液100mL(5)洗涤
[提问]
将烧杯中的氯化钠溶液转移到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?还有残留在烧杯壁和玻璃棒上的氯化钠未被
转移。因此要用蒸馏水洗涤用过的烧杯和玻
璃棒2-3次。配制2.0mol/L 的NaCl溶液100mL(6)定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。为何要改用胶头滴管滴加蒸馏水至刻度?答:用胶头滴管是为了防止加水过量,超过刻度线。若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?必须重新配制(7)摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。摇匀后发现液面低于刻线,能否补充水?不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。 容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。(8)装瓶容量瓶使用前应查是否检漏水,其方法是:
往瓶内加水,塞好瓶塞(瓶口和瓶塞要干,且不涂任何油脂等),用食指顶住瓶塞,另一只手托住瓶底把瓶倒立过来,观察瓶塞周围是否有水漏出,如不漏水,把瓶塞旋转180°塞紧,仍把瓶倒立过来,再检查是否漏水,经检查不漏水的容量瓶才能使用。
