氯 气[上学期]
图片预览
文档简介
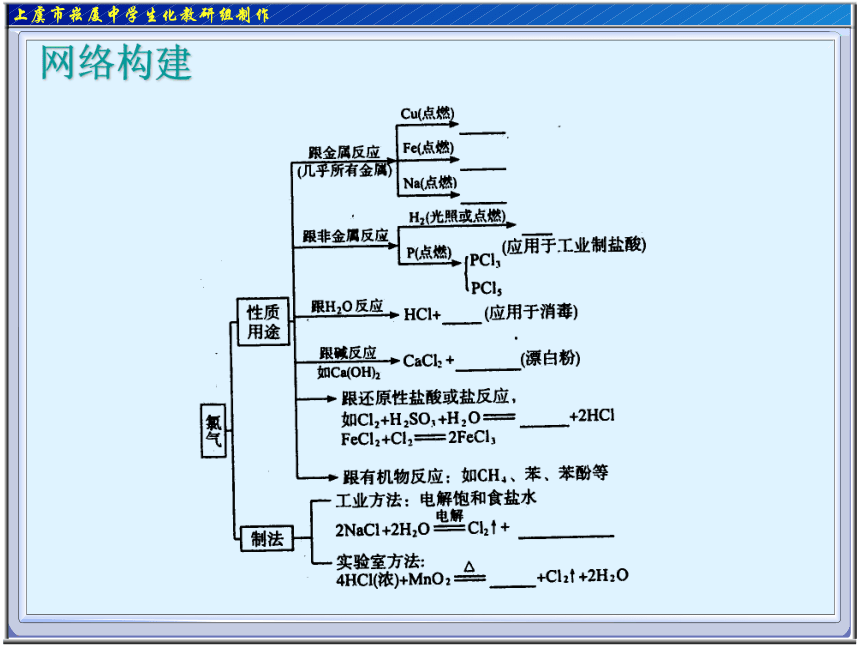
课件26张PPT。氯 气 网络构建自学感悟
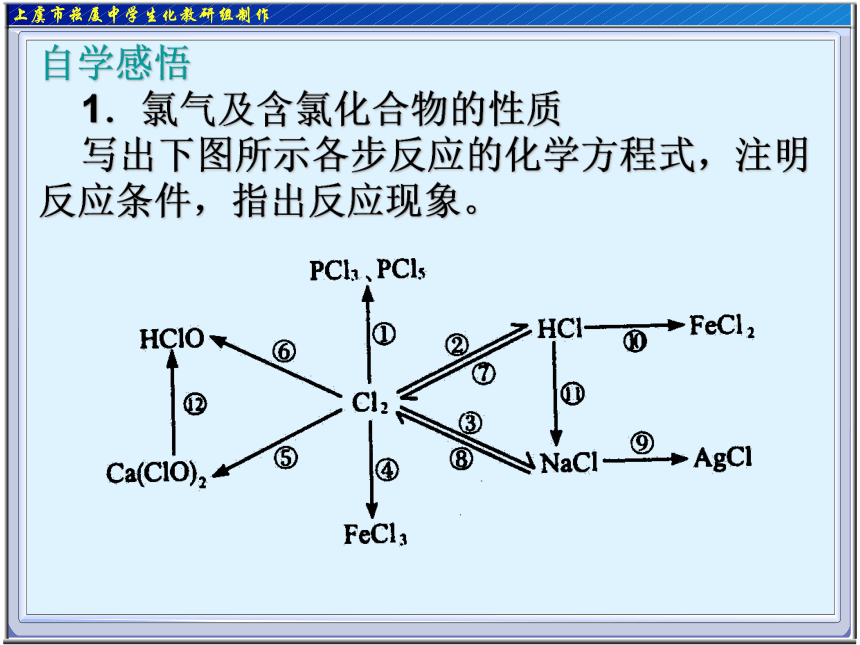
1.氯气及含氯化合物的性质
写出下图所示各步反应的化学方程式,注明反应条件,指出反应现象。自学感悟
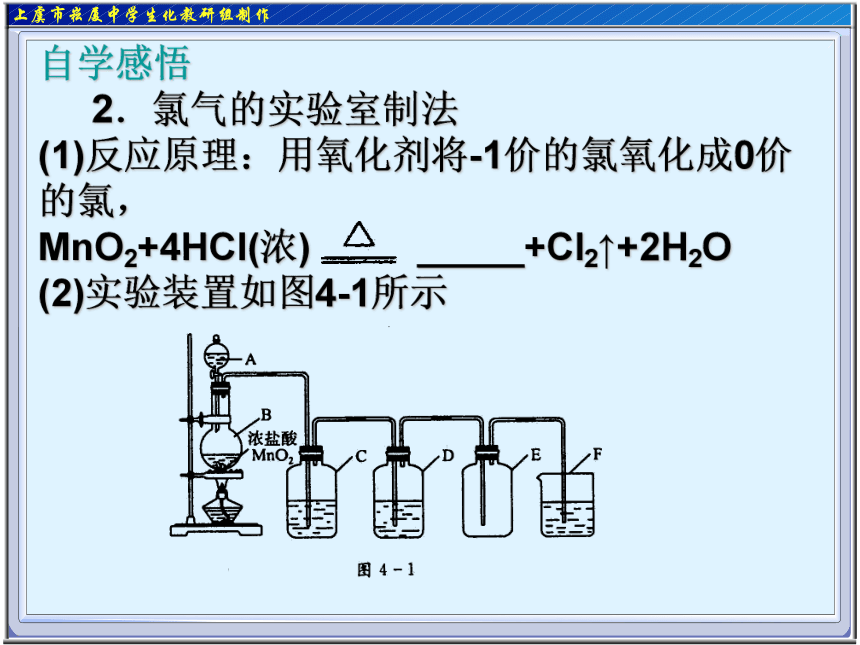
2.氯气的实验室制法
(1)反应原理:用氧化剂将-1价的氯氧化成0价的氯,
MnO2+4HCl(浓) _____+Cl2↑+2H2O
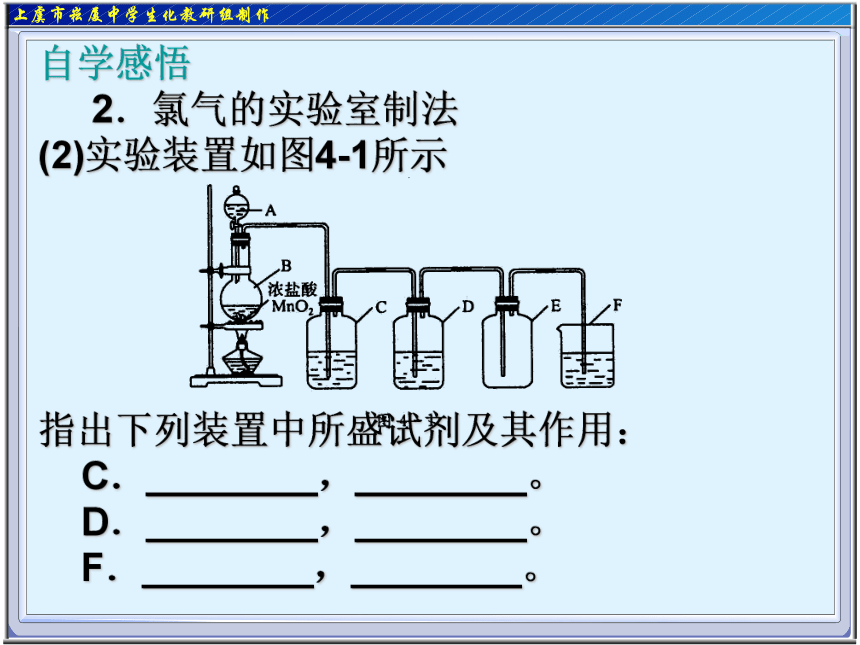
(2)实验装置如图4-1所示
氯气的实验室制法探究自学感悟
2.氯气的实验室制法
(2)实验装置如图4-1所示
指出下列装置中所盛试剂及其作用:
C.________,________。
D.________,________。
F.________,________。 自学感悟
2.氯气的实验室制法
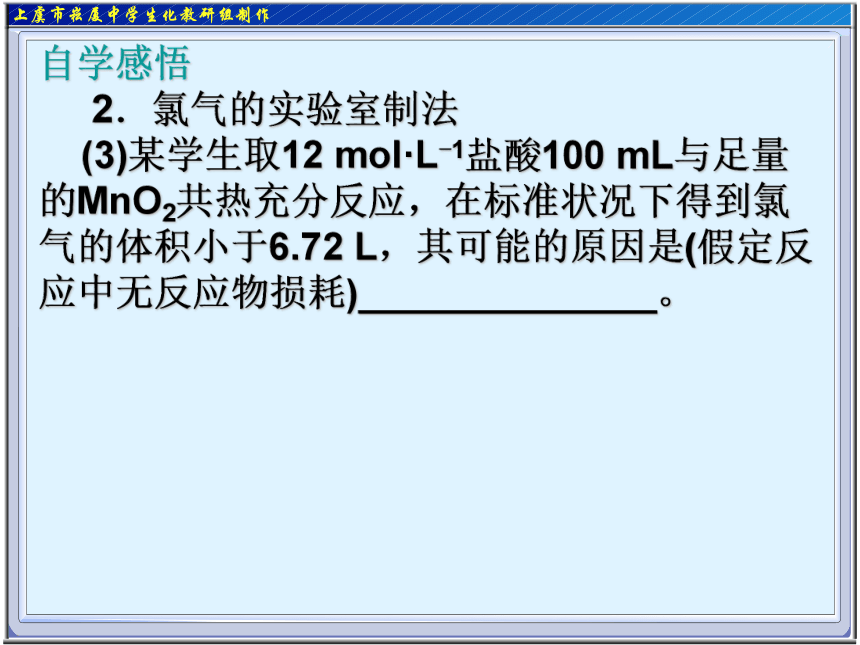
(3)某学生取12 mol·L-1盐酸100 mL与足量的MnO2共热充分反应,在标准状况下得到氯气的体积小于6.72 L,其可能的原因是(假定反应中无反应物损耗)______________。
要点诠释
考点1 氯气的性质和制取
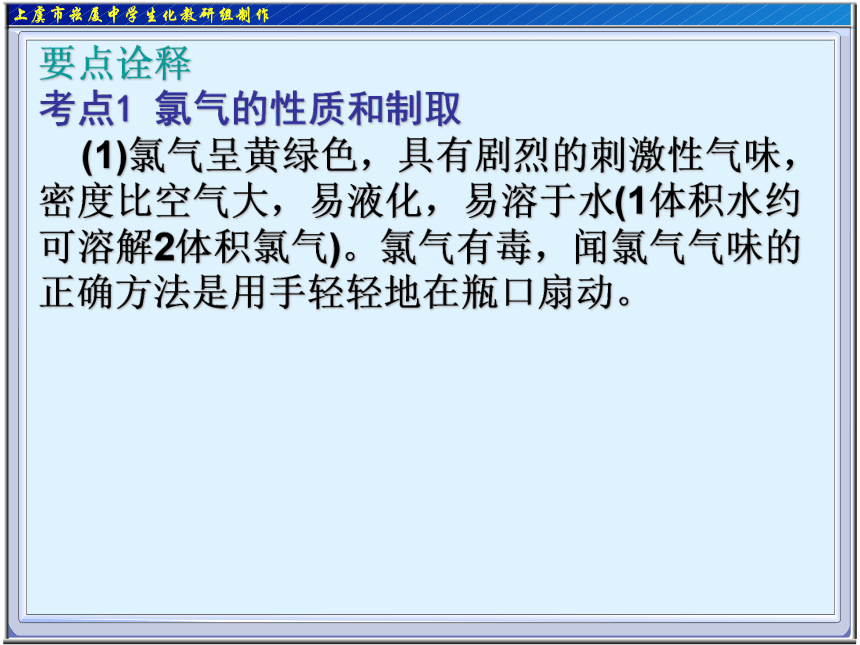
(1)氯气呈黄绿色,具有剧烈的刺激性气味,密度比空气大,易液化,易溶于水(1体积水约可溶解2体积氯气)。氯气有毒,闻氯气气味的正确方法是用手轻轻地在瓶口扇动。要点诠释
考点1 氯气的性质和制取
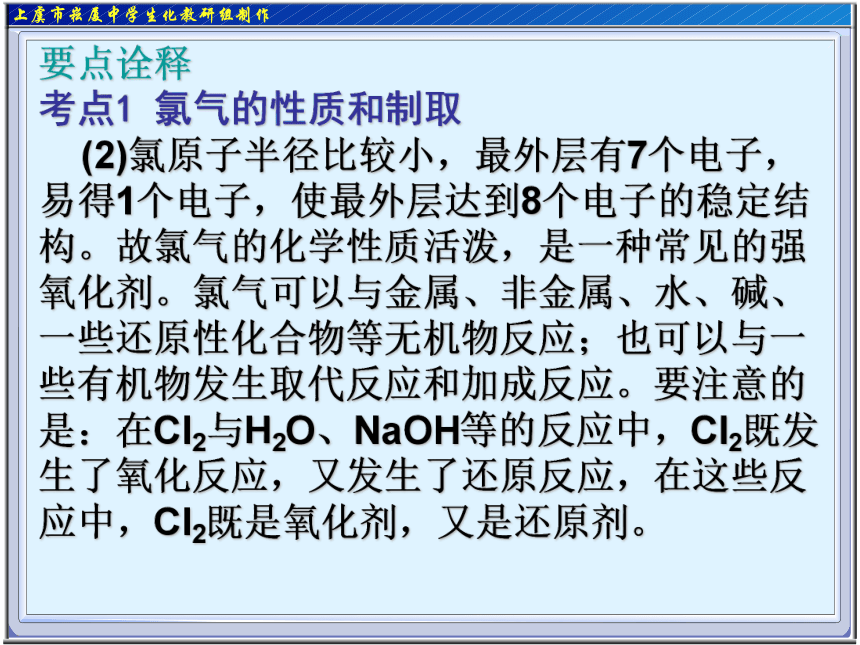
(2)氯原子半径比较小,最外层有7个电子,易得1个电子,使最外层达到8个电子的稳定结构。故氯气的化学性质活泼,是一种常见的强氧化剂。氯气可以与金属、非金属、水、碱、一些还原性化合物等无机物反应;也可以与一些有机物发生取代反应和加成反应。要注意的是:在Cl2与H2O、NaOH等的反应中,Cl2既发生了氧化反应,又发生了还原反应,在这些反应中,Cl2既是氧化剂,又是还原剂。要点诠释
考点1 氯气的性质和制取
(3)空验室制取Cl2的常见原理是MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。收集氯气可用向上排空气法或排饱和食盐水法,若要制得纯净的氯气,可用饱和食盐水洗去 HCI,并用浓硫酸干燥。氯气有毒,应用NaOH溶液吸收尾气,防止污染空气。工业上,通常采用电解饱和食盐水的方法制取氯气;也可用电解熔融的NaCI的方法制取氯气。要点诠释
考点2 氯水的成分和性质
(1)氯水的成分和性质要点诠释
考点2 氯水的成分和性质
(2)Cl2+H2O H++Cl-+HClO平衡移动的应用要点诠释
考点2 氯水的成分和性质
(3)新制氯水和久置氯水在成分和性质上的不同
新制氯水中含有三种分子:Cl2、H2O、HClO,四种离子: H+、Cl-、ClO-及少量的OH-。而久置的氯水因次氯酸分解,使Cl2+H2 O=H++Cl-+HClO平衡向右移动,变为稀盐酸,不再具有强氧化性和漂白性。因此氯水应盛放在棕色试剂瓶中密闭置于冷暗处保存。氯水使红色酚酞褪色原因研究难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(1)氧化漂白。氯水、次氯酸盐、Na2O2和H2O。在一定条件下分解放出原子氧,原子氧(可表示为[O])的活性很强,有较强的氧化能力,能将许多有色物质氧化成无色物质,从而达到漂白的目的。被漂白的物质不变色,此类漂白剂能漂白酸碱指示剂。难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(2)化合漂白。如SO2的漂白,其原理是SO2溶于水生成亚硫酸,亚硫酸与有色物质化合,形成不稳定的无色化合物,无色化合物在一定条件下(如加热)分解恢复原色。SO2不能漂白酸碱指示剂。难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(3)吸附漂白。活性炭、硅藻土的漂白原理是由于有许多小孔隙,总表面积大,有较强的吸附作用,通过吸附溶液中的一些有色物质或有色离子或有色气体使之褪色,属于物理变化。难点2 气体的实验室制法
(1)选取试剂的主要依据是制取气体的性质。如氯气具有氧化性,常用氧化其离子的方法来制取,因此要选用含有氯离子的物质(如盐酸)和具有强氧化性的物质(如MnO2、 KMnO4等)来制取。
(2)选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。以此分析可知,实验室制取氯气是加热固体与液体的混合物,所以应选用固液加热气体发生装置。因反应要加热,二氧化锰都不是块状固体,且氯气溶于水,因此不能选用启普发生器。难点2 气体的实验室制法
(3)进用收集方法的主要依据是气体的密度和水溶性。因为氯气能溶于水,密度比空气大,所以收集氯气时,不能用排水法,应该用向上排空气法收集。
(4)选择气体干燥剂的主要依据是被干燥气体不能与干燥剂反应。如氯气能与碱反应,所以它们都不能用碱石灰进行干燥,常用浓硫酸、五氧化二磷等进行干燥。难点2 气体的实验室制法
(5)吸收装置:因为氯气有毒,实验室制取氯气时应在密闭系统或通风橱中进行,通常在收集装置的后面连接盛有氢氧化钠溶液的吸收装置。若用水吸收极易溶解的气体(如 HCl)时,要防止吸水倒流,应在导管口连接一个倒置漏斗并使其刚好接近水面进行吸收。实例点拨
【例1】向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO3
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4实例点拨
【例2】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图4-2所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②③④处实例点拨
【例3】U、V、W、X、Y、Z六种物质之间存在如下反应:
(1)U+KOH→V+W+H2O
(2)X→W+Y
(3)X+W+H2SO4→U+Z+H2O
其中U和Y是单质,在常温下都是气体;Z是硫酸盐。
由此可以推断它们是:
U.______;V.______;W.______;X.______;Y.______;Z.______。△实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(1)A是______,B是______,C是______(请填化学式)。实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(2)反应①的化学方程式为______。
(3)反应③的化学方程式为____________。实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(4)反应④的化学方程式为____________。
1.氯气及含氯化合物的性质
写出下图所示各步反应的化学方程式,注明反应条件,指出反应现象。自学感悟
2.氯气的实验室制法
(1)反应原理:用氧化剂将-1价的氯氧化成0价的氯,
MnO2+4HCl(浓) _____+Cl2↑+2H2O
(2)实验装置如图4-1所示
氯气的实验室制法探究自学感悟
2.氯气的实验室制法
(2)实验装置如图4-1所示
指出下列装置中所盛试剂及其作用:
C.________,________。
D.________,________。
F.________,________。 自学感悟
2.氯气的实验室制法
(3)某学生取12 mol·L-1盐酸100 mL与足量的MnO2共热充分反应,在标准状况下得到氯气的体积小于6.72 L,其可能的原因是(假定反应中无反应物损耗)______________。
要点诠释
考点1 氯气的性质和制取
(1)氯气呈黄绿色,具有剧烈的刺激性气味,密度比空气大,易液化,易溶于水(1体积水约可溶解2体积氯气)。氯气有毒,闻氯气气味的正确方法是用手轻轻地在瓶口扇动。要点诠释
考点1 氯气的性质和制取
(2)氯原子半径比较小,最外层有7个电子,易得1个电子,使最外层达到8个电子的稳定结构。故氯气的化学性质活泼,是一种常见的强氧化剂。氯气可以与金属、非金属、水、碱、一些还原性化合物等无机物反应;也可以与一些有机物发生取代反应和加成反应。要注意的是:在Cl2与H2O、NaOH等的反应中,Cl2既发生了氧化反应,又发生了还原反应,在这些反应中,Cl2既是氧化剂,又是还原剂。要点诠释
考点1 氯气的性质和制取
(3)空验室制取Cl2的常见原理是MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。收集氯气可用向上排空气法或排饱和食盐水法,若要制得纯净的氯气,可用饱和食盐水洗去 HCI,并用浓硫酸干燥。氯气有毒,应用NaOH溶液吸收尾气,防止污染空气。工业上,通常采用电解饱和食盐水的方法制取氯气;也可用电解熔融的NaCI的方法制取氯气。要点诠释
考点2 氯水的成分和性质
(1)氯水的成分和性质要点诠释
考点2 氯水的成分和性质
(2)Cl2+H2O H++Cl-+HClO平衡移动的应用要点诠释
考点2 氯水的成分和性质
(3)新制氯水和久置氯水在成分和性质上的不同
新制氯水中含有三种分子:Cl2、H2O、HClO,四种离子: H+、Cl-、ClO-及少量的OH-。而久置的氯水因次氯酸分解,使Cl2+H2 O=H++Cl-+HClO平衡向右移动,变为稀盐酸,不再具有强氧化性和漂白性。因此氯水应盛放在棕色试剂瓶中密闭置于冷暗处保存。氯水使红色酚酞褪色原因研究难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(1)氧化漂白。氯水、次氯酸盐、Na2O2和H2O。在一定条件下分解放出原子氧,原子氧(可表示为[O])的活性很强,有较强的氧化能力,能将许多有色物质氧化成无色物质,从而达到漂白的目的。被漂白的物质不变色,此类漂白剂能漂白酸碱指示剂。难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(2)化合漂白。如SO2的漂白,其原理是SO2溶于水生成亚硫酸,亚硫酸与有色物质化合,形成不稳定的无色化合物,无色化合物在一定条件下(如加热)分解恢复原色。SO2不能漂白酸碱指示剂。难点1 次氯酸及漂白性物质
次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气来杀菌消毒。次氯酸能使染料和有机色素褪色,故可用作漂白剂。具有漂白性的物质,归纳起来有:氯水、 Ca(ClO)2、Na2O2、H2O2、SO2、活性炭、硅藻土等,其漂白原理大致可分为以下3类。
(3)吸附漂白。活性炭、硅藻土的漂白原理是由于有许多小孔隙,总表面积大,有较强的吸附作用,通过吸附溶液中的一些有色物质或有色离子或有色气体使之褪色,属于物理变化。难点2 气体的实验室制法
(1)选取试剂的主要依据是制取气体的性质。如氯气具有氧化性,常用氧化其离子的方法来制取,因此要选用含有氯离子的物质(如盐酸)和具有强氧化性的物质(如MnO2、 KMnO4等)来制取。
(2)选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。以此分析可知,实验室制取氯气是加热固体与液体的混合物,所以应选用固液加热气体发生装置。因反应要加热,二氧化锰都不是块状固体,且氯气溶于水,因此不能选用启普发生器。难点2 气体的实验室制法
(3)进用收集方法的主要依据是气体的密度和水溶性。因为氯气能溶于水,密度比空气大,所以收集氯气时,不能用排水法,应该用向上排空气法收集。
(4)选择气体干燥剂的主要依据是被干燥气体不能与干燥剂反应。如氯气能与碱反应,所以它们都不能用碱石灰进行干燥,常用浓硫酸、五氧化二磷等进行干燥。难点2 气体的实验室制法
(5)吸收装置:因为氯气有毒,实验室制取氯气时应在密闭系统或通风橱中进行,通常在收集装置的后面连接盛有氢氧化钠溶液的吸收装置。若用水吸收极易溶解的气体(如 HCl)时,要防止吸水倒流,应在导管口连接一个倒置漏斗并使其刚好接近水面进行吸收。实例点拨
【例1】向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO3
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4实例点拨
【例2】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图4-2所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②③④处实例点拨
【例3】U、V、W、X、Y、Z六种物质之间存在如下反应:
(1)U+KOH→V+W+H2O
(2)X→W+Y
(3)X+W+H2SO4→U+Z+H2O
其中U和Y是单质,在常温下都是气体;Z是硫酸盐。
由此可以推断它们是:
U.______;V.______;W.______;X.______;Y.______;Z.______。△实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(1)A是______,B是______,C是______(请填化学式)。实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(2)反应①的化学方程式为______。
(3)反应③的化学方程式为____________。实例点拨
【例4】室温下,单质A、B、C分别为固体、
黄绿色气体、无色气体,在合适的条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请完成下列问题:
(4)反应④的化学方程式为____________。
