化学电源[上学期]
图片预览





文档简介
课件16张PPT。二、化学电源空气电池锂电池什么是化学电池?化学电池是将化学能转变为电能的装置。
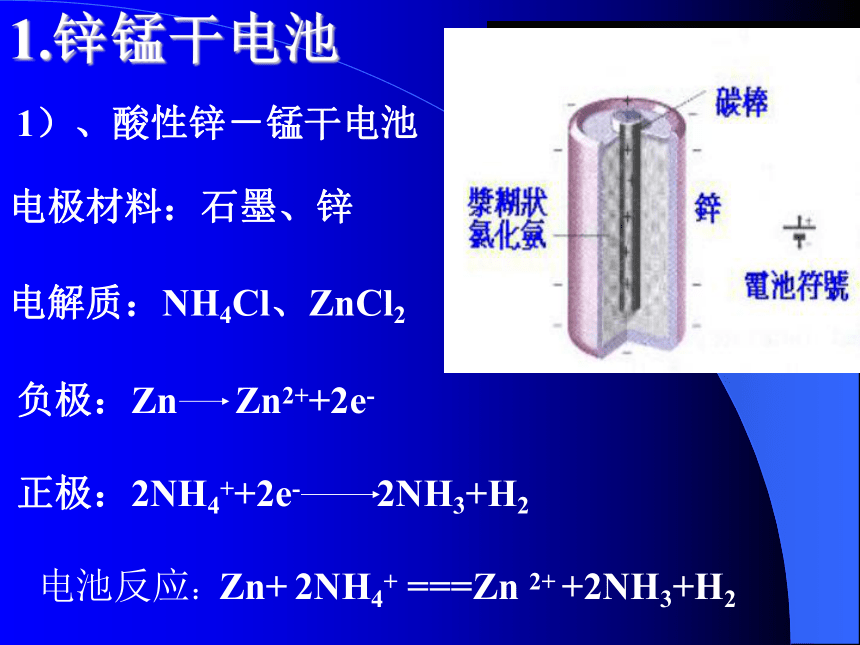
它主要包括一次电池、二次电池、燃料电池。一次电池只能放电不能充电,也称干电池,例如锌锰电池。二次电池称可充电电池,可以反复充电放电,例如铅蓄电池。什么是一次电池?什么是二次电池?1.锌锰干电池1)、酸性锌-锰干电池负极:Zn Zn2++2e-电解质:NH4Cl、ZnCl2电极材料:石墨、锌正极:2NH4++2e- 2NH3+H2 电池反应:Zn+ 2NH4+ ===Zn 2+ +2NH3+H2 随着用电器朝着
小型化、多功能化发
展的要求,对电池的
发展也提出了小型化、
多功能化发展的要求。 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
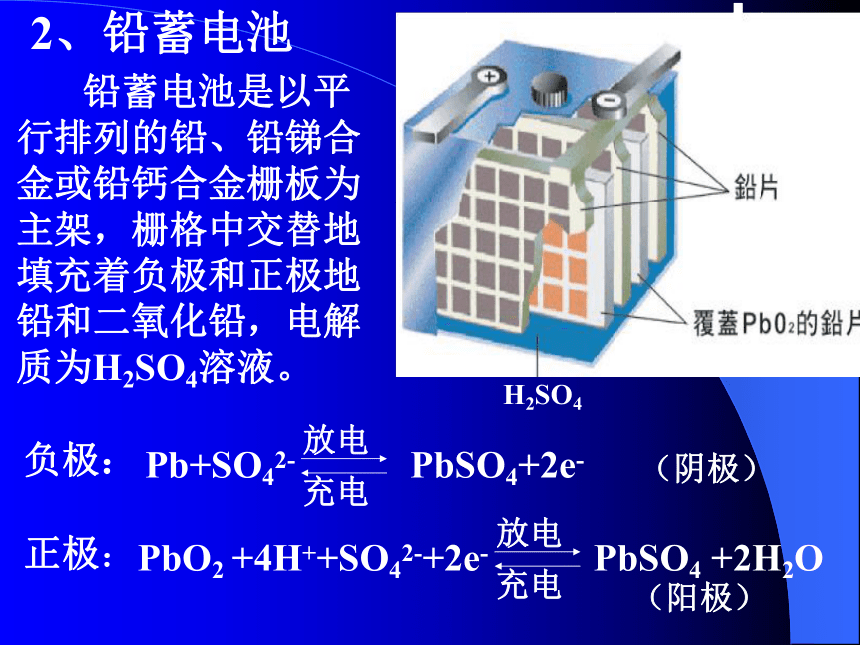
流大幅度提高。2)碱性锌—锰干电池电解质:KOH电极材料:锌、石墨负极:Zn+2OH- Zn(OH)2+2e- 正极:2MnO2+H2O+2e- Mn2O3+2OH-电池反应: Zn +2MnO2+H2O === Zn(OH)2+ Mn2O3锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。2、铅蓄电池H2SO4 铅蓄电池是以平行排列的铅、铅锑合金或铅钙合金栅板为主架,栅格中交替地填充着负极和正极地铅和二氧化铅,电解质为H2SO4溶液。 Pb+SO42- PbSO4+2e- PbO2 +4H++SO42-+2e- PbSO4 +2H2O 负极:正极:(阴极)(阳极)(白色沉淀) Pb(铅)→PbSO4(硫酸铅)PbO2→PbSO4增加硫酸浓度变小,密度变小化學能→電能PbSO4→ PbO2PbSO4(硫酸铅)→ Pb(铅)减少硫酸浓度变大,密度变大電能→化學能铅蓄电池2PbSO4 + 2H2O(负极)(正极) Pb + PbO2 + 2H2SO4(电解液) 电池反应3、新型燃料电池 燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。3.氢氧燃料电池1)若电解质溶液为KOH负极:2H2+4OH- 4H2O+4e-正极:O2+2H2O+4e- 4OH-2)若电解质溶液为酸性:负极:2H2 4H++4e-正极:O2+4H++4e- 2H2O 你能否写出在中性条件下的电池反应呢?电池反应:2H2+O2 ==2H2O是以氢气为燃料,氧气为氧化剂,铂作电极,及相应的电解质燃料电池汽车大家一起來认识“废电池污染”﹗1.铅蓄电池充电时,PbSO4( )
A、在阳极生成 B、在阴极生成
C、在两电极上生成 D、在两个电极上除去
2镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
由此可知,该电池放电时的负极是( )
A、Cd(OH)2 B、Ni(OH)2
C、Cd D、NiOOH3、理论上不能设计为原电池的化学反应
A.CH4(g)+2O2(g)===CO2(g)+2H2O(1);△H<0
B.HNO3(1)+NaOH(1) ==NaNO3(1)+H2O(1);
△H<0
C.2H2(g)+O2(g)===2H2O(1);△H<0
D.2FeCl3(1)+Fe(s)===3FeCl2(1);△H<0 点燃 点燃
它主要包括一次电池、二次电池、燃料电池。一次电池只能放电不能充电,也称干电池,例如锌锰电池。二次电池称可充电电池,可以反复充电放电,例如铅蓄电池。什么是一次电池?什么是二次电池?1.锌锰干电池1)、酸性锌-锰干电池负极:Zn Zn2++2e-电解质:NH4Cl、ZnCl2电极材料:石墨、锌正极:2NH4++2e- 2NH3+H2 电池反应:Zn+ 2NH4+ ===Zn 2+ +2NH3+H2 随着用电器朝着
小型化、多功能化发
展的要求,对电池的
发展也提出了小型化、
多功能化发展的要求。 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。2)碱性锌—锰干电池电解质:KOH电极材料:锌、石墨负极:Zn+2OH- Zn(OH)2+2e- 正极:2MnO2+H2O+2e- Mn2O3+2OH-电池反应: Zn +2MnO2+H2O === Zn(OH)2+ Mn2O3锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。2、铅蓄电池H2SO4 铅蓄电池是以平行排列的铅、铅锑合金或铅钙合金栅板为主架,栅格中交替地填充着负极和正极地铅和二氧化铅,电解质为H2SO4溶液。 Pb+SO42- PbSO4+2e- PbO2 +4H++SO42-+2e- PbSO4 +2H2O 负极:正极:(阴极)(阳极)(白色沉淀) Pb(铅)→PbSO4(硫酸铅)PbO2→PbSO4增加硫酸浓度变小,密度变小化學能→電能PbSO4→ PbO2PbSO4(硫酸铅)→ Pb(铅)减少硫酸浓度变大,密度变大電能→化學能铅蓄电池2PbSO4 + 2H2O(负极)(正极) Pb + PbO2 + 2H2SO4(电解液) 电池反应3、新型燃料电池 燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。3.氢氧燃料电池1)若电解质溶液为KOH负极:2H2+4OH- 4H2O+4e-正极:O2+2H2O+4e- 4OH-2)若电解质溶液为酸性:负极:2H2 4H++4e-正极:O2+4H++4e- 2H2O 你能否写出在中性条件下的电池反应呢?电池反应:2H2+O2 ==2H2O是以氢气为燃料,氧气为氧化剂,铂作电极,及相应的电解质燃料电池汽车大家一起來认识“废电池污染”﹗1.铅蓄电池充电时,PbSO4( )
A、在阳极生成 B、在阴极生成
C、在两电极上生成 D、在两个电极上除去
2镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
由此可知,该电池放电时的负极是( )
A、Cd(OH)2 B、Ni(OH)2
C、Cd D、NiOOH3、理论上不能设计为原电池的化学反应
A.CH4(g)+2O2(g)===CO2(g)+2H2O(1);△H<0
B.HNO3(1)+NaOH(1) ==NaNO3(1)+H2O(1);
△H<0
C.2H2(g)+O2(g)===2H2O(1);△H<0
D.2FeCl3(1)+Fe(s)===3FeCl2(1);△H<0 点燃 点燃
