专题4第一单元课件[下学期]
图片预览









文档简介
课件30张PPT。【学习目标】 二氧化硫的性质和作用1.理解SO2的还原性、酸性氧化物通用性等性质,能够书写有关的化学方程式
2.了解SO2的漂白性及特点。
4.了解硫酸型酸雨的形成及防治方法【你知道吗】 1.什么是酸雨?酸雨有哪些危害?
2.空气中的SO2主要有哪些来源? 1.酸雨:PH<5.6的雨水
2.酸雨的危害:水质酸化,土壤酸化,腐蚀建筑、设备等。
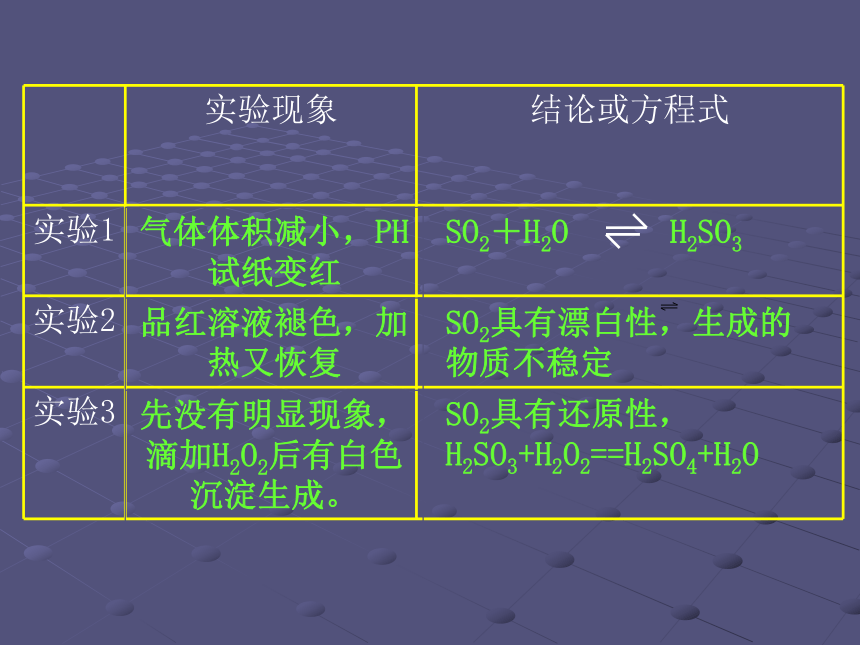
3.SO2主要来源:煤的燃烧、硫酸工业等。【归纳整理】 【观察与思考】 实验1:针筒内气体怎么变化?为什么?
PH试纸的颜色变化?怎么解释?
实验2:加热前后品红溶液的颜色怎么变化?为什么?
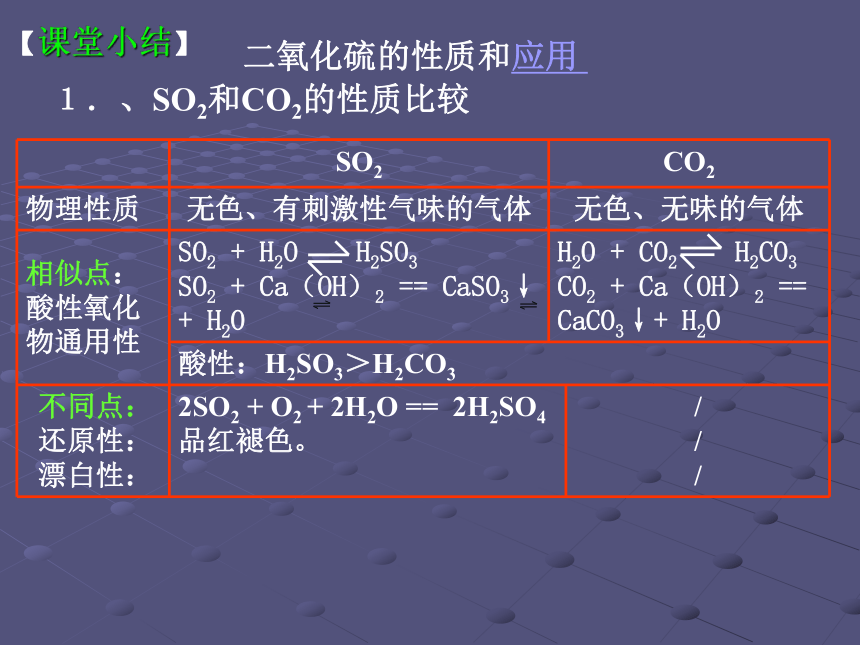
实验3:加入H2O2前后溶液中有无沉淀生成?如何解释?【归纳与整理】 1.酸性氧化物: SO2+H2O H2SO3与水反应 与碱反应 SO2+2NaOH==Na2SO3+H2O 2.还原性 可与过氧化氢、氧气、卤素单质(Cl2、Br2、I2)、高锰酸钾等反应。SO2+H2O2==H2SO4 3.漂白性 加热SO2品红溶液不稳定无色物质退色恢复SO2的酸性氧化物性质时,与CO2极相似,请写出下列反应方程式。
SO2通入澄清石灰水中:_______________________
SO2通入NH3·H2O中:
__________________________
SO2通入Na2SO3溶液中:_______________________
2.根据SO2的还原性写出SO2通入氯水的反应方程式:______________________
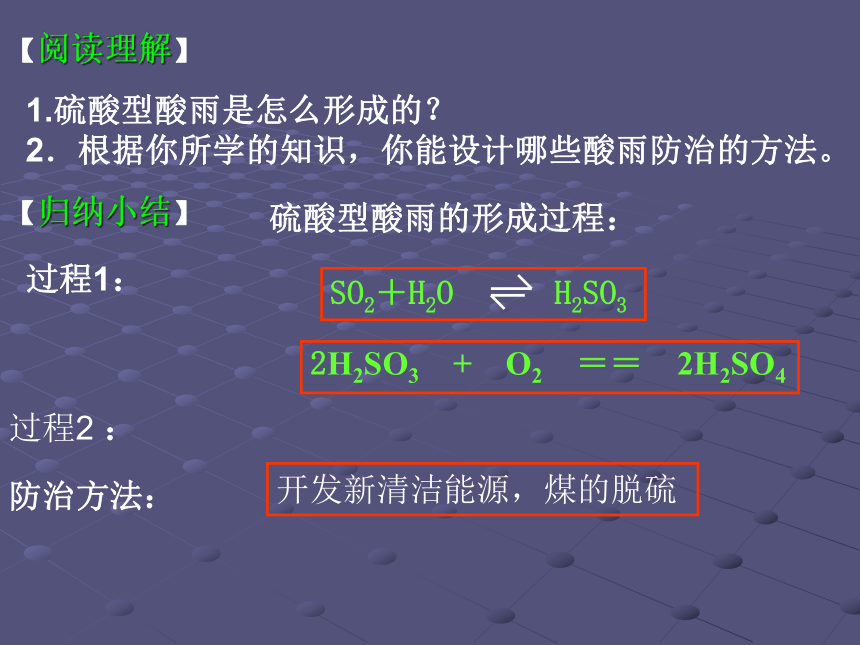
3.亚硫酸盐的还原性强于亚硫酸:写出CaSO3与O2反应的方程式________________【问题解决】 SO2+Ca(OH)2==CaSO3↓+H2O SO2 + 2NH3·H2O = (NH4)2SO3+ H2OSO2+Na2SO3+H2O==2NaHSO3 SO2 + Cl2 + 2H2O == H2SO3 + 2HCl .2CaSO3 + O2 == 2CaSO41.硫酸型酸雨是怎么形成的?
2.根据你所学的知识,你能设计哪些酸雨防治的方法。 硫酸型酸雨的形成过程:【阅读理解】 【归纳小结】 过程1: 2H2SO3 + O2 == 2H2SO4过程2 :防治方法: 开发新清洁能源,煤的脱硫 【目标检测】 1.下列关于二氧化硫的叙述中正确的是 ( )
A.二氧化硫通入澄清石灰水不会变浑浊
B.二氧化硫可使品红溶液褪色
C.二氧化硫使氯水褪色是因为具有漂白性
D.二氧化硫与水反应生成硫酸。B2.不能用于鉴别SO2和CO2的试剂是( )
A.品红溶液 B.氯水
C.澄清石灰水 D.高锰酸钾溶液C3.“酸雨”的形成主要是由于
A.滥伐森林,破坏生态平衡
B.工业上大量燃烧含硫的燃料
C.大气中CO2含量增多
D.汽车排出大量的尾气
4.你认为减少酸雨产生的途径可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤BC二氧化硫的性质和应用 、SO2和CO2的性质比较【课堂小结】 二、酸雨的形成和防治1.形成:
2.危害:
3.防治:2H2SO3 + O2 == 2H2SO4污染水源、酸化土壤 腐蚀建筑设施开发清洁能源 .2CaSO3 + O2 == 2CaSO4SO2+Ca(OH)2==CaSO3+H2O SO2 + 2NH3·H2O = (NH4)2SO3+ H2O脱硫【学习目标】 硫酸的制备和性质 1.了解工业硫酸生产的主要设备,能够说出每个设备中发生的主要反应
2. 理解工业制硫酸的原理,并能够用化学方程式表示
3.了解浓硫酸的吸水性、脱水性。 比较二者的不同
4. .掌握浓硫酸的氧化性,能够熟练写出浓硫酸与铜、炭等反应的方程式。 【你知道吗】 1.硫酸被称为“工业之母”,你知道为什么吗?它有哪些用途?
2.由S怎么制取H2SO4?写出反应的方程式。【交流与讨论】 1.接触法制硫酸包含哪几步?写出各步的反应方程式
2.指出各步反应分别在哪个设备中进行。【归纳小结】 【观察与思考 】 1.浓硫酸的状态
2.实验1中胆矾的颜色有什么变化?为什么?
3.实验(补充):用浓硫酸在白纸上写字,字迹颜色有什么变化?为什么?
4.实验2:观察蔗糖的颜色变化、观察品红溶液颜色的变化。
5.实验3:观察溶液颜色变化、品红溶液颜色的变化?推断反应的生成物。吸水性(原来有水)
2.脱水性(原来没水,但含H、O元素)
3.强氧化性: 【归纳整理 】 浓硫酸的特性:氧化剂、酸性1.浓硫酸与稀硫酸的性质有什么不同?
2.以浓硫酸与Cu反应、稀硫酸与Zn反应为例分析,反应中硫酸作氧化剂的本质有何不同?【交流与讨论 】 1、下列现象反映了硫酸的哪些性质? ⑴把浓硫酸露置在空气里,质量会增加。 ⑵清洗镀件表面氧化物________;
⑶实验室用浓H2SO4干燥制取的氯气。
(4)浓硫酸使湿润石蕊试纸变红,后来又变黑
(5)用铝槽车装运浓硫酸________;
(6)实验室制CO2气体________;【目标检测 】 2.用废铜屑与硫酸反应 制CuSO4,以下两种方法哪个好?为什么
浓硫酸与铜共热
铜先在空气中加热制取氧化铜,再与稀硫酸反应3、向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol 小于0.9mol C、等于0.45mol ?? D、小于0.45mol【课堂小结 】 一、硫酸的工业制取 吸水性(原来有水)
2.脱水性(原来没水,但含H、O元素)
3.强氧化性: △2H2SO4(浓) + C == CO2 + 2SO2 ↑ 二、浓硫酸的特性:2H2SO4(浓) + Cu == CuSO4 + SO2 ↑+2H2O△+6+4氧化剂、酸性【学习目标 】 了解单质硫与金属、O2反应的性质,能够根据写出有关反应方程式。
+4价硫的化合物间的转化以及它们的还原性。
能够构建硫单质及其化合物之间的转化关系图硫和含硫化合物的相互转化 【复习检查】 有线索地回忆上节课的内容并写出有关反应方程式。【交流与讨论】 1.你知道哪些含硫化合物,按化合价对它们进行分类。
2.你学过有哪些硫单质的性质,写出反应方程式。1.分类:
O价 单质S
-2价:H2S FeS S2-
+4价:SO2、 H2SO3 SO32-(Na2SO3等)
+6价: SO3、 SO42-(Na2SO4等)【归纳整理】 2.S单质的性质S的氧化性: S的还原性 根据S 、Cl2与铁反应产物,请推断出S、 Cl2的氧化性哪个更强?S2.反应过程中硫、亚硫酸钠、硫酸、硫化氢的作用。2Na2SO3 + O2 == 2Na2SO4FeS + H2SO4 == FeSO4 + H2S ↑ H2S + Cl2 = S + 2HClS + Hg == Hg S【整理与归纳】 高价氧低价还,中间价态两边兼水平方向反应:氧化还原--向右氧化,向左还原
竖直方向反应:非氧化还原反应。【目标检测】 下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.S SO2 D. SO32- SO2
2.已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2ACC3.可以鉴别K2SO4、K2S、K2SO3三种无色溶液的是( )
A. BaCl2溶液 B. 稀硫酸
C. SO2气体 D. 石蕊试液
4.反应3S + 6KOH === 2K2S + K2SO3 +3H2O 中,被氧化的硫元素与被还原的硫元素的质量比为( )
A. 1:1 B. 1:2 C. 1:3 D. 2:3BB5.下列各组离子在溶液中可以大量共存的是( )
A. H+、SO32-、S2-、K+ B. HS-、Cl-、OH-、Ba2+
C. Na+、K+、S2-、SO42- D. Cu2+、Cl-、OH-、K+
6.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是 ①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓H2SO4溶液;④灼热的铜网;⑤碱石灰 A.①③④???? B.②③④??? ?
C.②④③??? D.③④⑤?CB
2.了解SO2的漂白性及特点。
4.了解硫酸型酸雨的形成及防治方法【你知道吗】 1.什么是酸雨?酸雨有哪些危害?
2.空气中的SO2主要有哪些来源? 1.酸雨:PH<5.6的雨水
2.酸雨的危害:水质酸化,土壤酸化,腐蚀建筑、设备等。
3.SO2主要来源:煤的燃烧、硫酸工业等。【归纳整理】 【观察与思考】 实验1:针筒内气体怎么变化?为什么?
PH试纸的颜色变化?怎么解释?
实验2:加热前后品红溶液的颜色怎么变化?为什么?
实验3:加入H2O2前后溶液中有无沉淀生成?如何解释?【归纳与整理】 1.酸性氧化物: SO2+H2O H2SO3与水反应 与碱反应 SO2+2NaOH==Na2SO3+H2O 2.还原性 可与过氧化氢、氧气、卤素单质(Cl2、Br2、I2)、高锰酸钾等反应。SO2+H2O2==H2SO4 3.漂白性 加热SO2品红溶液不稳定无色物质退色恢复SO2的酸性氧化物性质时,与CO2极相似,请写出下列反应方程式。
SO2通入澄清石灰水中:_______________________
SO2通入NH3·H2O中:
__________________________
SO2通入Na2SO3溶液中:_______________________
2.根据SO2的还原性写出SO2通入氯水的反应方程式:______________________
3.亚硫酸盐的还原性强于亚硫酸:写出CaSO3与O2反应的方程式________________【问题解决】 SO2+Ca(OH)2==CaSO3↓+H2O SO2 + 2NH3·H2O = (NH4)2SO3+ H2OSO2+Na2SO3+H2O==2NaHSO3 SO2 + Cl2 + 2H2O == H2SO3 + 2HCl .2CaSO3 + O2 == 2CaSO41.硫酸型酸雨是怎么形成的?
2.根据你所学的知识,你能设计哪些酸雨防治的方法。 硫酸型酸雨的形成过程:【阅读理解】 【归纳小结】 过程1: 2H2SO3 + O2 == 2H2SO4过程2 :防治方法: 开发新清洁能源,煤的脱硫 【目标检测】 1.下列关于二氧化硫的叙述中正确的是 ( )
A.二氧化硫通入澄清石灰水不会变浑浊
B.二氧化硫可使品红溶液褪色
C.二氧化硫使氯水褪色是因为具有漂白性
D.二氧化硫与水反应生成硫酸。B2.不能用于鉴别SO2和CO2的试剂是( )
A.品红溶液 B.氯水
C.澄清石灰水 D.高锰酸钾溶液C3.“酸雨”的形成主要是由于
A.滥伐森林,破坏生态平衡
B.工业上大量燃烧含硫的燃料
C.大气中CO2含量增多
D.汽车排出大量的尾气
4.你认为减少酸雨产生的途径可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤BC二氧化硫的性质和应用 、SO2和CO2的性质比较【课堂小结】 二、酸雨的形成和防治1.形成:
2.危害:
3.防治:2H2SO3 + O2 == 2H2SO4污染水源、酸化土壤 腐蚀建筑设施开发清洁能源 .2CaSO3 + O2 == 2CaSO4SO2+Ca(OH)2==CaSO3+H2O SO2 + 2NH3·H2O = (NH4)2SO3+ H2O脱硫【学习目标】 硫酸的制备和性质 1.了解工业硫酸生产的主要设备,能够说出每个设备中发生的主要反应
2. 理解工业制硫酸的原理,并能够用化学方程式表示
3.了解浓硫酸的吸水性、脱水性。 比较二者的不同
4. .掌握浓硫酸的氧化性,能够熟练写出浓硫酸与铜、炭等反应的方程式。 【你知道吗】 1.硫酸被称为“工业之母”,你知道为什么吗?它有哪些用途?
2.由S怎么制取H2SO4?写出反应的方程式。【交流与讨论】 1.接触法制硫酸包含哪几步?写出各步的反应方程式
2.指出各步反应分别在哪个设备中进行。【归纳小结】 【观察与思考 】 1.浓硫酸的状态
2.实验1中胆矾的颜色有什么变化?为什么?
3.实验(补充):用浓硫酸在白纸上写字,字迹颜色有什么变化?为什么?
4.实验2:观察蔗糖的颜色变化、观察品红溶液颜色的变化。
5.实验3:观察溶液颜色变化、品红溶液颜色的变化?推断反应的生成物。吸水性(原来有水)
2.脱水性(原来没水,但含H、O元素)
3.强氧化性: 【归纳整理 】 浓硫酸的特性:氧化剂、酸性1.浓硫酸与稀硫酸的性质有什么不同?
2.以浓硫酸与Cu反应、稀硫酸与Zn反应为例分析,反应中硫酸作氧化剂的本质有何不同?【交流与讨论 】 1、下列现象反映了硫酸的哪些性质? ⑴把浓硫酸露置在空气里,质量会增加。 ⑵清洗镀件表面氧化物________;
⑶实验室用浓H2SO4干燥制取的氯气。
(4)浓硫酸使湿润石蕊试纸变红,后来又变黑
(5)用铝槽车装运浓硫酸________;
(6)实验室制CO2气体________;【目标检测 】 2.用废铜屑与硫酸反应 制CuSO4,以下两种方法哪个好?为什么
浓硫酸与铜共热
铜先在空气中加热制取氧化铜,再与稀硫酸反应3、向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol 小于0.9mol C、等于0.45mol ?? D、小于0.45mol【课堂小结 】 一、硫酸的工业制取 吸水性(原来有水)
2.脱水性(原来没水,但含H、O元素)
3.强氧化性: △2H2SO4(浓) + C == CO2 + 2SO2 ↑ 二、浓硫酸的特性:2H2SO4(浓) + Cu == CuSO4 + SO2 ↑+2H2O△+6+4氧化剂、酸性【学习目标 】 了解单质硫与金属、O2反应的性质,能够根据写出有关反应方程式。
+4价硫的化合物间的转化以及它们的还原性。
能够构建硫单质及其化合物之间的转化关系图硫和含硫化合物的相互转化 【复习检查】 有线索地回忆上节课的内容并写出有关反应方程式。【交流与讨论】 1.你知道哪些含硫化合物,按化合价对它们进行分类。
2.你学过有哪些硫单质的性质,写出反应方程式。1.分类:
O价 单质S
-2价:H2S FeS S2-
+4价:SO2、 H2SO3 SO32-(Na2SO3等)
+6价: SO3、 SO42-(Na2SO4等)【归纳整理】 2.S单质的性质S的氧化性: S的还原性 根据S 、Cl2与铁反应产物,请推断出S、 Cl2的氧化性哪个更强?S
竖直方向反应:非氧化还原反应。【目标检测】 下列转化需要加入氧化剂才能实现的是( )
A.H2S SO2 B. H2SO4 SO2
C.S SO2 D. SO32- SO2
2.已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2ACC3.可以鉴别K2SO4、K2S、K2SO3三种无色溶液的是( )
A. BaCl2溶液 B. 稀硫酸
C. SO2气体 D. 石蕊试液
4.反应3S + 6KOH === 2K2S + K2SO3 +3H2O 中,被氧化的硫元素与被还原的硫元素的质量比为( )
A. 1:1 B. 1:2 C. 1:3 D. 2:3BB5.下列各组离子在溶液中可以大量共存的是( )
A. H+、SO32-、S2-、K+ B. HS-、Cl-、OH-、Ba2+
C. Na+、K+、S2-、SO42- D. Cu2+、Cl-、OH-、K+
6.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是 ①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓H2SO4溶液;④灼热的铜网;⑤碱石灰 A.①③④???? B.②③④??? ?
C.②④③??? D.③④⑤?CB
