金属晶体[上学期]
图片预览






文档简介
课件14张PPT。 第一节
重要的氧化剂和还原剂制作人:崔安禳二、重要氧化剂和还原剂的常见反应 卤族元素单质是我们最常见的氧化剂,请大家设计实验证明Cl2、Br2、I2的氧化性强弱顺序。2Br-+Cl2 = Br2+ 2Cl-
2I- + Cl2 = I2 + 2Cl-
2I- + Br2 = I2 + 2Br-二、重要氧化剂和还原剂的常见反应 同一主族元素的非金属单质,其氧化性随着电子层数的增加而逐渐减弱,其对应的阴离子的还原性却逐渐增强1.对于氧化剂对于典型的金属元素——碱金属,
它们的还原性强弱顺序如何?
其对应阳离子时氧化性强弱顺序又当怎样?Li、Na、K、Rb、CsLi+ 、Na+ 、K+ 、Rb+ 、Cs+还原性逐渐增强氧化性逐渐减弱K、Ca、Na、Mg、Al、Zn、Fe、Sn、
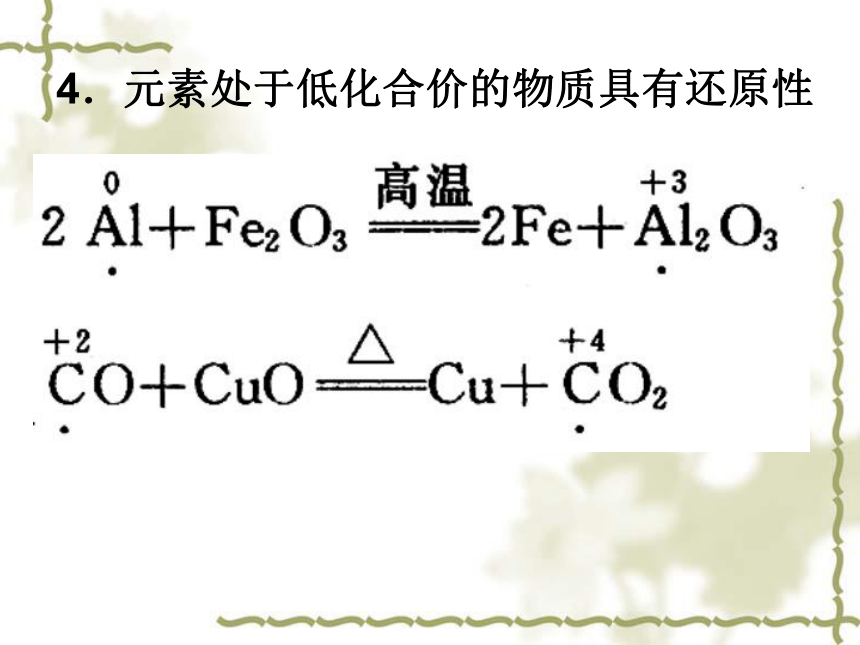
Pb、(H) Cu、Hg、Ag、Pt、Au K+、Ca2+、 Na+、 Mg2+、Al3+、Zn2+、Fe2+、Sn2+、 Pb2+、(H+) Cu2+、Hg+、Ag+、Pt+、Au3+ 氧化性逐渐增强还原性逐渐减弱2. 对于还原剂3.元素处于高化合价的物质具有氧化性4.元素处于低化合价的物质具有还原性5.浓、稀硫酸的氧化性?C + 2H2SO4(浓) = CO2↑+SO2↑+2H2O ?Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O 6.浓、稀硝酸均为氧化性酸Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OFeFe 2+7.具有多种可变化合价的金属元素 Fe3+没有氧化性,还原性较强氧化性较弱氧化性较强 说明同一元素不同价态的物质问发生氧化还原反应时, 实验: 在盛有FeCl3溶液的试管中滴加KSCN溶液,溶液变红色,在变红色后的溶液中加人Fe粉,红色褪去。 其氧化、还原产物中该元素的化合价遵循什么规律? 归中规律 2Fe3++Fe = 3Fe2+
2H2S+SO2 = 3S+2H2O
ClO-+Cl-+2H+ = Cl2+H2O
IO3-+5I-+6H+ = 3I2+3H2O(验证食盐含碘元素)8.趋中规律-常见实例讨论:已知在常温时能发生下列反应:Fe +Cu2+ = Fe2++Cu
2Fe2++Br2 = 2Fe3++2Br-
2Fe3++Cu = 2Fe2++Cu2+ Fe3+、Fe 2+、Cu2+、Br2作为氧化剂时,其氧化能力的强弱顺序。Cu+2FeCl3=CuCl2+2FeCl2 氧化剂与还原剂在一定条件下反应时:
总结相对弱的氧化剂一般是生成相对弱的还原剂强氧化剂制弱氧化剂强还原剂制弱还原剂即:Cl2+2KI = 2KCl+I22Al+3CuCl2=2AlCl3+3Cu
重要的氧化剂和还原剂制作人:崔安禳二、重要氧化剂和还原剂的常见反应 卤族元素单质是我们最常见的氧化剂,请大家设计实验证明Cl2、Br2、I2的氧化性强弱顺序。2Br-+Cl2 = Br2+ 2Cl-
2I- + Cl2 = I2 + 2Cl-
2I- + Br2 = I2 + 2Br-二、重要氧化剂和还原剂的常见反应 同一主族元素的非金属单质,其氧化性随着电子层数的增加而逐渐减弱,其对应的阴离子的还原性却逐渐增强1.对于氧化剂对于典型的金属元素——碱金属,
它们的还原性强弱顺序如何?
其对应阳离子时氧化性强弱顺序又当怎样?Li、Na、K、Rb、CsLi+ 、Na+ 、K+ 、Rb+ 、Cs+还原性逐渐增强氧化性逐渐减弱K、Ca、Na、Mg、Al、Zn、Fe、Sn、
Pb、(H) Cu、Hg、Ag、Pt、Au K+、Ca2+、 Na+、 Mg2+、Al3+、Zn2+、Fe2+、Sn2+、 Pb2+、(H+) Cu2+、Hg+、Ag+、Pt+、Au3+ 氧化性逐渐增强还原性逐渐减弱2. 对于还原剂3.元素处于高化合价的物质具有氧化性4.元素处于低化合价的物质具有还原性5.浓、稀硫酸的氧化性?C + 2H2SO4(浓) = CO2↑+SO2↑+2H2O ?Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O 6.浓、稀硝酸均为氧化性酸Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OFeFe 2+7.具有多种可变化合价的金属元素 Fe3+没有氧化性,还原性较强氧化性较弱氧化性较强 说明同一元素不同价态的物质问发生氧化还原反应时, 实验: 在盛有FeCl3溶液的试管中滴加KSCN溶液,溶液变红色,在变红色后的溶液中加人Fe粉,红色褪去。 其氧化、还原产物中该元素的化合价遵循什么规律? 归中规律 2Fe3++Fe = 3Fe2+
2H2S+SO2 = 3S+2H2O
ClO-+Cl-+2H+ = Cl2+H2O
IO3-+5I-+6H+ = 3I2+3H2O(验证食盐含碘元素)8.趋中规律-常见实例讨论:已知在常温时能发生下列反应:Fe +Cu2+ = Fe2++Cu
2Fe2++Br2 = 2Fe3++2Br-
2Fe3++Cu = 2Fe2++Cu2+ Fe3+、Fe 2+、Cu2+、Br2作为氧化剂时,其氧化能力的强弱顺序。Cu+2FeCl3=CuCl2+2FeCl2 氧化剂与还原剂在一定条件下反应时:
总结相对弱的氧化剂一般是生成相对弱的还原剂强氧化剂制弱氧化剂强还原剂制弱还原剂即:Cl2+2KI = 2KCl+I22Al+3CuCl2=2AlCl3+3Cu
