电解原理[上学期]
图片预览







文档简介
课件23张PPT。高三化学第一节 电解原理制作人:崔安禳问题与讨论:1、电解质溶液的电解过程就是电解质溶液的导电过程。
2、电解质溶液的导电与金属导电的区别。3、电解与电离的区别。4、原电池与电解池的区别电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子
例: CuCl2=Cu2++2Cl—
阴阳离子定向移动,在两极上发生氧化还原反应。如: 只产生自由移动的离子 电解必须建立在电离的基础上发生氧化还原反应生成了新物质
电能转化为化学能化学能转化为电能反应不自发,可以是两个活性相同的电极反应自发,两个活性不同的电极接电源正极,阳极作为负极,对外电路送出电子接电源负极,阴极作为正极,接受由外电路流回的电子阴离子向阳极迁移
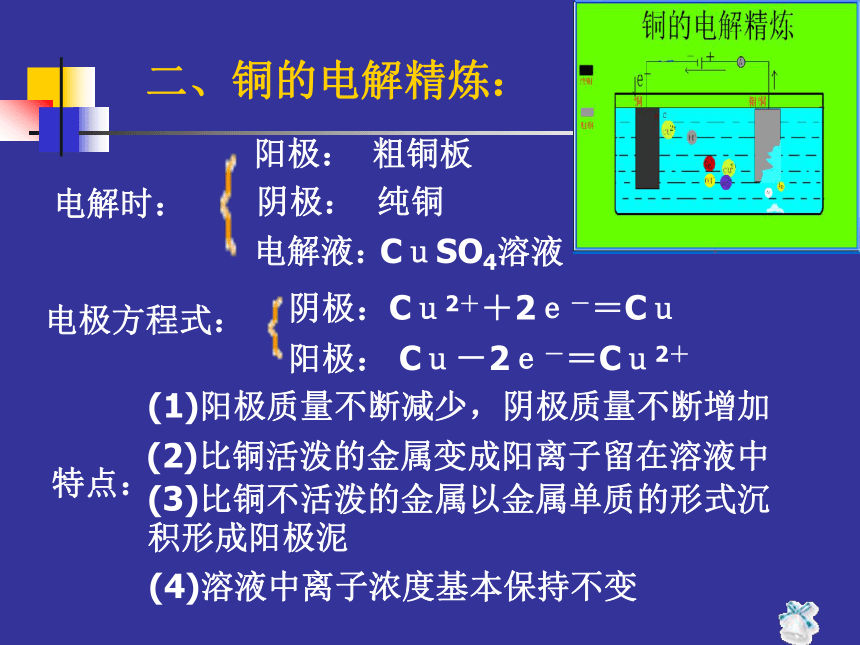
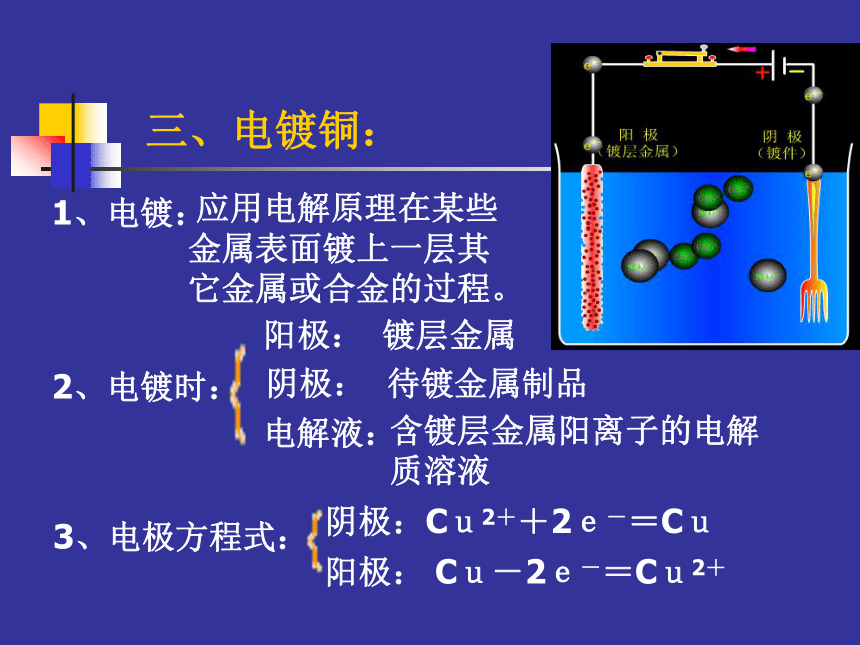
阳离子向阴极迁移阴离子向负极迁移阳离子向正极迁移两个电极、导线、电解质溶液二、铜的电解精炼:电解时:电极方程式:阴极:Cu2++2e-=Cu阳极: Cu-2e-=Cu2+特点:(1)阳极质量不断减少,阴极质量不断增加(2)比铜活泼的金属变成阳离子留在溶液中(3)比铜不活泼的金属以金属单质的形式沉积形成阳极泥阴极:纯铜阳极:粗铜板电解液:CuSO4溶液(4)溶液中离子浓度基本保持不变三、电镀铜: 应用电解原理在某些金属表面镀上一层其它金属或合金的过程。1、电镀:2、电镀时:阴极:待镀金属制品阳极:镀层金属电解液:含镀层金属阳离子的电解质溶液3、电极方程式:阴极:Cu2++2e-=Cu阳极: Cu-2e-=Cu2+三、电镀铜:4、特点:阳极(镀层金属)不断减少阴极(镀件)不断增加电解质溶液浓度保持不变。想一想(1)如何使镀层致密、坚固、光亮?(2)如何减少电镀污染?以石墨为电极,电解下列物质:想一想盐酸、水
2. NaCl溶液、AgNO3溶液、CuSO4溶液
3. Na2SO4溶液、H2SO4溶液、NaOH溶液一、电解原理4. 离子放电顺序(氧化还原能力强弱)阳离子:Ag+>Cu2+>(H+)>Fe2+>Zn2+>(H+)>Al3+ 阴离子:S2- > I - >Br - >Cl - > OH - >含氧酸根>F-一、电解原理 5. 电极反应: 阳极反应:(1)金属电极失电子:M-ne - =Mn+(金属电极)(2)无氧酸根失电子:2X—-2e - =X2(3)氢氧根失电子:4OH—-4e - =2H2O+O2 ↑阴极反应:(2)氢离子得电子:2H++2e-=H2 ↑(3)氢前阳离子得电子: Mn+ +ne - = M(1)氢后阳离子得电子: Mn+ +ne - = M惰性电极本节内容小结电解的原理与本质电解的一般规律电极的判断、电极方程式的书写以碳棒作两极材料,画出电解硫酸铜水溶液的装置图。并注明阳极、阴极,写出两极电极反应式及总的电解化学方程式. 练习阳极:4OH—-4e—=2H2O+O2↑
阴极:Cu2++2e—=Cu
总反应式:2CuSO4+2H2O=2Cu+O2↑+2H2SO4
电解指出下列装置的名称、电极名称,写出电极反应式,并表示出电子移动方向。 练习Ⅰ Ⅱe-e-e-e-e--+阳阴原电池电解池 在相同条件下,以石墨作为电极,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为
A.108g B.54g
C.216g D.64g
练习:作业:课本54——55页原电池的构成条件:1. 两种活动性不同的金属(或金属与非金属导体)作电极。2. 电极材料插入电解质溶液中。3. 两极相连形成闭合回路。CuCl2溶液CC再 见
2、电解质溶液的导电与金属导电的区别。3、电解与电离的区别。4、原电池与电解池的区别电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子
例: CuCl2=Cu2++2Cl—
阴阳离子定向移动,在两极上发生氧化还原反应。如: 只产生自由移动的离子 电解必须建立在电离的基础上发生氧化还原反应生成了新物质
电能转化为化学能化学能转化为电能反应不自发,可以是两个活性相同的电极反应自发,两个活性不同的电极接电源正极,阳极作为负极,对外电路送出电子接电源负极,阴极作为正极,接受由外电路流回的电子阴离子向阳极迁移
阳离子向阴极迁移阴离子向负极迁移阳离子向正极迁移两个电极、导线、电解质溶液二、铜的电解精炼:电解时:电极方程式:阴极:Cu2++2e-=Cu阳极: Cu-2e-=Cu2+特点:(1)阳极质量不断减少,阴极质量不断增加(2)比铜活泼的金属变成阳离子留在溶液中(3)比铜不活泼的金属以金属单质的形式沉积形成阳极泥阴极:纯铜阳极:粗铜板电解液:CuSO4溶液(4)溶液中离子浓度基本保持不变三、电镀铜: 应用电解原理在某些金属表面镀上一层其它金属或合金的过程。1、电镀:2、电镀时:阴极:待镀金属制品阳极:镀层金属电解液:含镀层金属阳离子的电解质溶液3、电极方程式:阴极:Cu2++2e-=Cu阳极: Cu-2e-=Cu2+三、电镀铜:4、特点:阳极(镀层金属)不断减少阴极(镀件)不断增加电解质溶液浓度保持不变。想一想(1)如何使镀层致密、坚固、光亮?(2)如何减少电镀污染?以石墨为电极,电解下列物质:想一想盐酸、水
2. NaCl溶液、AgNO3溶液、CuSO4溶液
3. Na2SO4溶液、H2SO4溶液、NaOH溶液一、电解原理4. 离子放电顺序(氧化还原能力强弱)阳离子:Ag+>Cu2+>(H+)>Fe2+>Zn2+>(H+)>Al3+ 阴离子:S2- > I - >Br - >Cl - > OH - >含氧酸根>F-一、电解原理 5. 电极反应: 阳极反应:(1)金属电极失电子:M-ne - =Mn+(金属电极)(2)无氧酸根失电子:2X—-2e - =X2(3)氢氧根失电子:4OH—-4e - =2H2O+O2 ↑阴极反应:(2)氢离子得电子:2H++2e-=H2 ↑(3)氢前阳离子得电子: Mn+ +ne - = M(1)氢后阳离子得电子: Mn+ +ne - = M惰性电极本节内容小结电解的原理与本质电解的一般规律电极的判断、电极方程式的书写以碳棒作两极材料,画出电解硫酸铜水溶液的装置图。并注明阳极、阴极,写出两极电极反应式及总的电解化学方程式. 练习阳极:4OH—-4e—=2H2O+O2↑
阴极:Cu2++2e—=Cu
总反应式:2CuSO4+2H2O=2Cu+O2↑+2H2SO4
电解指出下列装置的名称、电极名称,写出电极反应式,并表示出电子移动方向。 练习Ⅰ Ⅱe-e-e-e-e--+阳阴原电池电解池 在相同条件下,以石墨作为电极,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为
A.108g B.54g
C.216g D.64g
练习:作业:课本54——55页原电池的构成条件:1. 两种活动性不同的金属(或金属与非金属导体)作电极。2. 电极材料插入电解质溶液中。3. 两极相连形成闭合回路。CuCl2溶液CC再 见
