离子键 必修II(浙江省温州市苍南县)
图片预览





文档简介
课件19张PPT。(一)离子键专题1 微观结构与物质的多样性第二单元 微粒之间的相互作用力议一议:构成物质的基本微粒有哪几种?分别举例说明。
想一想:不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
例如:水在直流电的作用下分解
2H2O === 2H2↑ + O2↑
水在通电条件下能够发生分解,为什么要通电?
水分子是由两个氢原子和一个氧原子构成的,氢原子和氧原子之间存在着很强的相互作用,要破坏这种相互作用就需要消耗能量,通电正是为了提供使水分解所需要的能量。 通电 氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;
氯气是由许多氯分子构成的,分子中两个氯原子间存在着强烈的相互作用;
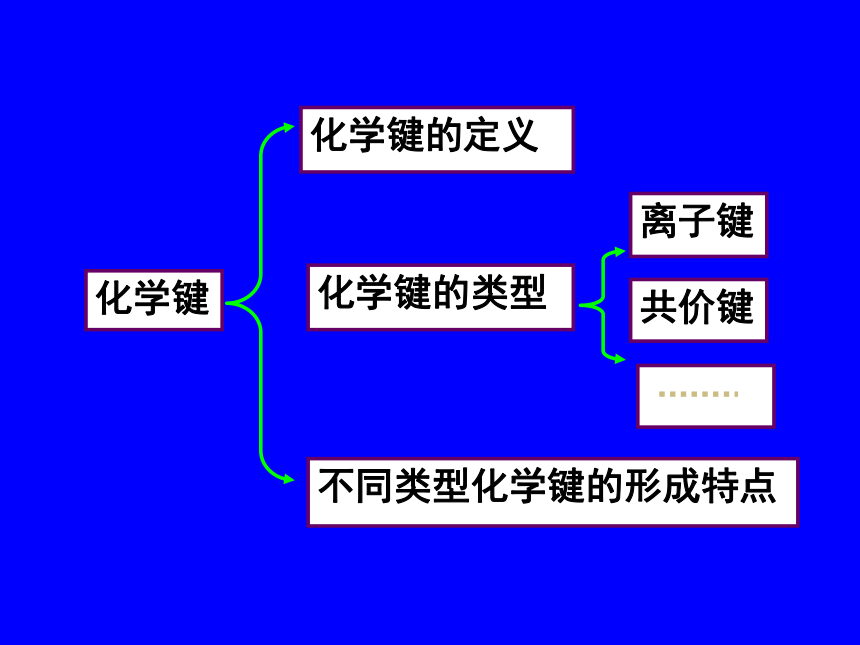
金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。 从上述讨论中,我们可以看到,由原子结合成分子时,或由离子构成化合物时,原子或离子之间存在着强烈的相互作用,这种强烈的相互作用存在于直接相邻的原子或离子之间。通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。化学键化学键化学键的定义化学键的类型离子键共价键不同类型化学键的形成特点一、化学键物质中直接相邻的原子或离子之间存在的强烈的相互作用
注:1、直接相邻
2、强烈的相互作用
3、化学键的分类:A、离子键 B、共价键二、离子键以氯化钠的形成过程为例分析离子键的成因电子转移不稳定稳定思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子间的静电相互吸引作用不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。阴阳离子结合在一起,彼此电荷是否会抵消呢?电子与电子、原子核与原子核间的相互排斥作用1、定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键 使阴阳离子结合成化合物的静电作用,叫 做离子键。思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。2、电子式 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式 [ 练习1] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子 铝离子离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 [ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 注:在箭头左面是原子的电子式,右面是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。小结 使阴阳离子结合成化合物的静电作用,叫做离子键。 含有离子键的化合物一定是离子化合物区分: 用电子式表示物质
用电子式表示物质形成过程
想一想:不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
例如:水在直流电的作用下分解
2H2O === 2H2↑ + O2↑
水在通电条件下能够发生分解,为什么要通电?
水分子是由两个氢原子和一个氧原子构成的,氢原子和氧原子之间存在着很强的相互作用,要破坏这种相互作用就需要消耗能量,通电正是为了提供使水分解所需要的能量。 通电 氯化钠和氯化镁是由阴、阳离子构成的,离子间存在强烈的相互作用;
氯气是由许多氯分子构成的,分子中两个氯原子间存在着强烈的相互作用;
金刚石是由许多碳原子彼此结合形成的空间网状晶体,在晶体中,直接相邻的碳原子间存在强烈的相互作用。 从上述讨论中,我们可以看到,由原子结合成分子时,或由离子构成化合物时,原子或离子之间存在着强烈的相互作用,这种强烈的相互作用存在于直接相邻的原子或离子之间。通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。化学键化学键化学键的定义化学键的类型离子键共价键不同类型化学键的形成特点一、化学键物质中直接相邻的原子或离子之间存在的强烈的相互作用
注:1、直接相邻
2、强烈的相互作用
3、化学键的分类:A、离子键 B、共价键二、离子键以氯化钠的形成过程为例分析离子键的成因电子转移不稳定稳定思考在氯化钠晶体中,Na+和Cl- 间存在哪些力? Na+离子和Cl-离子间的静电相互吸引作用不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。阴阳离子结合在一起,彼此电荷是否会抵消呢?电子与电子、原子核与原子核间的相互排斥作用1、定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键 使阴阳离子结合成化合物的静电作用,叫 做离子键。思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。2、电子式 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。电子式 [ 练习1] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子 铝离子离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 [ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 注:在箭头左面是原子的电子式,右面是离子化合物的电子式,相同原子的电子式可合并,但不建议,但离子化合物中相同离子不能合并。小结 使阴阳离子结合成化合物的静电作用,叫做离子键。 含有离子键的化合物一定是离子化合物区分: 用电子式表示物质
用电子式表示物质形成过程
