热量变化 必修II(浙江省温州市苍南县)
文档属性
| 名称 | 热量变化 必修II(浙江省温州市苍南县) |

|
|
| 格式 | rar | ||
| 文件大小 | 161.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-08-12 00:00:00 | ||
图片预览





文档简介
课件19张PPT。第二单元
化学反应中的热量一.化学反应中的热量变化化学化学变化中除有新物质生成外,必然伴随有能量(热能、光能、电能)的变化。利用化学反应:一是制取物质、二是利用反应中的能量
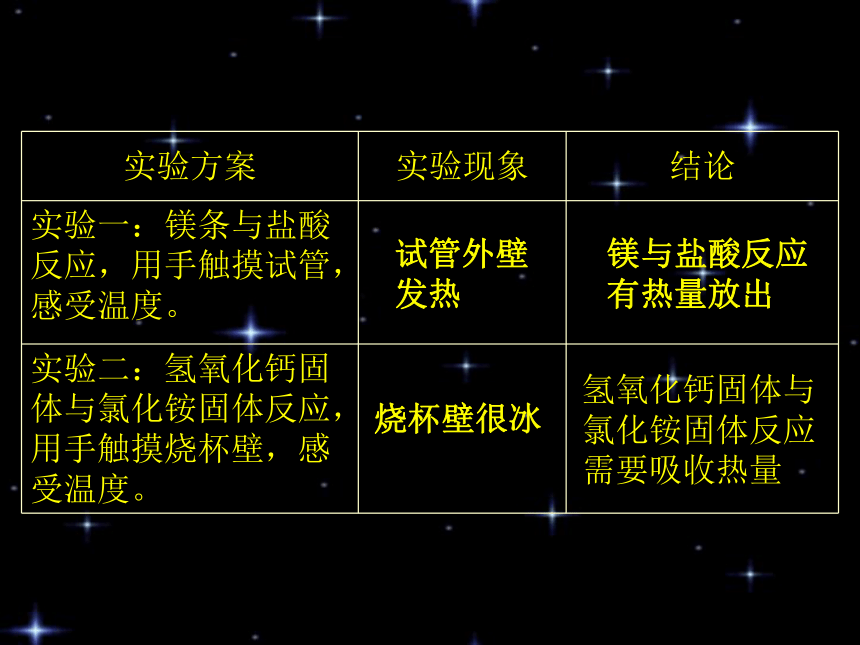
试管外壁
发热镁与盐酸反应
有热量放出烧杯壁很冰氢氧化钙固体与
氯化铵固体反应
需要吸收热量化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一.化学反应中的热量变化1.放热反应和吸热反应O2H2O能量能量为什么有的化学反应放热,有的却吸热??(吸收能量)旧分子拆开 原子(放出能量)新分子结合吸收能量<放出能量吸收能量>放出能量放热反应吸热反应决定计算:
已知1mol H2中的H-H键断裂时吸收436.4kJ的能量
1molCl2中的Cl-Cl键断裂时吸收242.7kJ的能量
1molHCl中的H-Cl键形成时放出431.8kJ的能量
求1mol H2与1molCl2反应生成2mol HCl过程中的能量变化
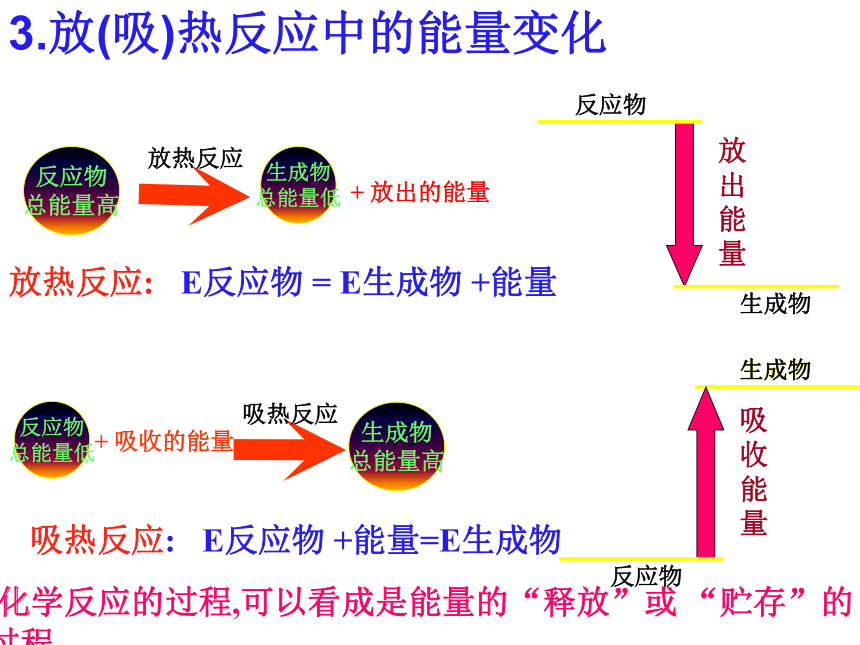
放出431.8kJ×2-(436.4kJ+242.7kJ)=184.5kJ的能量。3.放(吸)热反应中的能量变化反应物
总能量高生成物
总能量低放热反应反应物
总能量低生成物
总能量高吸热反应+ 放出的能量+ 吸收的能量放热反应:E反应物 = E生成物 +能量吸热反应:E反应物 +能量=E生成物 化学反应的过程,可以看成是能量的“释放”或 “贮存”的过程
计算:
刚才1mol H2中的H-H键断裂时吸收436.4kJ的能量
1molCl2中的Cl-Cl键断裂时吸收242.7kJ的能量
1molHCl中的H-Cl键形成时放出431.8kJ的能量
可得1mol H2与1molCl2反应生成2mol HCl
放出431.8kJ×2-(436.4kJ+242.7kJ)=184.5kJ的能量
现求2mol HCl 分解生成1mol H2与1molCl2反应生成过程中
的能量变化
下面是某同学关于吸、放热的说法,你同意她的说法吗?
请陈述理由(结合反应吸放热的原理及具体实例)
甲同学说:凡经加热而发生的化学反应都是吸热反应
凡不经加热就能发生的化学反应一定是放热反应乙同学说:反应中要持续加热才能进行的化学反应
是吸热反应问题解决判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温下木炭与二氧化碳反应生成一氧化碳。
3.氧化钙与水的反应。
4.高温煅烧石灰石(主要成分是CaC03)制生石灰(CaO)。
5.炸药爆炸
6.Ba(OH)2·8H2O和NH4Cl的反应
7.炽热的碳与CO2的反应
8.甲烷在氧气中的燃烧一. 化学反应中的能量变化2.常见的放(吸)热反应1.金属与酸的反应
2.所有的燃烧反应(包括爆炸反应)
3.酸碱中和反应
4.大多数化合反应反应热(1)定义:在化学反应中放出或吸收的热量叫反应热。
(2)符号:
(3)单位:△H kJ ?mol-1 二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。 如:C(s)+O2(g)==CO2(g) △H=-393.5kJ ?mol-12H2(g) + O2(g) = 2H2O(l) △H= -571.6KJ·mol-1H2(g) + 1/2O2(g) = H2O(l) △H= -285.8KJ·mol-1H2(g) + 1/2O2(g) = H2O(g) △H= -241.8KJ·mol-1思考: 热化学方程式与普通化学方程式有何区别?(1)标明各物质的聚集状态(s,l,g)
(2)系数只表示物质的量,可以为分数(3)注明反应热△H2. 热化学方程式的书写步骤(1)写出正确的化学方程式(2)标明各物质的聚集状态(3)注明反应热(△H>0表示吸热, △H<0表示放热
单位:KJ·mol-1)思考: 同一反应的△H与哪些因素有关?反应物系数和各物质的聚集状态1、下列热化学方程式书写正确的是A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol 练习:C2、典型例题 判断热化学方程式的正误;(2003年)已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A.H2O(g)=H2 (g)+1/2O2 (g) ;ΔH=+242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=+484kJ·mol-1
A注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。例2. 已知每1 mol 辛烷(C8H18 液态)完全燃烧生成二氧化碳和液态水时将放出5472kJ热量,写出该反应的热化学方程式。3、当1g氨气安全分解为N2和H2时,吸收2.718KJ的热量,写出其热化学反应方程。
化学反应中的热量一.化学反应中的热量变化化学化学变化中除有新物质生成外,必然伴随有能量(热能、光能、电能)的变化。利用化学反应:一是制取物质、二是利用反应中的能量
试管外壁
发热镁与盐酸反应
有热量放出烧杯壁很冰氢氧化钙固体与
氯化铵固体反应
需要吸收热量化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。一.化学反应中的热量变化1.放热反应和吸热反应O2H2O能量能量为什么有的化学反应放热,有的却吸热??(吸收能量)旧分子拆开 原子(放出能量)新分子结合吸收能量<放出能量吸收能量>放出能量放热反应吸热反应决定计算:
已知1mol H2中的H-H键断裂时吸收436.4kJ的能量
1molCl2中的Cl-Cl键断裂时吸收242.7kJ的能量
1molHCl中的H-Cl键形成时放出431.8kJ的能量
求1mol H2与1molCl2反应生成2mol HCl过程中的能量变化
放出431.8kJ×2-(436.4kJ+242.7kJ)=184.5kJ的能量。3.放(吸)热反应中的能量变化反应物
总能量高生成物
总能量低放热反应反应物
总能量低生成物
总能量高吸热反应+ 放出的能量+ 吸收的能量放热反应:E反应物 = E生成物 +能量吸热反应:E反应物 +能量=E生成物 化学反应的过程,可以看成是能量的“释放”或 “贮存”的过程
计算:
刚才1mol H2中的H-H键断裂时吸收436.4kJ的能量
1molCl2中的Cl-Cl键断裂时吸收242.7kJ的能量
1molHCl中的H-Cl键形成时放出431.8kJ的能量
可得1mol H2与1molCl2反应生成2mol HCl
放出431.8kJ×2-(436.4kJ+242.7kJ)=184.5kJ的能量
现求2mol HCl 分解生成1mol H2与1molCl2反应生成过程中
的能量变化
下面是某同学关于吸、放热的说法,你同意她的说法吗?
请陈述理由(结合反应吸放热的原理及具体实例)
甲同学说:凡经加热而发生的化学反应都是吸热反应
凡不经加热就能发生的化学反应一定是放热反应乙同学说:反应中要持续加热才能进行的化学反应
是吸热反应问题解决判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温下木炭与二氧化碳反应生成一氧化碳。
3.氧化钙与水的反应。
4.高温煅烧石灰石(主要成分是CaC03)制生石灰(CaO)。
5.炸药爆炸
6.Ba(OH)2·8H2O和NH4Cl的反应
7.炽热的碳与CO2的反应
8.甲烷在氧气中的燃烧一. 化学反应中的能量变化2.常见的放(吸)热反应1.金属与酸的反应
2.所有的燃烧反应(包括爆炸反应)
3.酸碱中和反应
4.大多数化合反应反应热(1)定义:在化学反应中放出或吸收的热量叫反应热。
(2)符号:
(3)单位:△H kJ ?mol-1 二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式叫热化学方程式。 如:C(s)+O2(g)==CO2(g) △H=-393.5kJ ?mol-12H2(g) + O2(g) = 2H2O(l) △H= -571.6KJ·mol-1H2(g) + 1/2O2(g) = H2O(l) △H= -285.8KJ·mol-1H2(g) + 1/2O2(g) = H2O(g) △H= -241.8KJ·mol-1思考: 热化学方程式与普通化学方程式有何区别?(1)标明各物质的聚集状态(s,l,g)
(2)系数只表示物质的量,可以为分数(3)注明反应热△H2. 热化学方程式的书写步骤(1)写出正确的化学方程式(2)标明各物质的聚集状态(3)注明反应热(△H>0表示吸热, △H<0表示放热
单位:KJ·mol-1)思考: 同一反应的△H与哪些因素有关?反应物系数和各物质的聚集状态1、下列热化学方程式书写正确的是A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol 练习:C2、典型例题 判断热化学方程式的正误;(2003年)已知在1×105 Pa,298K条件下,2mol氢气
燃烧生成水蒸气放出 484kJ热量,下列热化学方程式
正确的是 A.H2O(g)=H2 (g)+1/2O2 (g) ;ΔH=+242kJ·mol-1 B.2H2(g)+O2(g)=2H2O(l) ;ΔH=-484kJ·mol-1 C.H2 (g)+1/2O2 (g)=H2O(g) ;ΔH=+242kJ·mol-1 D.2H2 (g)+O2 (g)=2H2O(g) ;ΔH=+484kJ·mol-1
A注意:①物质聚集状态②吸放热与ΔH 的“+”、“-”
③吸放热的量与系数对应例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。例2. 已知每1 mol 辛烷(C8H18 液态)完全燃烧生成二氧化碳和液态水时将放出5472kJ热量,写出该反应的热化学方程式。3、当1g氨气安全分解为N2和H2时,吸收2.718KJ的热量,写出其热化学反应方程。
