元素周期表 必修II(浙江省温州市苍南县)
文档属性
| 名称 | 元素周期表 必修II(浙江省温州市苍南县) |  | |
| 格式 | rar | ||
| 文件大小 | 51.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-08-12 19:42:00 | ||
图片预览



文档简介
课件16张PPT。小结元素周期表的结构:七个横行七周期,三短三长一不全周期序数 = 电子层数 十八纵行十六族、七主七副一零一八主族序数 = 最外层电子数
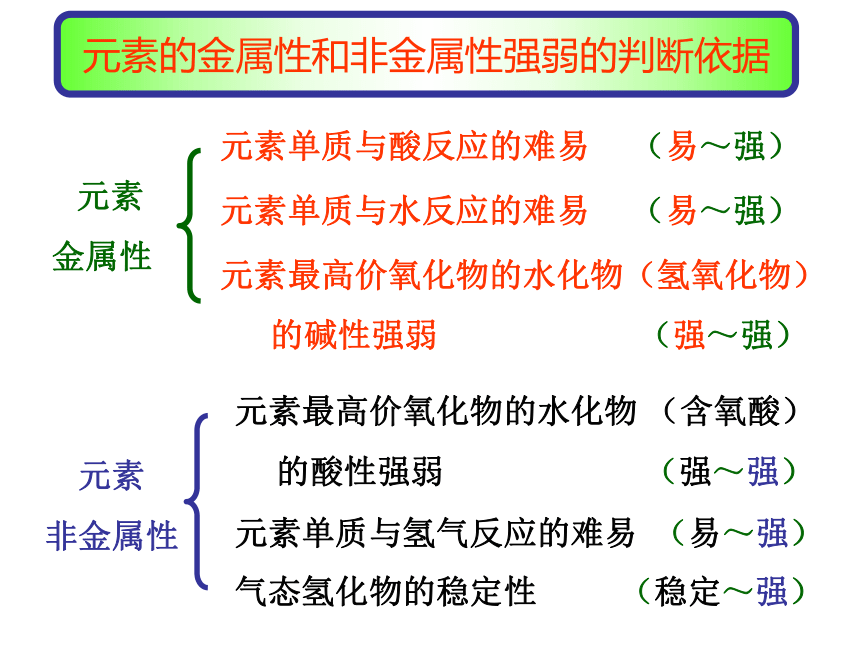
元素的金属性和非金属性强弱的判断依据
元素
金属性 元素单质与酸反应的难易 (易~强) 元素单质与水反应的难易 (易~强) 元素最高价氧化物的水化物(氢氧化物)
的碱性强弱 (强~强) 元素最高价氧化物的水化物 (含氧酸)
的酸性强弱 (强~强) 元素单质与氢气反应的难易 (易~强) 气态氢化物的稳定性 (稳定~强) 元素
非金属性1、电子层数越多—原子半径 —原
子核对电子的引力 —原子失去电子
的能力 (得电子能力 )—元
素金属性 (非金属性 )2、电子层数相同,核电荷数越大—原子
半径 —原子核对电子的引力 —
原子失去电子的能力 (得电子能力
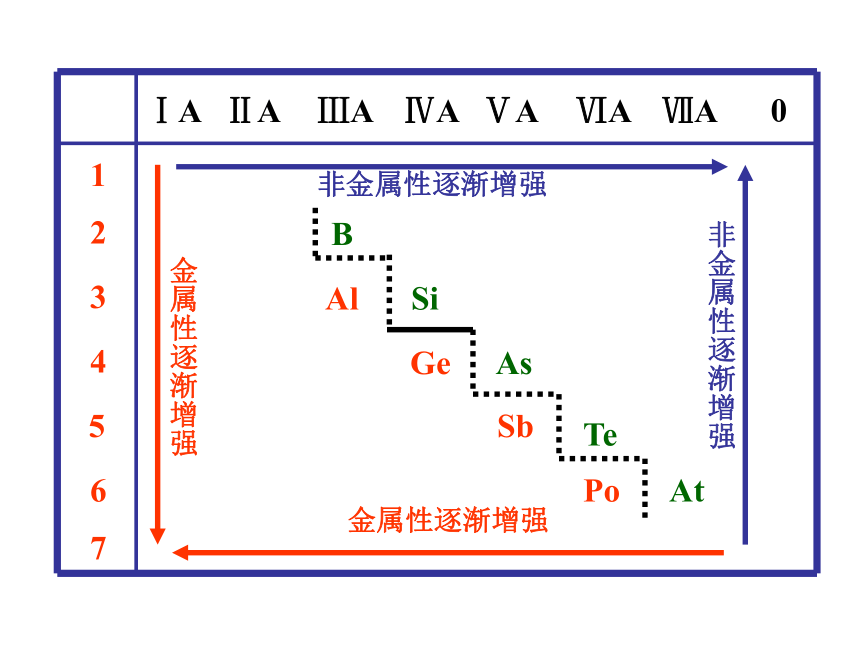
)—元素金属性 (非金属性 )越大越小越弱越强越强越弱越小越大越弱越强越弱越强元素的金属性和非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
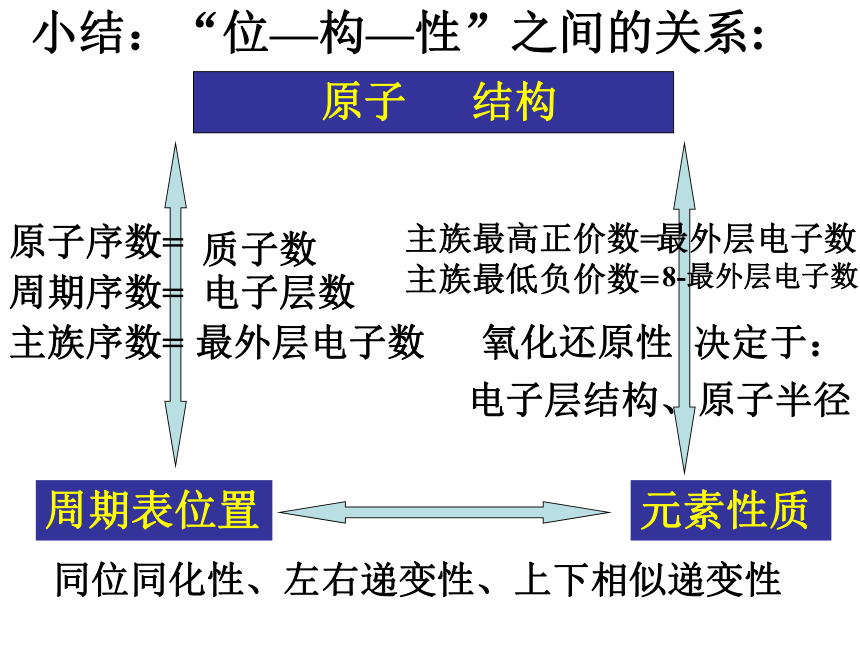
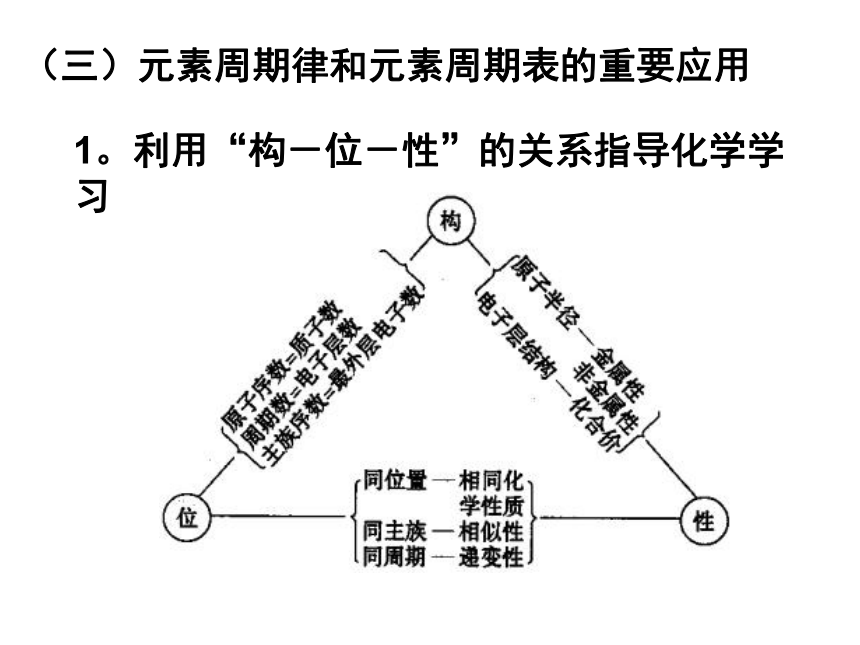
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs小结:“位—构—性”之间的关系: 原子 结构原子序数=质子数周期序数=电子层数主族序数=最外层电子数周期表位置主族最高正价数=最外层电子数氧化还原性 决定于:电子层结构、原子半径元素性质同位同化性、左右递变性、上下相似递变性主族最低负价数=8-最外层电子数(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例1]下列对于铯(Cs)的性质的预测中, 正确的是 ( )
A.它只有一种氧化物Cs2O B.它与水剧烈反应
C.Cs+具有很强的氧化性 D.CsHCO3受热不易分解例2、同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:
HAO4>H2BO4>H3CO4,则下列判断错误的是
A.原子半径A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C
D.阴离子半径C3—>B2—>A—A3.根据原子结构理论和元素周期律,请回答关于114号元素(此元素尚未命名,暂以X代替其化学符号)的几个问题。
(1) 原子核外有几个电子层?最外层电子数是多少?
(2) 它在周期表中位于第几周期?第几族?
(3)写出它的最高价氧化物的化学式。自我评价“惰性气体原子序数”定位法4、下列微粒的半径比大于1的是( )
A Na+/Na B Cl—/Cl
C N/C D K+/S2—
A5、下列单质中,最容易跟氢气发生反应的是 ( )
A.O2 B.N2 C.F2 D.Cl2C6.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是( )。
A.第9列元素中没有非金属元素
B.第1列和第17列元素的单质熔、沸点变化趋势相反
C.只有第2列元素原子的最外层有2个电子
D.在整个18列元素中,第3列元素种类最多C综合应用:下表是元素周期表的一部分,回答下列问题:(填序号)上述元素中,化学性质最不活泼的是___,只有负价无正价的非金属元素是___,原子半径最大的是____,还原性最强的单质是____,在最高价氧化物对应水化物中,碱性最强的是_____,酸性最强的是_____,呈两性的是______,在③和④中,化学性质较活泼的是_____,怎样用化学实验证明?在⑧和⑿中,化学性质较活泼的是_____,怎样用化学实验证明?⑨②⑩⑩③⑧⑤⑩⑧7、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D周期表及周期律的意义元素周期表是学习研究化学的重要工具
位——构——性2. 指导工农业生产
1)生产农药:在右上角寻找F,Cl,P等元素
2)生产催化剂,耐火材料:在过渡元素中寻找
3)生产半导体材料:在金属和非金属分界线处寻找半导体3. 它从自然科学方面有力地论证了事物变化中
量变到质变的规律性。
4.预言了未知元素,为发现新元素提供了线索
本课到此结束每天做点化学方面的练习,别停止,这样可以使你熟能生巧。
元素的金属性和非金属性强弱的判断依据
元素
金属性 元素单质与酸反应的难易 (易~强) 元素单质与水反应的难易 (易~强) 元素最高价氧化物的水化物(氢氧化物)
的碱性强弱 (强~强) 元素最高价氧化物的水化物 (含氧酸)
的酸性强弱 (强~强) 元素单质与氢气反应的难易 (易~强) 气态氢化物的稳定性 (稳定~强) 元素
非金属性1、电子层数越多—原子半径 —原
子核对电子的引力 —原子失去电子
的能力 (得电子能力 )—元
素金属性 (非金属性 )2、电子层数相同,核电荷数越大—原子
半径 —原子核对电子的引力 —
原子失去电子的能力 (得电子能力
)—元素金属性 (非金属性 )越大越小越弱越强越强越弱越小越大越弱越强越弱越强元素的金属性和非金属性 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs小结:“位—构—性”之间的关系: 原子 结构原子序数=质子数周期序数=电子层数主族序数=最外层电子数周期表位置主族最高正价数=最外层电子数氧化还原性 决定于:电子层结构、原子半径元素性质同位同化性、左右递变性、上下相似递变性主族最低负价数=8-最外层电子数(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例1]下列对于铯(Cs)的性质的预测中, 正确的是 ( )
A.它只有一种氧化物Cs2O B.它与水剧烈反应
C.Cs+具有很强的氧化性 D.CsHCO3受热不易分解例2、同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:
HAO4>H2BO4>H3CO4,则下列判断错误的是
A.原子半径A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C
D.阴离子半径C3—>B2—>A—A3.根据原子结构理论和元素周期律,请回答关于114号元素(此元素尚未命名,暂以X代替其化学符号)的几个问题。
(1) 原子核外有几个电子层?最外层电子数是多少?
(2) 它在周期表中位于第几周期?第几族?
(3)写出它的最高价氧化物的化学式。自我评价“惰性气体原子序数”定位法4、下列微粒的半径比大于1的是( )
A Na+/Na B Cl—/Cl
C N/C D K+/S2—
A5、下列单质中,最容易跟氢气发生反应的是 ( )
A.O2 B.N2 C.F2 D.Cl2C6.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是( )。
A.第9列元素中没有非金属元素
B.第1列和第17列元素的单质熔、沸点变化趋势相反
C.只有第2列元素原子的最外层有2个电子
D.在整个18列元素中,第3列元素种类最多C综合应用:下表是元素周期表的一部分,回答下列问题:(填序号)上述元素中,化学性质最不活泼的是___,只有负价无正价的非金属元素是___,原子半径最大的是____,还原性最强的单质是____,在最高价氧化物对应水化物中,碱性最强的是_____,酸性最强的是_____,呈两性的是______,在③和④中,化学性质较活泼的是_____,怎样用化学实验证明?在⑧和⑿中,化学性质较活泼的是_____,怎样用化学实验证明?⑨②⑩⑩③⑧⑤⑩⑧7、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D周期表及周期律的意义元素周期表是学习研究化学的重要工具
位——构——性2. 指导工农业生产
1)生产农药:在右上角寻找F,Cl,P等元素
2)生产催化剂,耐火材料:在过渡元素中寻找
3)生产半导体材料:在金属和非金属分界线处寻找半导体3. 它从自然科学方面有力地论证了事物变化中
量变到质变的规律性。
4.预言了未知元素,为发现新元素提供了线索
本课到此结束每天做点化学方面的练习,别停止,这样可以使你熟能生巧。
