专题一微观结构与物质的多样性复习 (浙江省温州市苍南县)
文档属性
| 名称 | 专题一微观结构与物质的多样性复习 (浙江省温州市苍南县) |  | |
| 格式 | rar | ||
| 文件大小 | 557.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-06-29 10:25:00 | ||
图片预览







文档简介
课件35张PPT。2007.4.25专题一微观结构与物质的多样性复习 一、原子结构及核外电子排布7.下列各组微粒中,核电荷数和核外电子总数都相等的一组是 ( )
A.K+和Na+ B.O2-和Na+
C.CO和CO2 D.N2和CO
12.X和Y都是短周期元素, X原子的最外层电子数是次外层电子数的2倍, Y在X的前一周期, 且最外层只有一个电子, 则X和Y形成的化合物的化学式可以表示为: A. XY B. XY4 C. XY3 D. X2Y3
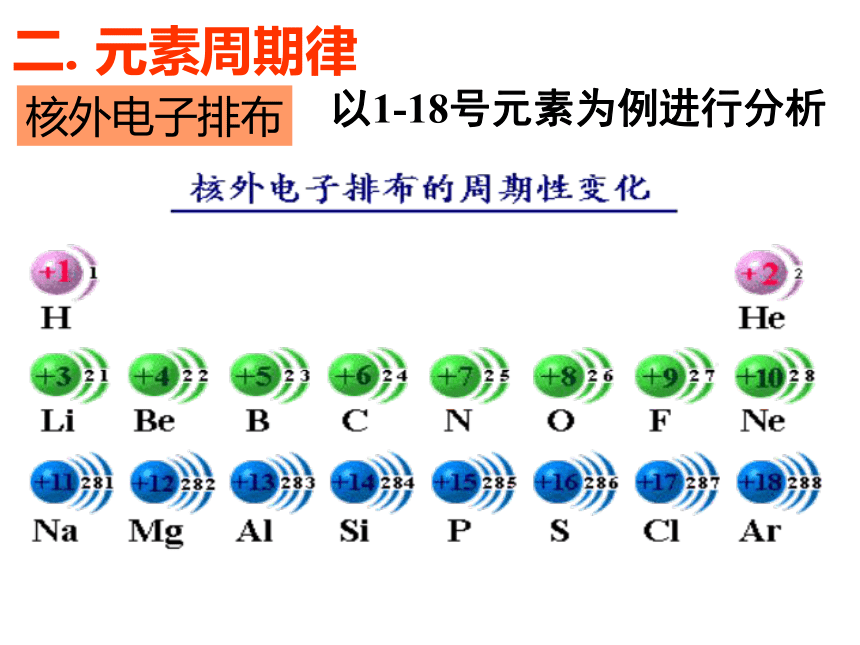
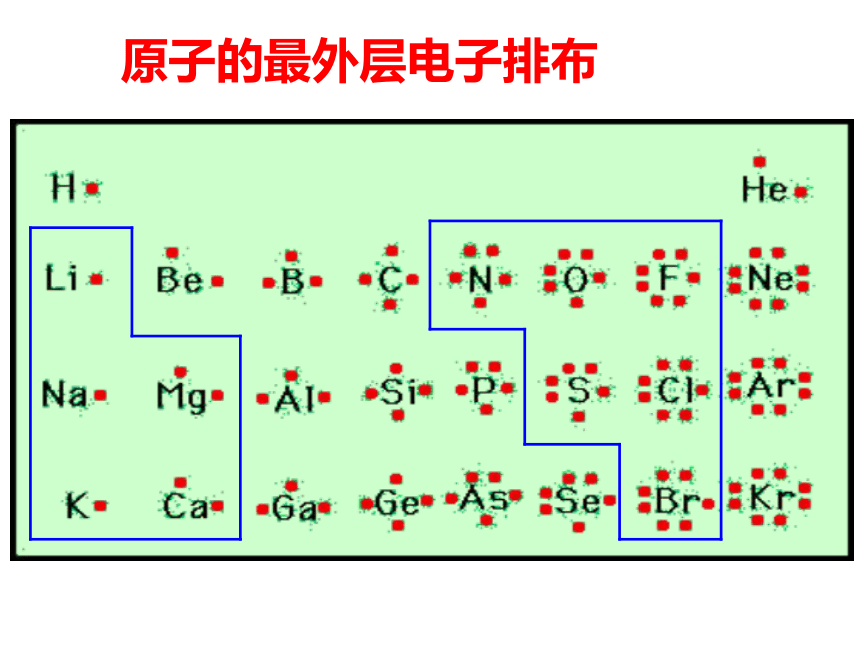
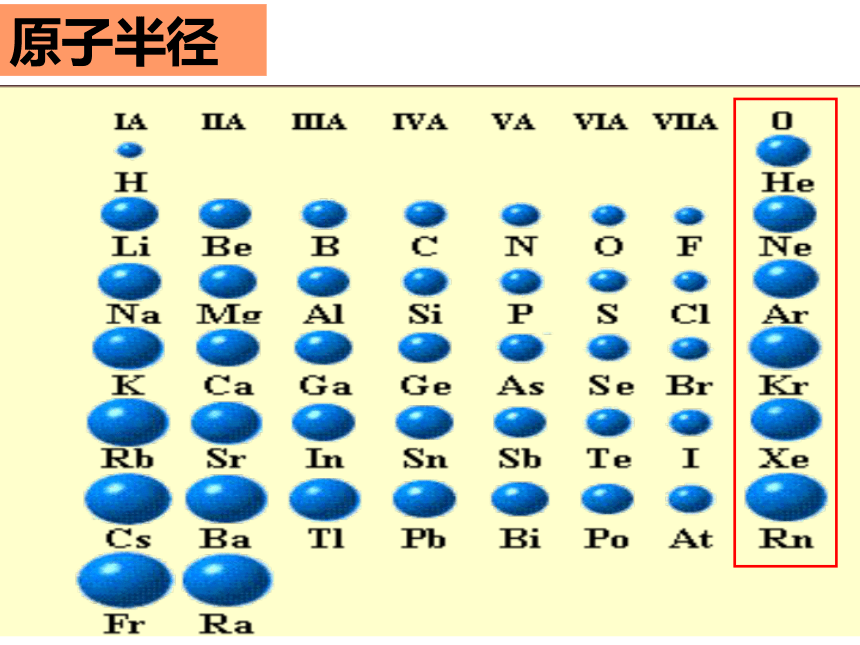
二、元素周期律 (1)定义:元素的____ 随着原子序数的____而呈现出_________的规律叫做元素周期律。性质周期性变化原子核外电子排布原子半径元素主要化合价元素的金属性和非金属性递增(3)实质:元素性质随着原子序数递增呈现出周期性变化,其本质原因是:_______________________________元素的原子核外电子排布呈现周期性变化核外电子排布以1-18号元素为例进行分析二. 元素周期律原子的最外层电子排布原子半径练习:③Fe__Fe2+ Fe3+; S S2-②Na+、N3-、 P3- 、 Mg2+、F- ①Na、N、P 、 Mg、F 比比半径吧影响微粒半径大小的因素:
1.电子层数:最外层电子数相同
电子层数越多,
微粒半径越大。
2.电子层数相同时:随着核电荷数增加,
粒子半径逐渐减小。3.同一元素的不同微粒:
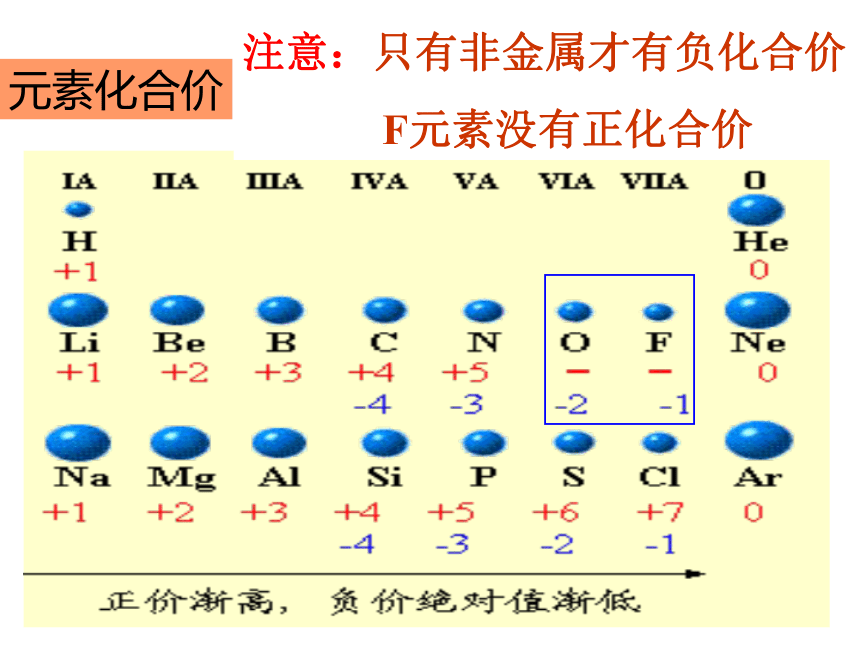
其核外电子数越多微粒半径越大 已知A2+、B+、C3-、D-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是_________离子半径由大到小的顺序是_______原子序数由大到小的顺序是_______单质的还原性____A>B>D>CB>A>C>DC>D>B>AB >A元素化合价注意:只有非金属才有负化合价
F元素没有正化合价1.以第IA为例讨论元素的金属性强弱的方法有哪些?
2.以第VIIA为例讨论元素的非属性强弱的方法有哪些?
回忆思考元素周期律元素性质随着元素原子序数的递增而呈周期性变化元素性质的周期性递变是核外电子排布周期性变化的必然结果归纳整理金属性与非金属性的强弱比较:1、金属性(1)单质与水(或酸)的反应的
剧烈程度(2)元素最高价氧化物对应水
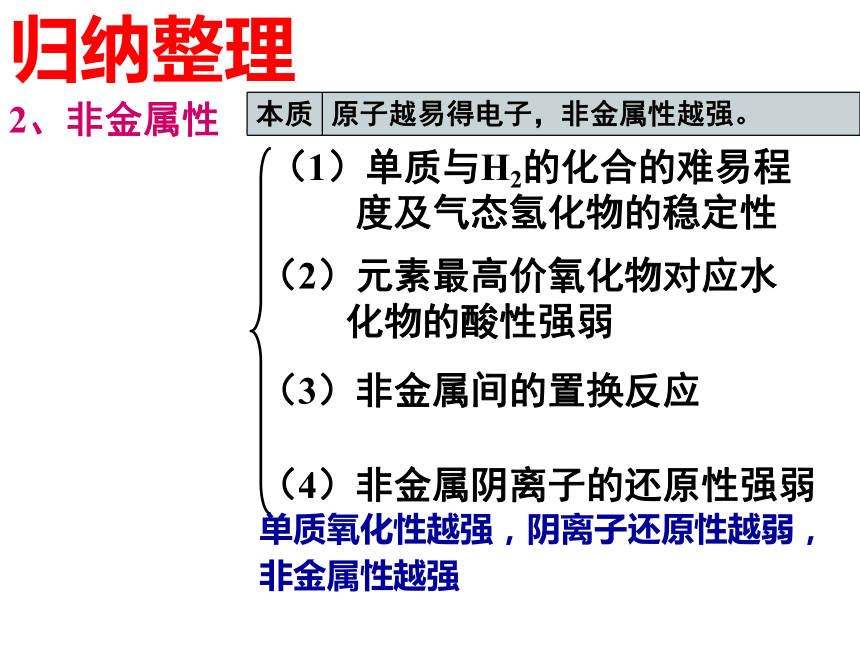
化物的碱性强弱(3)金属间的置换反应(4)金属活动性顺序表(5)金属阳离子的氧化性强弱 单质还原性越强,离子氧化性越弱,金属性越强 2、非金属性(1)单质与H2的化合的难易程
度及气态氢化物的稳定性(2)元素最高价氧化物对应水
化物的酸性强弱(3)非金属间的置换反应(4)非金属阴离子的还原性强弱 单质氧化性越强,阴离子还原性越弱,非金属性越强 归纳整理二、元素周期表 3个短周期 (1、2、3周期) 3个长周期 (4、5、6周期) 周期(7个) 族(16个) 周期表的结构 主族(7个) IA~VIIA
1个不完全周期(7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳:三短、三长、一不完全;(7横行)
七主、七副、一八、一零(18纵行) 请说出Na和Cl
在元素周期表中
的位置1、下列关于元素周期表的说法正确的是( )
A、共有7个横行,18个纵行,每一个纵行称为一族元素
B、最外层电子数相同的元素一定在同一族
C、某元素的最外电子层上只有三个电子,则该元素一定是金属元素
D、主族元素在周期表中的位置取决于该元素原子的电子层数和最外层电子数D回忆元素周期表的结构:要点七:元素性质在周期表中的递变逐渐↓逐渐↑ 最高正化合价=主族序数
最低负化合价=主族序数-8金属性逐渐↓
非金属性逐渐↑金属性逐渐↑
非金属性逐渐↓碱性逐渐↓
酸性逐渐↑碱性逐渐↑
酸性逐渐↓稳定性逐渐↑稳定性逐渐↓ 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强Be非金属区金属区基础题20.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4 H2YO4 、H3ZO4 ,则下列判断正确的是 ( )
A.含氧酸的酸性:H3ZO4 >H2YO4 >HXO4
B.非金属性:X> Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的原子半径按X、Y、Z顺序由小到大练习:我国最新报道的高温超导体,铊(Tl)是其成分之一,已知铊与铝是同族元素,原子序数为81,关于铊的性质的判断中,可能错误的是
A.是银白色金属
B.能生成+3价的化合物
C .Tl(OH)3与Al(OH)3一样具有两性
D.与稀硝酸作用生成硝酸盐熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测16.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素.下面关于它的原子结构和性质预测正确的是 ( )
A.类铅元素原子的最外层电子数为5 B.其常见价态为+2、+3、+4
C.它的金属性比铅强
D.它的原子半径比铅小熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测8. 8、若原子序数为 116 号元素, 其元素最外层电子数为 6, 则下列叙述正确的是:
A、X 可能是非金属元素
B、X的钠盐的化学式为:Na2X C. X的最高价氧化物的化学式为: XO3
D. X的最高价氧化物的水化物为强酸
1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强Be非金属区金属区三、从微粒间的相互作用,理解物质的多样性。微观粒子宏观晶体原子
离子
分子共价键
离子键
分子间作用力原子晶体
离子晶体
分子晶体相互作用力要点八:两常见类型的化学键离子键:直接相邻的阴,阳离子,结合时所形成的强烈的相互作用。
共价键:直接相邻的原子之间,通过共用电子对所形成的强烈的相互作用离子键的形成条件:①活泼金属元素原子与活泼非金属元素原子,化合形成离子键。②某些非金属元素之间也能形成离子键,如NH4Cl等①非金属元素之间形成共价键,如HCl,H2等共价键的形成条件:②非金属元素与某些金属元素之间形成共价键,如AlCl3,BeCl2等。③含有原子团的离子化合物存在着共价键,如NH4Cl,NaOH等含有离子键的化合物一定是离子化合物;
含有共价键的化合物不一定是共价化合物。电子式:11. 下列电子式或结构式错误的是
要点九:分子间作用力(范德华力)
离子间或原子间分子间较强较弱化学性质
物理性质
分子间作用力与化学键的区别:氢键是一种比较强的分子间作用力,存在于H2O,NH3,HF等物质中。分子间作用力越大,物质的熔沸点越高。29现有①BaCl2 ②金刚石 ③NH4Cl ④NaOH ⑤干冰
⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,
熔化时需要破坏共价键的是________,
熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,
晶体以分子间作用力结合的是________。
(3)只有离子键的物质是________,
既有离子键又有共价键的是 。
⑤ ⑥②②⑤① ③ ④⑤ ⑥①③ ④三、从微粒间的相互作用,理解物质的多样性。1、除了晶体类型的多样性,还有哪些因素造成物质的多样性?2、对比同位素、同素异形体、同分异构体三概念:要点十:同位素、同素异形现象和同分异构现象同素异形体:同种元素形成的不同单质。注意:①互为同素异形体的物质必须是单质。②不同单质是指单质的组成元素相同,而结构不同。例如:同位素:质子数相同,中子数不同的原子,互称为同位素。同分异构体:分子式相同,但结构不同的化合物。例如:注意:互为同分异构体的物质,必须是化合物碳元素的同素异形体的结构特点:金刚石:空间网状结构石墨:片层结构碳60:足球状
26.下列各组物质(填序号) ① O2和O3 ② H2、D2、T2 ③ 12C和14C ④ CH3CH2CH2CH3和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥ CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5 ⑦正丁烷和异丁烷 ⑧金刚石和石墨 ⑨冰与水 ⑩乙醇与二甲醚
互为同分异构体的是_ _______ , 互为同位素的是_ ___ __,
互为同素异形体的是____ _ __,同种物质的是_____ _______④ ⑦ ⑩③① ⑧⑥ ⑨分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体分子晶体离子晶体例4.根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式 ___________。
(2)Be(OH)2与Mg(OH)2可用试剂鉴别,其离子方程式为 ___________________。
(3)BeCl2是 化合物(填写“离子”或“共价”)。Be(OH)2 + 2OH- = BeO22- + 2H2OBe + 2OH-= BeO22- + H2↑共价三、元素周期律和元素周期表讨论:
1、为什么要设计出元素周期表?
2、周期表是如何体现出元素周期律?
3、请概括周期表中位、构、性三者关系?
A.K+和Na+ B.O2-和Na+
C.CO和CO2 D.N2和CO
12.X和Y都是短周期元素, X原子的最外层电子数是次外层电子数的2倍, Y在X的前一周期, 且最外层只有一个电子, 则X和Y形成的化合物的化学式可以表示为: A. XY B. XY4 C. XY3 D. X2Y3
二、元素周期律 (1)定义:元素的____ 随着原子序数的____而呈现出_________的规律叫做元素周期律。性质周期性变化原子核外电子排布原子半径元素主要化合价元素的金属性和非金属性递增(3)实质:元素性质随着原子序数递增呈现出周期性变化,其本质原因是:_______________________________元素的原子核外电子排布呈现周期性变化核外电子排布以1-18号元素为例进行分析二. 元素周期律原子的最外层电子排布原子半径练习:③Fe__Fe2+ Fe3+; S S2-②Na+、N3-、 P3- 、 Mg2+、F- ①Na、N、P 、 Mg、F 比比半径吧影响微粒半径大小的因素:
1.电子层数:最外层电子数相同
电子层数越多,
微粒半径越大。
2.电子层数相同时:随着核电荷数增加,
粒子半径逐渐减小。3.同一元素的不同微粒:
其核外电子数越多微粒半径越大 已知A2+、B+、C3-、D-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是_________离子半径由大到小的顺序是_______原子序数由大到小的顺序是_______单质的还原性____A>B>D>CB>A>C>DC>D>B>AB >A元素化合价注意:只有非金属才有负化合价
F元素没有正化合价1.以第IA为例讨论元素的金属性强弱的方法有哪些?
2.以第VIIA为例讨论元素的非属性强弱的方法有哪些?
回忆思考元素周期律元素性质随着元素原子序数的递增而呈周期性变化元素性质的周期性递变是核外电子排布周期性变化的必然结果归纳整理金属性与非金属性的强弱比较:1、金属性(1)单质与水(或酸)的反应的
剧烈程度(2)元素最高价氧化物对应水
化物的碱性强弱(3)金属间的置换反应(4)金属活动性顺序表(5)金属阳离子的氧化性强弱 单质还原性越强,离子氧化性越弱,金属性越强 2、非金属性(1)单质与H2的化合的难易程
度及气态氢化物的稳定性(2)元素最高价氧化物对应水
化物的酸性强弱(3)非金属间的置换反应(4)非金属阴离子的还原性强弱 单质氧化性越强,阴离子还原性越弱,非金属性越强 归纳整理二、元素周期表 3个短周期 (1、2、3周期) 3个长周期 (4、5、6周期) 周期(7个) 族(16个) 周期表的结构 主族(7个) IA~VIIA
1个不完全周期(7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳:三短、三长、一不完全;(7横行)
七主、七副、一八、一零(18纵行) 请说出Na和Cl
在元素周期表中
的位置1、下列关于元素周期表的说法正确的是( )
A、共有7个横行,18个纵行,每一个纵行称为一族元素
B、最外层电子数相同的元素一定在同一族
C、某元素的最外电子层上只有三个电子,则该元素一定是金属元素
D、主族元素在周期表中的位置取决于该元素原子的电子层数和最外层电子数D回忆元素周期表的结构:要点七:元素性质在周期表中的递变逐渐↓逐渐↑ 最高正化合价=主族序数
最低负化合价=主族序数-8金属性逐渐↓
非金属性逐渐↑金属性逐渐↑
非金属性逐渐↓碱性逐渐↓
酸性逐渐↑碱性逐渐↑
酸性逐渐↓稳定性逐渐↑稳定性逐渐↓ 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强Be非金属区金属区基础题20.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4 H2YO4 、H3ZO4 ,则下列判断正确的是 ( )
A.含氧酸的酸性:H3ZO4 >H2YO4 >HXO4
B.非金属性:X> Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的原子半径按X、Y、Z顺序由小到大练习:我国最新报道的高温超导体,铊(Tl)是其成分之一,已知铊与铝是同族元素,原子序数为81,关于铊的性质的判断中,可能错误的是
A.是银白色金属
B.能生成+3价的化合物
C .Tl(OH)3与Al(OH)3一样具有两性
D.与稀硝酸作用生成硝酸盐熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测16.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素.下面关于它的原子结构和性质预测正确的是 ( )
A.类铅元素原子的最外层电子数为5 B.其常见价态为+2、+3、+4
C.它的金属性比铅强
D.它的原子半径比铅小熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测熟练应用位、构、性三者关系解题:
对未知物质的结构与性质进行预测8. 8、若原子序数为 116 号元素, 其元素最外层电子数为 6, 则下列叙述正确的是:
A、X 可能是非金属元素
B、X的钠盐的化学式为:Na2X C. X的最高价氧化物的化学式为: XO3
D. X的最高价氧化物的水化物为强酸
1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强Be非金属区金属区三、从微粒间的相互作用,理解物质的多样性。微观粒子宏观晶体原子
离子
分子共价键
离子键
分子间作用力原子晶体
离子晶体
分子晶体相互作用力要点八:两常见类型的化学键离子键:直接相邻的阴,阳离子,结合时所形成的强烈的相互作用。
共价键:直接相邻的原子之间,通过共用电子对所形成的强烈的相互作用离子键的形成条件:①活泼金属元素原子与活泼非金属元素原子,化合形成离子键。②某些非金属元素之间也能形成离子键,如NH4Cl等①非金属元素之间形成共价键,如HCl,H2等共价键的形成条件:②非金属元素与某些金属元素之间形成共价键,如AlCl3,BeCl2等。③含有原子团的离子化合物存在着共价键,如NH4Cl,NaOH等含有离子键的化合物一定是离子化合物;
含有共价键的化合物不一定是共价化合物。电子式:11. 下列电子式或结构式错误的是
要点九:分子间作用力(范德华力)
离子间或原子间分子间较强较弱化学性质
物理性质
分子间作用力与化学键的区别:氢键是一种比较强的分子间作用力,存在于H2O,NH3,HF等物质中。分子间作用力越大,物质的熔沸点越高。29现有①BaCl2 ②金刚石 ③NH4Cl ④NaOH ⑤干冰
⑥碘片六种物质,按下列要求回答:
(1)熔化时不需要破坏化学键的是________,
熔化时需要破坏共价键的是________,
熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,
晶体以分子间作用力结合的是________。
(3)只有离子键的物质是________,
既有离子键又有共价键的是 。
⑤ ⑥②②⑤① ③ ④⑤ ⑥①③ ④三、从微粒间的相互作用,理解物质的多样性。1、除了晶体类型的多样性,还有哪些因素造成物质的多样性?2、对比同位素、同素异形体、同分异构体三概念:要点十:同位素、同素异形现象和同分异构现象同素异形体:同种元素形成的不同单质。注意:①互为同素异形体的物质必须是单质。②不同单质是指单质的组成元素相同,而结构不同。例如:同位素:质子数相同,中子数不同的原子,互称为同位素。同分异构体:分子式相同,但结构不同的化合物。例如:注意:互为同分异构体的物质,必须是化合物碳元素的同素异形体的结构特点:金刚石:空间网状结构石墨:片层结构碳60:足球状
26.下列各组物质(填序号) ① O2和O3 ② H2、D2、T2 ③ 12C和14C ④ CH3CH2CH2CH3和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥ CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5 ⑦正丁烷和异丁烷 ⑧金刚石和石墨 ⑨冰与水 ⑩乙醇与二甲醚
互为同分异构体的是_ _______ , 互为同位素的是_ ___ __,
互为同素异形体的是____ _ __,同种物质的是_____ _______④ ⑦ ⑩③① ⑧⑥ ⑨分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________原子晶体分子晶体分子晶体离子晶体例4.根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式 ___________。
(2)Be(OH)2与Mg(OH)2可用试剂鉴别,其离子方程式为 ___________________。
(3)BeCl2是 化合物(填写“离子”或“共价”)。Be(OH)2 + 2OH- = BeO22- + 2H2OBe + 2OH-= BeO22- + H2↑共价三、元素周期律和元素周期表讨论:
1、为什么要设计出元素周期表?
2、周期表是如何体现出元素周期律?
3、请概括周期表中位、构、性三者关系?
