电能转化为化学能 必修II(浙江省温州市苍南县)
文档属性
| 名称 | 电能转化为化学能 必修II(浙江省温州市苍南县) |  | |
| 格式 | rar | ||
| 文件大小 | 164.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-08-12 19:46:00 | ||
图片预览




文档简介
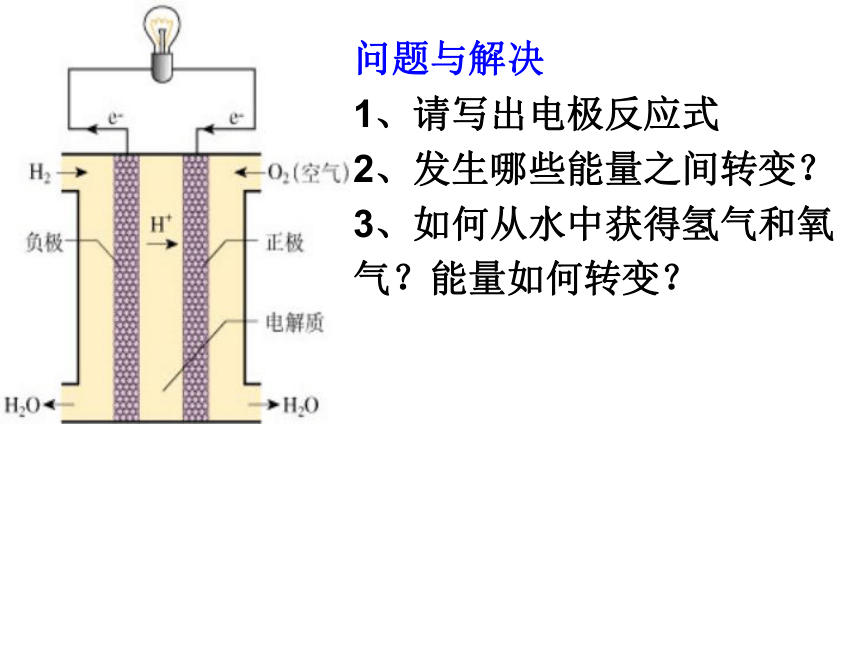
课件20张PPT。第三节电能转化为化学能问题与解决
1、请写出电极反应式
2、发生哪些能量之间转变?
3、如何从水中获得氢气和氧
气?能量如何转变?
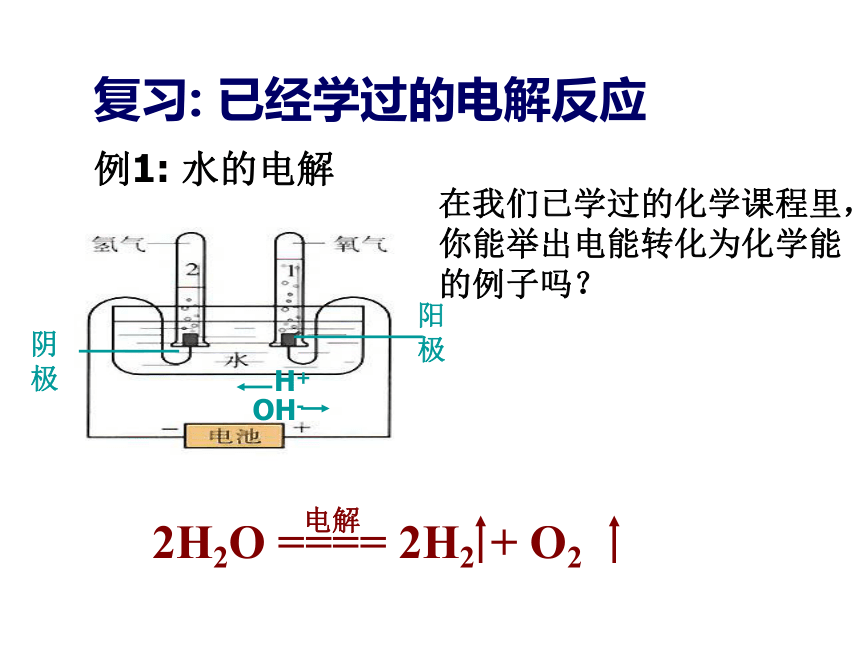
例1: 水的电解阳极阴极复习: 已经学过的电解反应电解H+OH-在我们已学过的化学课程里,你能举出电能转化为化学能的例子吗?其他的电解反应
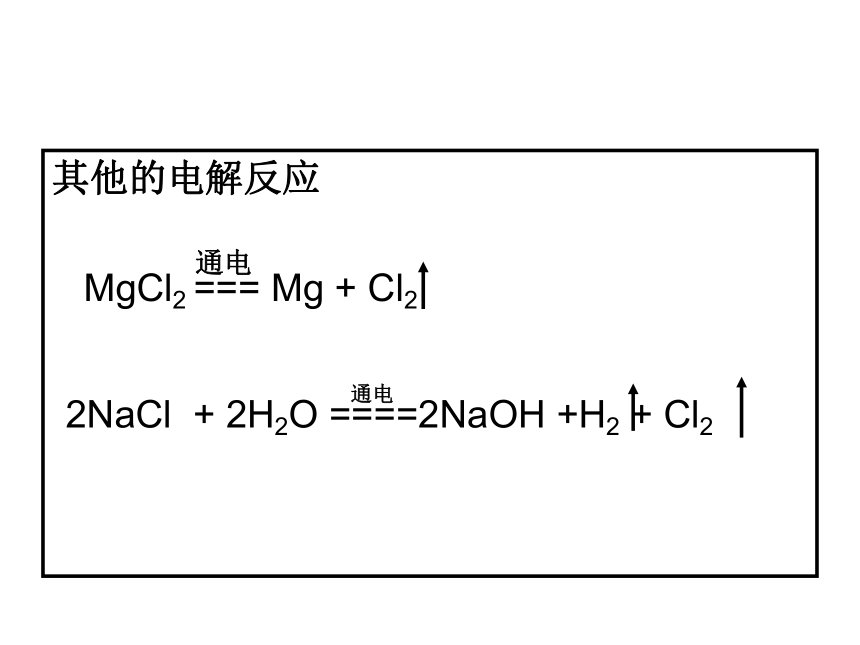
MgCl2 === Mg + Cl2
2NaCl + 2H2O ====2NaOH +H2 + Cl2
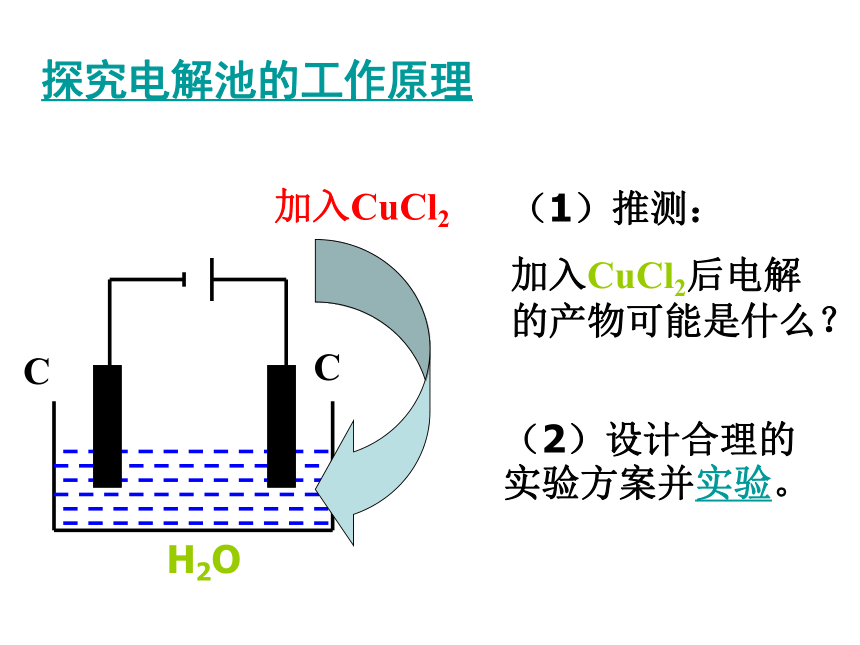
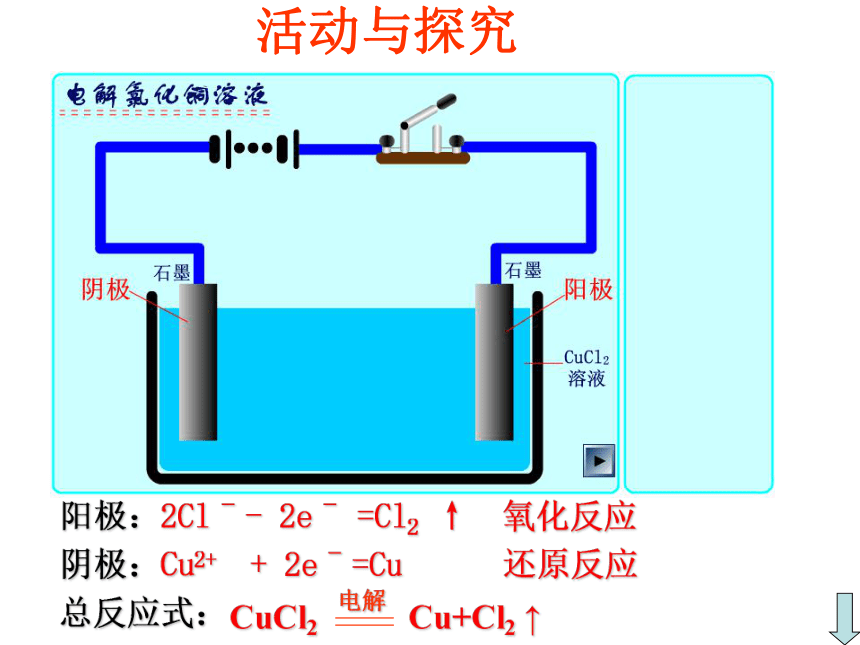
通电通电探究电解池的工作原理加入CuCl2(1)推测:
加入CuCl2后电解的产物可能是什么?(2)设计合理的实验方案并实验。H2O实验现象及分析现象:①与电源正极相接碳棒上,产生刺激
性气体,并使湿润的淀粉—KI试纸变
蓝色的气体
②与电源负极相接碳棒上,覆盖了亮
红色的物质
Cl2铜分析:活动与探究阳极:2Clˉ- 2eˉ =Cl2 ↑ 氧化反应
阴极:Cu2+ + 2eˉ=Cu 还原反应
总反应式:一、电解1、定义
电解:在外加直流电源的作用下,电解质的
阴阳离子在阴阳两极发生氧化还原反
应的过程。电解池:借助氧化还原反应,将电能转化为化学能的装置
阴离子向阳极迁移
阳离子向阴极迁移①形成完整的闭合回路
②与直流电源相连两个电极
③电解质溶液或熔融电解质电能转化为化学能阳极(接电源正极)阴极(接电源负极)负极→阴极→阳极→正极交流与讨论电解CuCl2溶液时,溶液中有Cu2+、H+、Cl-、OH-,为什么只有Cu2+、Cl-得失电子,而H+、OH-却不能在两极上发生变化呢?氧化性(得电子能力):Cu2+ > H+结论:电解时,氧化性强的离子先被还原,
还原性强的离子(或金属)先被氧化还原性(失电子能力):Cl - > OH-阴离子 和金属的失电子能力:阳离子 :与金属活动顺序相反。即:K +、Ca2+ 、Na + 、Mg2+ 、Al3+ 、 Zn2+ 、 Fe2+
Sn2+ 、Pb2+ (H+) Cu2+ 、Fe3+ 、 Hg2+ 、 Ag+. 得e能力(即氧化性)依次增强除Au 、Pt外的金属还原性﹥阴离子。失e 能力(即还原性)依次减弱 你能写出电解NaCl溶液过程中的所有反应方程式吗?牛刀小试2NaCl+2H2O2Cl-- 2e- = Cl 22H ++ 2e- = H2 阳极:阴极:总反应式:问题与解决在P40“活动与探究”中,我们发现,当接通
电源后,在与电源负极相接的电极上产生氢
气,与电源正极连接的电极上产生氧气
问题1:为什么会生成氢气和氧气?
问题2:请写出电极反应式
问题3:为什么Na+和SO42-不参加反应?
问题4:请总结判断电解产物的步骤与方法-分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子注意:氧化性强的离子先被还原,还原性强的离子(或金属)先被氧化阳极: (1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极(石墨、金和铂):溶液中阴离子失去电子阴离子向阳极迁移
阳离子向阴极迁移阴离子向负极迁移
阳离子向正极迁移负极正极①形成完整的闭合回路
②两个活性不同的电极
③电解质溶液
或熔融电解质①形成完整的闭合回路
②与直流电源相连两个电极
③电解质溶液
或熔融电解质电能转化为化学能化学能转化为电能负极→阴极→阳极→正极负极→外电路→正极阳极(接电源正极)阴极(接电源负极)电解CuCl2溶液如果改用用金属锌或铜做电极,情况会如何?交流与讨论阅读:P43—“拓展视野”3.铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液电解原理的应用2、活泼金属的冶炼
(1)钠的制取
(2)镁的制取
(3)铝的制取总反应式 : 2NaCl 2Na+Cl2↑总反应式 : MgCl2 Mg+Cl2↑总反应式 : 2Al2O3 2Al+3O2↑1、氯碱工业——电解饱和食盐水
电解原理的应用与电源正极相连阳极阴极与电源负极相连发生氧化反应阳离子移向阴离子移向发生还原反应电源、电极、电极反应关系小结:作业1、完成学习与评价
1、请写出电极反应式
2、发生哪些能量之间转变?
3、如何从水中获得氢气和氧
气?能量如何转变?
例1: 水的电解阳极阴极复习: 已经学过的电解反应电解H+OH-在我们已学过的化学课程里,你能举出电能转化为化学能的例子吗?其他的电解反应
MgCl2 === Mg + Cl2
2NaCl + 2H2O ====2NaOH +H2 + Cl2
通电通电探究电解池的工作原理加入CuCl2(1)推测:
加入CuCl2后电解的产物可能是什么?(2)设计合理的实验方案并实验。H2O实验现象及分析现象:①与电源正极相接碳棒上,产生刺激
性气体,并使湿润的淀粉—KI试纸变
蓝色的气体
②与电源负极相接碳棒上,覆盖了亮
红色的物质
Cl2铜分析:活动与探究阳极:2Clˉ- 2eˉ =Cl2 ↑ 氧化反应
阴极:Cu2+ + 2eˉ=Cu 还原反应
总反应式:一、电解1、定义
电解:在外加直流电源的作用下,电解质的
阴阳离子在阴阳两极发生氧化还原反
应的过程。电解池:借助氧化还原反应,将电能转化为化学能的装置
阴离子向阳极迁移
阳离子向阴极迁移①形成完整的闭合回路
②与直流电源相连两个电极
③电解质溶液或熔融电解质电能转化为化学能阳极(接电源正极)阴极(接电源负极)负极→阴极→阳极→正极交流与讨论电解CuCl2溶液时,溶液中有Cu2+、H+、Cl-、OH-,为什么只有Cu2+、Cl-得失电子,而H+、OH-却不能在两极上发生变化呢?氧化性(得电子能力):Cu2+ > H+结论:电解时,氧化性强的离子先被还原,
还原性强的离子(或金属)先被氧化还原性(失电子能力):Cl - > OH-阴离子 和金属的失电子能力:阳离子 :与金属活动顺序相反。即:K +、Ca2+ 、Na + 、Mg2+ 、Al3+ 、 Zn2+ 、 Fe2+
Sn2+ 、Pb2+ (H+) Cu2+ 、Fe3+ 、 Hg2+ 、 Ag+. 得e能力(即氧化性)依次增强除Au 、Pt外的金属还原性﹥阴离子。失e 能力(即还原性)依次减弱 你能写出电解NaCl溶液过程中的所有反应方程式吗?牛刀小试2NaCl+2H2O2Cl-- 2e- = Cl 22H ++ 2e- = H2 阳极:阴极:总反应式:问题与解决在P40“活动与探究”中,我们发现,当接通
电源后,在与电源负极相接的电极上产生氢
气,与电源正极连接的电极上产生氧气
问题1:为什么会生成氢气和氧气?
问题2:请写出电极反应式
问题3:为什么Na+和SO42-不参加反应?
问题4:请总结判断电解产物的步骤与方法-分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子注意:氧化性强的离子先被还原,还原性强的离子(或金属)先被氧化阳极: (1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极(石墨、金和铂):溶液中阴离子失去电子阴离子向阳极迁移
阳离子向阴极迁移阴离子向负极迁移
阳离子向正极迁移负极正极①形成完整的闭合回路
②两个活性不同的电极
③电解质溶液
或熔融电解质①形成完整的闭合回路
②与直流电源相连两个电极
③电解质溶液
或熔融电解质电能转化为化学能化学能转化为电能负极→阴极→阳极→正极负极→外电路→正极阳极(接电源正极)阴极(接电源负极)电解CuCl2溶液如果改用用金属锌或铜做电极,情况会如何?交流与讨论阅读:P43—“拓展视野”3.铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液电解原理的应用2、活泼金属的冶炼
(1)钠的制取
(2)镁的制取
(3)铝的制取总反应式 : 2NaCl 2Na+Cl2↑总反应式 : MgCl2 Mg+Cl2↑总反应式 : 2Al2O3 2Al+3O2↑1、氯碱工业——电解饱和食盐水
电解原理的应用与电源正极相连阳极阴极与电源负极相连发生氧化反应阳离子移向阴离子移向发生还原反应电源、电极、电极反应关系小结:作业1、完成学习与评价
