必修I 常见物质的检验
图片预览








文档简介
课件20张PPT。请同学们:规范操作、注意安全1、注意本桌、邻桌的易打玻璃仪器
2、不要用手接触药品,也不要随意丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且试管口不能对着人。常 见 物 质 的 检 验常见试纸:PH试纸:红石蕊试纸:即广范试纸。检验液体时不能先湿润(定量时)石蕊试纸遇碱性物质变蓝色蓝石蕊试纸:遇酸性物质变红淀粉试纸醋酸铅试纸(检验气体需先湿润)碘淀粉蓝实验1:NH4Cl和(NH4)2SO4各2mL,分别2mLNaOH,稍加热,将先准备好的湿润的试纸靠近试管口实验步骤:实验现象:闻气味及观试纸颜色的变化
实验2:实验步骤:NH4Cl和KCl各少量(1~2)mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3实验现象:观察液体变化实验3:实验步骤:(NH4)2SO4和K2SO4各少量,各滴几滴稀HCl ,再各滴几滴BaCl2实验现象:观察液体变化
实验现象:实验药品:实验结论:有刺激性气味气体产生,且该气体能使湿润的红石蕊试纸变蓝NH4Cl和(NH4)2SO4中含有NH4+
实验1.NH4Cl、 (NH4)2SO4 、NaOH 取样(少量放在试管中)与碱混合加热,若有刺激性气味的气体产生,且该气使湿润的红色石蕊试纸变蓝,证明该试样中含有NH4+。
NH4+的检验(铵盐)
方法:实验原理:
蓝实验2实验药品:NH4Cl、KCl、稀HNO3和Ag NO 3
实验现象:实验结论:问题稀硝酸的作用是什么?排除CO32-和SO32-的干扰反应生成不溶于稀硝酸的白色沉淀NH4Cl和KCl 中含有 Cl-先加稀HNO3即先除杂取样并向内加稀HNO3和AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。
Cl-的检验(盐酸盐或称氯化物)
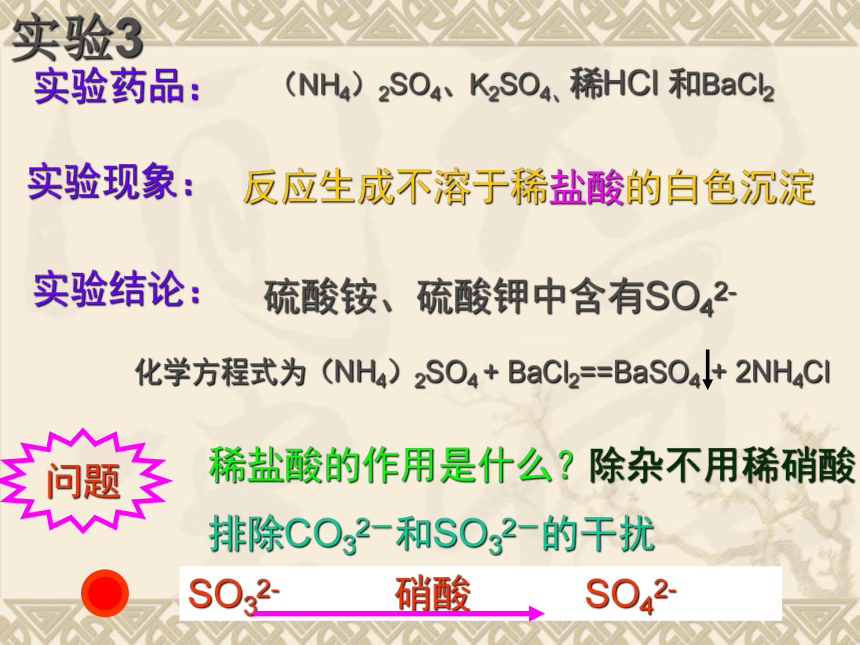
方法:实验原理?实验3实验药品:(NH4)2SO4、K2SO4、稀HCl 和BaCl2实验现象:反应生成不溶于稀盐酸的白色沉淀实验结论:硫酸铵、硫酸钾中含有SO42-问题稀盐酸的作用是什么?排除CO32-和SO32-的干扰除杂不用稀硝酸取样并向内加稀HCl、BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42- 。SO42-的检验(硫酸盐)
方法:● 不能用稀硝酸,也不能用Ba(NO3)2思考:某白色晶体可能是硫酸铵,怎样证明?
4.焰色反应实验方法: 根据焰色反应所呈现的特征焰色,可检验金属或金属离子的存在 取一根铂丝,放在酒精灯的火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,放入火焰中灼烧,就会观察到不同颜色的火焰记Na 为黄色 K为紫色除杂P20表1-5 一些物质的检验用红外光谱仪来确定:物质中是否含有某些有机基团用元素分析仪测定:物质中是否含C、H、O、N、S等元素5. 仪器分析法:课本P21用原子吸收光谱确定:物质中是否含有哪些金属元素1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸2、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 练习BA3、某溶液中含有大量的Cl-、SO42-、OH-三种离子,
如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④或 ③②①②④
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-4、对下列实验过程的评价,正确的是√作业:课本 P25 2 、31、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-+42-32-4C课堂训练
2、不要用手接触药品,也不要随意丢弃,更不能拿出实验室
3、酒精灯只能用火柴点燃,用灯帽盖灭,不能拿、移燃着的酒精灯
4、对液体加热时,先均匀加热,且试管口不能对着人。常 见 物 质 的 检 验常见试纸:PH试纸:红石蕊试纸:即广范试纸。检验液体时不能先湿润(定量时)石蕊试纸遇碱性物质变蓝色蓝石蕊试纸:遇酸性物质变红淀粉试纸醋酸铅试纸(检验气体需先湿润)碘淀粉蓝实验1:NH4Cl和(NH4)2SO4各2mL,分别2mLNaOH,稍加热,将先准备好的湿润的试纸靠近试管口实验步骤:实验现象:闻气味及观试纸颜色的变化
实验2:实验步骤:NH4Cl和KCl各少量(1~2)mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3实验现象:观察液体变化实验3:实验步骤:(NH4)2SO4和K2SO4各少量,各滴几滴稀HCl ,再各滴几滴BaCl2实验现象:观察液体变化
实验现象:实验药品:实验结论:有刺激性气味气体产生,且该气体能使湿润的红石蕊试纸变蓝NH4Cl和(NH4)2SO4中含有NH4+
实验1.NH4Cl、 (NH4)2SO4 、NaOH 取样(少量放在试管中)与碱混合加热,若有刺激性气味的气体产生,且该气使湿润的红色石蕊试纸变蓝,证明该试样中含有NH4+。
NH4+的检验(铵盐)
方法:实验原理:
蓝实验2实验药品:NH4Cl、KCl、稀HNO3和Ag NO 3
实验现象:实验结论:问题稀硝酸的作用是什么?排除CO32-和SO32-的干扰反应生成不溶于稀硝酸的白色沉淀NH4Cl和KCl 中含有 Cl-先加稀HNO3即先除杂取样并向内加稀HNO3和AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。
Cl-的检验(盐酸盐或称氯化物)
方法:实验原理?实验3实验药品:(NH4)2SO4、K2SO4、稀HCl 和BaCl2实验现象:反应生成不溶于稀盐酸的白色沉淀实验结论:硫酸铵、硫酸钾中含有SO42-问题稀盐酸的作用是什么?排除CO32-和SO32-的干扰除杂不用稀硝酸取样并向内加稀HCl、BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42- 。SO42-的检验(硫酸盐)
方法:● 不能用稀硝酸,也不能用Ba(NO3)2思考:某白色晶体可能是硫酸铵,怎样证明?
4.焰色反应实验方法: 根据焰色反应所呈现的特征焰色,可检验金属或金属离子的存在 取一根铂丝,放在酒精灯的火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,放入火焰中灼烧,就会观察到不同颜色的火焰记Na 为黄色 K为紫色除杂P20表1-5 一些物质的检验用红外光谱仪来确定:物质中是否含有某些有机基团用元素分析仪测定:物质中是否含C、H、O、N、S等元素5. 仪器分析法:课本P21用原子吸收光谱确定:物质中是否含有哪些金属元素1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸2、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH? ????????? B.Na2CO3
C.AgNO3? ???????? D.BaCl2 练习BA3、某溶液中含有大量的Cl-、SO42-、OH-三种离子,
如果只取一次就能够将3种阴离子依次检验出来,
下列实验操作顺序正确的是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④或 ③②①②④
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-4、对下列实验过程的评价,正确的是√作业:课本 P25 2 、31、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-+42-32-4C课堂训练
