离子共存(云南省昆明市五华区)
图片预览











文档简介
课件31张PPT。高考热点复习--离子共存专题1、(06,四川)室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )。
A、NH4+、Cu2+、Cl-、NO3-
B、K+、Na+、SO32-、S2-
C、 K+、Na+、SO42-、AlO2-
D、 Ba2+、Fe2+、NO3-、Br-D2、(06,江苏)一定能在下列溶液中大量共存的离子组是( )。
A、含有大量Al3+的溶液:
Na+、NH4+、SO42-、Cl-
B、C(H+)=1×10-13mol/L的溶液:
Na+、Ca2+、SO42-、CO32-
C、含有大量Fe3+的溶液:
Na+、Mg2+、NO3-、SCN-
D、含有大量NO3-的溶液:
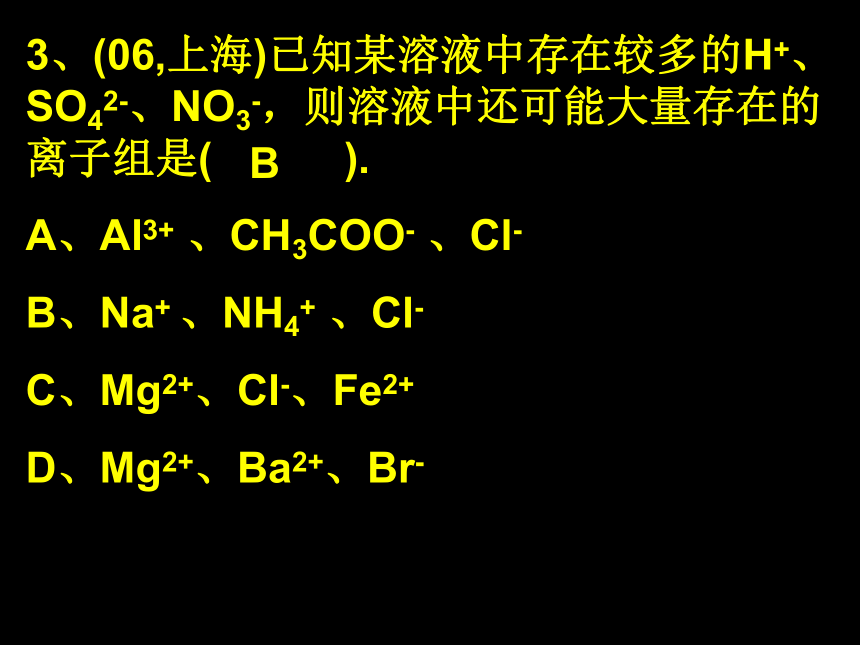
H+、Fe2+、SO42-、Cl-A3、(06,上海)已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( ).
A、Al3+ 、CH3COO- 、Cl-
B、Na+ 、NH4+ 、Cl-
C、Mg2+、Cl-、Fe2+
D、Mg2+、Ba2+、Br-B原则:
能反应就不共存,能共存就不反应。1、先弄清楚外加条件的暗示(1)分清是“能大量共存”还是“不能大量共存”。(2)“无色透明的溶液”中不能含有:Cu2+ Fe2+ Fe3+ MnO4-(3)“在强酸性(或pH=1)溶液中”,应考虑H+的影响。(4)“在强碱性(或pH=14)溶液中”,应考虑OH-的影响。(5)“在由水电离出的C(H+)=10-10mol/L【或C(OH-)=10-10mol/L】的溶液中能大量共存的” ,即在酸性和碱性条件下均能大量共存的离子组。(6)“在与 Al反应产生H2的溶液 中”,即含大量H+或OH-。应加上对H+或OH-的分析,并弄清是“肯定还是可能大量共存”。(7)“因氧化还原反应……”,即只考虑离子间的氧化还原反应。2、生成沉淀而不能大量共存
判断原则:溶解性表中不溶或微溶的物质的阴、阳离子,不能大量共存。
如:Ag+和Cl-,H+和SiO32-、Fe3+和OH-、Cu2+和S2-等。
3、生成弱电解质而不能大量共存
判断原则:有弱酸、弱碱和水等弱电解质 生成,它们在水溶液中主要以难电离的分子存在,因此不能大量共存。
如:H+与ClO-、H+和OH-、H+和CH3COO-,H+和F-等。4、生成挥发性而不能共存
判断原则:有不稳定酸或不稳定碱生成。
如:H+和CO32-,H+和SO32-,H+和HSO3-,H+ 和S2-,NH4+和OH-等都不能在溶液中大量共存。
5、发生双水解反应而不能大量共存
判断原则;溶解性表中“——”符号的阴离子和阳离子不能共存,它们的盐不能在水溶液中存在。(1)AlO2- 与Al3+ (2)Al3+与CO32-、HCO3-、SO32-、HSO3-、S2- 、HS-等。(3)Fe3+与CO32-、 HCO3-等。(4)NH4+与SiO32-、 AlO2-等。
6、发生氧化-还原反应而不能大量共存 考查率较高的离子有:(1) Fe3+ 与 S2-(HS-) 、SO32-(HSO3- )、I-等;(2) NO3- (H+) 、MnO4- 、ClO- 与I-、Fe2+ 、S2-(HS-) 、SO32-(HSO3-) 、S2O32-等;(3)S2-与SO32-在酸性条件下不共存;(4)H+ 与 S2O32-不共存。7、发生络合反应而不共存的有:Fe3+与SCN- 、 CN-、C6H5O- 8、一切弱酸的酸式酸根离子在酸性或碱性溶液中均不能共存。如:HCO3-、HS-、HSO3-、HPO42-等都不能在酸性或碱性溶液中存在。
掌握以上的判断原则,同时注意题目中告知的离子组颜色以及其他的限制性条件等,如常见的有色离子有:Fe3+(棕黄色),Fe2+(浅绿),Cu2+(蓝),MnO4- (紫红);这样一般的离子共存题都能正确迅速地解答出来,并达到事半功倍的效果。1、与H+不能共存(即酸性溶液、PH<7、 石蕊变红)
OH-、CO32-、SO32-、SiO32-、S2-、CH3COO-、F-、ClO-,AlO2-、 S2O32-,HCO3-、HSO3-、HS-、HPO42-、H2PO4-。常见的离子共存问题2、与OH-不能共存(即碱性溶液、PH>7、 酚酞变红)
H+、NH4+、Mg2+、Fe2+、Fe3+、Al3+、Cu2+等, HSO3-、HS-、HPO42-、H2PO4-等。3、金属阳离子与酸根离子
Ag+、Ca2+、Ba2+、Pb2+与 CO32-、SO42-、PO43-、SO32-、SiO32-; Ag+与Cl-、Br-、I-; F-与Ca2+。4、(05,全国)pH=1的溶液中,可以大量共存的离子是( )。
A、K+、Na+、SO42-、S2O32-
B、NH4+、Mg2+、SO42-、Cl-
C、Na+、K+、HCO3-、Cl-
D、K+、Na+、AlO2-、NO3-B5、(05,广东)下列各组离子一定能大量共存的是( )。
A、在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=1×10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-B6、(06,威海)下列各组离子在指定环境下能大量共存的是( )。
A、pH=1的溶液中:Na+、S2-、K+、MnO4-
B、pH=7的溶液中:Al3+、Cl-、SO42-、HCO3-
C、pH>7的溶液中:Na+、AlO2-、SO42-、K+
D、pH=12的溶液中:Na+、K+、Fe2+、ClO-C7、(06,滨州)在列各组离子在所给条件下能够大量共存的是( )。
A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B、由水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、HCO3-、Cl-、S2-
C、使pH试纸显深蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42-
D、在Na2SO3溶液中:Na+、H+、NO3-、SO42-A8、下列各组中的离子能在pH=1的无色溶液中大量共存的是( )。
A、K+、Na+、I-、MnO4-
B、Mg2+、Cl-、Al3+、SO42-
C、K+、Cl-、HCO3-、NO3-
D、Ca2+、Na+、Fe3+、Br-B9、某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=1×10-2mol·L-1,在该溶液中可以大量存在的阴离子是
A、SO42- B、NO3- C、SCN- D、CO32-A10、(05,海淀)在pH=1的无色溶液中,下列离子组能大量共存的是( )。
A、NH4+、Ba2+、NO3-、CO32-
B、Fe2+、OH-、SO42-、MnO4-
C、K+、Mg2+、NO3- 、SO42-
D、Na+、Fe3+、Cl-、AlO2-C11、(05,哈师大附中、东北师大附中)
下列各溶液中能大量共存的离子组是( )。
A、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO32-、K+
B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-
C、c(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-
D、水电离出来的c(H+)和c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+C1、(93)下列各组离子,在水溶液中不可能大量共存的是( )
A、H+、K+、Cl- 、NO3- B、K+、 Al3+ 、Cl--、OH-
C、Na+、K+、CO32-、NO3- D、Al3+、Cl--、SO42-、 NO3-
2.(94)在PH=1的无色透明溶液中,不能大量共存的是( )
A、Al3+、Ag+、NO3-、Cl- B、Mg2+、 NH4+、Cl- 、NO3-
C、Ba2+、K+、S2- 、Cl- D、Zn2+、Na+、NO3- 、SO42-
3、(95)在PH=1的溶液中,可以大量共存的是( )
A、Na+、K+、S2- 、Cl- B、Al3+、Mg2+、SO42- 、Cl-
C、Na+、K+、NO3-、AlO2- D、Na+、K+、SO42-、S2O32-课堂练习(高考题再现):BACB4、下列各组离子,在强碱性溶液中可能大量共存的是( )
A、I-、AlO2-、S2- 、Cl-
B、Na+、K+、NH4+、Ba2+、
C、Br-、S2- 、Cl- 、CO32
D、SO32-、NO3-、SO42-、 HCO3-
5、(99) 在水溶液可以共存,且加入氨水也不产生沉淀( )
A、Na+、Ba2+、SO42- 、Cl--
B、K+、AlO2-、NO3-- 、OH-
C、H+、NH4+、Al3+、SO42-
D、H+、Cl- 、CH3COO-、NO3-ACB6、(00)在水溶液可以大量共存的是( )
A、,Ca2+、HCO3-、Cl-、K+
B、Al3+、AlO2-、HCO3-、 K+
C、Fe2+、NH4+、SO42- 、 S2-
D、Fe3+、SCN-、Na+、CO32-
7、(01)在强碱性溶液中可能大量共存的是( )
A、I- AlO2- Cl- S2- B、Na+ NH4+ K+ Ba2+
C.Br- S2- Cl- CO32- D.SO32- NO3- SO42- HCO3-
AAC8.(2004年江苏卷)巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
9、(96)下列各组离子,在强碱性溶液中可以大量共存的是( ).
A、K+ Na+ HSO3- Cl- B、Na+ Ba2+ AlO2- NO3-
C、NH4+ K+ Cl- NO3- D、K+ Na+ ClO- S2-
10、(97)下列各组离子,在强碱性溶液中可以大量共存的是
A、I- AlO2- Cl- S2-
B、Na+ K+ NH4+ Ba2+
C、Br- S2- Cl- CO32-
D、SO32- NO3- SO42- HCO3-DBAC11.(04年云南)在PH=1含Ba2+离子的溶液中,还能大量存在的离子是( )A. AlO2- B. ClO- C. Cl- D. SO42-C12.(02年上海)在PH=1的无色溶液中能大量共存的离子组是( )A. NH4+ Mg2+ SO42- Cl- B. Ba2+ K+ OH- NO3-C.Al3+ Cu2+ SO42- Cl- D.Na+ Ca2+ Cl- AlO2-A13、下列各组中的离子,能在无色溶液中大量共存的是( )
A、K+、Mg2+、NO3-、OH-
B、Cu2+、Na+、NO3-、SO42-
C、Na+、H+、Cl-、CO32-
D、Na+、Ba2+、Cl-、OH-
14、下列各组离子,能在溶液中大量共存的是
A、H+、Ca2+、Cl-、CO32-
B、Na+、Fe3+、SO42-、OH-
C、K+、Na+、OH-、Cl-
D、Cu2+、Ba2+、Cl-、SO42-?DC15.(01,上海)下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )A.H3O+、NO3- 、Fe2+ 、Na+ B.Ag+ 、 NO3-、 Cl- 、 K+ C.K+、 Ba2+、 OH-、 SO42- D.Cu2+、 NH4+、 Br- 、OH-A16.某溶液中水电离出的C(H+)=10-12mol/L,在溶液中肯定能大量存在的离子组是( )A.Na+ 、NO3-、K+、I- B.Ba2+、Cl-、 K+ 、NO3-C.Al3+、Cl-、SO42-、NO3- D.CO32-、K+、Br-、SO42-B17.(03)若某溶液中由水电离产生的C(OH-)=1x10-14mol/L满足此条件的溶液中一定可以大量共存的离子组是( )A.Al3+、 Na+、 NO3- 、Cl- B.K+ 、Na+ 、Cl- 、NO3-C.K+、 Na+ 、Cl- 、AlO2- D.K+ 、NH4+ 、SO42- 、NO3-B18. 某溶液中加入铝粉产生氢气,则该溶液中可能大量共存的离子组是( )A.NH4+ NO3- CO32- Na+ B.Na+ 、Ba2+ 、Mg2+ 、HCO3-C.NO3- 、Mg2+ 、Fe2+ 、Ca2+ D.NO3- 、Na+ 、K+ 、Cl-D19.某无色透明溶液,跟铝反应放出氢气,试判断下列离子:Mg2+ 、Cu2+ 、Ba2+ 、H+ 、Ag+ 、SO42- 、HCO3- 、OH- 、NO3- 何者能大量共存。(1)当生成Al3+时,可能存在:________________;(2)当生成AlO2-时,可能存在:______________。H+ 、Mg2+ 、SO42-OH- 、NO3- 、Ba2+20.某溶液在25℃时由水电离出C(H+)=1x10-12mol L-1,下列说法正确的是( )A.HCO3- 、 HS- 、 HPO42- 等离子在该溶液中不能大量共存。B.该溶液的PH可能为2 C.向溶液中加入铝片后,一定能生成氢气。D.若该溶液中的溶质只有一种,它一定是酸或碱。分析:由水电离出的C(H+)=1x10-12mol L-1,这是水的电离平衡被抑制的结果,抑制水电离的物质,可能是NaOH等碱,可能是HCl等非强氧化性酸,可能是HNO3等这样的强氧化性酸,还可能是NaHSO4这样的盐。AB21.(93)下列各组离子:(1)I- ClO- NO3- H+ (2)K+ NH4+ HCO3- OH- (3)SO32- SO42- Cl- OH- (4)Fe3+ Cu2+ SO42- Cl- (5)H+ K+ AlO2- HSO3- (6)Ca2+ Na+ SO42- CO32-能大量共存的是:A.(1) (6) B.(3)(4) C.(2) (5) D.(1) (4)B22.(97)(1)NaHSO4 溶液中逐滴加入Ba(OH)2溶液至中性,反应的离子方程式为:____________________(2)向以上中性溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为________________________________________23.若将Na+、K+、Al3+ 、H+ 、NH4+ 、AlO2- 、NO3- 、Cl- 、S2- 、OH-等10种阴阳离子分成可以相互共存的A、B两组,每组至少有两种阳离子和两种阴离子,且A组中要有Na+、B组中要有Al3+,则A组可以相互共存的是__________________ ,B 组可以相互共存的是__________________ 。Na+ K+ AlO2- S2- OH- Al3+ H+ NH4+ NO3- Cl-24.讨论:FeBr2与Cl2反应的离子方程式(1)FeBr2 与少量Cl2反应(2)FeBr2 与过量Cl2反应(3)10mL1mol/LFeBr2溶液中通入224mLCl2 (标况)反应的离子方程式2Fe2+ + Cl2 =2Fe3+ +2Cl-2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-2Fe2+ +2Br- +2Cl2=2Fe3+ +Br2 +4Cl-
A、NH4+、Cu2+、Cl-、NO3-
B、K+、Na+、SO32-、S2-
C、 K+、Na+、SO42-、AlO2-
D、 Ba2+、Fe2+、NO3-、Br-D2、(06,江苏)一定能在下列溶液中大量共存的离子组是( )。
A、含有大量Al3+的溶液:
Na+、NH4+、SO42-、Cl-
B、C(H+)=1×10-13mol/L的溶液:
Na+、Ca2+、SO42-、CO32-
C、含有大量Fe3+的溶液:
Na+、Mg2+、NO3-、SCN-
D、含有大量NO3-的溶液:
H+、Fe2+、SO42-、Cl-A3、(06,上海)已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( ).
A、Al3+ 、CH3COO- 、Cl-
B、Na+ 、NH4+ 、Cl-
C、Mg2+、Cl-、Fe2+
D、Mg2+、Ba2+、Br-B原则:
能反应就不共存,能共存就不反应。1、先弄清楚外加条件的暗示(1)分清是“能大量共存”还是“不能大量共存”。(2)“无色透明的溶液”中不能含有:Cu2+ Fe2+ Fe3+ MnO4-(3)“在强酸性(或pH=1)溶液中”,应考虑H+的影响。(4)“在强碱性(或pH=14)溶液中”,应考虑OH-的影响。(5)“在由水电离出的C(H+)=10-10mol/L【或C(OH-)=10-10mol/L】的溶液中能大量共存的” ,即在酸性和碱性条件下均能大量共存的离子组。(6)“在与 Al反应产生H2的溶液 中”,即含大量H+或OH-。应加上对H+或OH-的分析,并弄清是“肯定还是可能大量共存”。(7)“因氧化还原反应……”,即只考虑离子间的氧化还原反应。2、生成沉淀而不能大量共存
判断原则:溶解性表中不溶或微溶的物质的阴、阳离子,不能大量共存。
如:Ag+和Cl-,H+和SiO32-、Fe3+和OH-、Cu2+和S2-等。
3、生成弱电解质而不能大量共存
判断原则:有弱酸、弱碱和水等弱电解质 生成,它们在水溶液中主要以难电离的分子存在,因此不能大量共存。
如:H+与ClO-、H+和OH-、H+和CH3COO-,H+和F-等。4、生成挥发性而不能共存
判断原则:有不稳定酸或不稳定碱生成。
如:H+和CO32-,H+和SO32-,H+和HSO3-,H+ 和S2-,NH4+和OH-等都不能在溶液中大量共存。
5、发生双水解反应而不能大量共存
判断原则;溶解性表中“——”符号的阴离子和阳离子不能共存,它们的盐不能在水溶液中存在。(1)AlO2- 与Al3+ (2)Al3+与CO32-、HCO3-、SO32-、HSO3-、S2- 、HS-等。(3)Fe3+与CO32-、 HCO3-等。(4)NH4+与SiO32-、 AlO2-等。
6、发生氧化-还原反应而不能大量共存 考查率较高的离子有:(1) Fe3+ 与 S2-(HS-) 、SO32-(HSO3- )、I-等;(2) NO3- (H+) 、MnO4- 、ClO- 与I-、Fe2+ 、S2-(HS-) 、SO32-(HSO3-) 、S2O32-等;(3)S2-与SO32-在酸性条件下不共存;(4)H+ 与 S2O32-不共存。7、发生络合反应而不共存的有:Fe3+与SCN- 、 CN-、C6H5O- 8、一切弱酸的酸式酸根离子在酸性或碱性溶液中均不能共存。如:HCO3-、HS-、HSO3-、HPO42-等都不能在酸性或碱性溶液中存在。
掌握以上的判断原则,同时注意题目中告知的离子组颜色以及其他的限制性条件等,如常见的有色离子有:Fe3+(棕黄色),Fe2+(浅绿),Cu2+(蓝),MnO4- (紫红);这样一般的离子共存题都能正确迅速地解答出来,并达到事半功倍的效果。1、与H+不能共存(即酸性溶液、PH<7、 石蕊变红)
OH-、CO32-、SO32-、SiO32-、S2-、CH3COO-、F-、ClO-,AlO2-、 S2O32-,HCO3-、HSO3-、HS-、HPO42-、H2PO4-。常见的离子共存问题2、与OH-不能共存(即碱性溶液、PH>7、 酚酞变红)
H+、NH4+、Mg2+、Fe2+、Fe3+、Al3+、Cu2+等, HSO3-、HS-、HPO42-、H2PO4-等。3、金属阳离子与酸根离子
Ag+、Ca2+、Ba2+、Pb2+与 CO32-、SO42-、PO43-、SO32-、SiO32-; Ag+与Cl-、Br-、I-; F-与Ca2+。4、(05,全国)pH=1的溶液中,可以大量共存的离子是( )。
A、K+、Na+、SO42-、S2O32-
B、NH4+、Mg2+、SO42-、Cl-
C、Na+、K+、HCO3-、Cl-
D、K+、Na+、AlO2-、NO3-B5、(05,广东)下列各组离子一定能大量共存的是( )。
A、在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=1×10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-B6、(06,威海)下列各组离子在指定环境下能大量共存的是( )。
A、pH=1的溶液中:Na+、S2-、K+、MnO4-
B、pH=7的溶液中:Al3+、Cl-、SO42-、HCO3-
C、pH>7的溶液中:Na+、AlO2-、SO42-、K+
D、pH=12的溶液中:Na+、K+、Fe2+、ClO-C7、(06,滨州)在列各组离子在所给条件下能够大量共存的是( )。
A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B、由水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、HCO3-、Cl-、S2-
C、使pH试纸显深蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42-
D、在Na2SO3溶液中:Na+、H+、NO3-、SO42-A8、下列各组中的离子能在pH=1的无色溶液中大量共存的是( )。
A、K+、Na+、I-、MnO4-
B、Mg2+、Cl-、Al3+、SO42-
C、K+、Cl-、HCO3-、NO3-
D、Ca2+、Na+、Fe3+、Br-B9、某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=1×10-2mol·L-1,在该溶液中可以大量存在的阴离子是
A、SO42- B、NO3- C、SCN- D、CO32-A10、(05,海淀)在pH=1的无色溶液中,下列离子组能大量共存的是( )。
A、NH4+、Ba2+、NO3-、CO32-
B、Fe2+、OH-、SO42-、MnO4-
C、K+、Mg2+、NO3- 、SO42-
D、Na+、Fe3+、Cl-、AlO2-C11、(05,哈师大附中、东北师大附中)
下列各溶液中能大量共存的离子组是( )。
A、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO32-、K+
B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-
C、c(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-
D、水电离出来的c(H+)和c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+C1、(93)下列各组离子,在水溶液中不可能大量共存的是( )
A、H+、K+、Cl- 、NO3- B、K+、 Al3+ 、Cl--、OH-
C、Na+、K+、CO32-、NO3- D、Al3+、Cl--、SO42-、 NO3-
2.(94)在PH=1的无色透明溶液中,不能大量共存的是( )
A、Al3+、Ag+、NO3-、Cl- B、Mg2+、 NH4+、Cl- 、NO3-
C、Ba2+、K+、S2- 、Cl- D、Zn2+、Na+、NO3- 、SO42-
3、(95)在PH=1的溶液中,可以大量共存的是( )
A、Na+、K+、S2- 、Cl- B、Al3+、Mg2+、SO42- 、Cl-
C、Na+、K+、NO3-、AlO2- D、Na+、K+、SO42-、S2O32-课堂练习(高考题再现):BACB4、下列各组离子,在强碱性溶液中可能大量共存的是( )
A、I-、AlO2-、S2- 、Cl-
B、Na+、K+、NH4+、Ba2+、
C、Br-、S2- 、Cl- 、CO32
D、SO32-、NO3-、SO42-、 HCO3-
5、(99) 在水溶液可以共存,且加入氨水也不产生沉淀( )
A、Na+、Ba2+、SO42- 、Cl--
B、K+、AlO2-、NO3-- 、OH-
C、H+、NH4+、Al3+、SO42-
D、H+、Cl- 、CH3COO-、NO3-ACB6、(00)在水溶液可以大量共存的是( )
A、,Ca2+、HCO3-、Cl-、K+
B、Al3+、AlO2-、HCO3-、 K+
C、Fe2+、NH4+、SO42- 、 S2-
D、Fe3+、SCN-、Na+、CO32-
7、(01)在强碱性溶液中可能大量共存的是( )
A、I- AlO2- Cl- S2- B、Na+ NH4+ K+ Ba2+
C.Br- S2- Cl- CO32- D.SO32- NO3- SO42- HCO3-
AAC8.(2004年江苏卷)巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
9、(96)下列各组离子,在强碱性溶液中可以大量共存的是( ).
A、K+ Na+ HSO3- Cl- B、Na+ Ba2+ AlO2- NO3-
C、NH4+ K+ Cl- NO3- D、K+ Na+ ClO- S2-
10、(97)下列各组离子,在强碱性溶液中可以大量共存的是
A、I- AlO2- Cl- S2-
B、Na+ K+ NH4+ Ba2+
C、Br- S2- Cl- CO32-
D、SO32- NO3- SO42- HCO3-DBAC11.(04年云南)在PH=1含Ba2+离子的溶液中,还能大量存在的离子是( )A. AlO2- B. ClO- C. Cl- D. SO42-C12.(02年上海)在PH=1的无色溶液中能大量共存的离子组是( )A. NH4+ Mg2+ SO42- Cl- B. Ba2+ K+ OH- NO3-C.Al3+ Cu2+ SO42- Cl- D.Na+ Ca2+ Cl- AlO2-A13、下列各组中的离子,能在无色溶液中大量共存的是( )
A、K+、Mg2+、NO3-、OH-
B、Cu2+、Na+、NO3-、SO42-
C、Na+、H+、Cl-、CO32-
D、Na+、Ba2+、Cl-、OH-
14、下列各组离子,能在溶液中大量共存的是
A、H+、Ca2+、Cl-、CO32-
B、Na+、Fe3+、SO42-、OH-
C、K+、Na+、OH-、Cl-
D、Cu2+、Ba2+、Cl-、SO42-?DC15.(01,上海)下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )A.H3O+、NO3- 、Fe2+ 、Na+ B.Ag+ 、 NO3-、 Cl- 、 K+ C.K+、 Ba2+、 OH-、 SO42- D.Cu2+、 NH4+、 Br- 、OH-A16.某溶液中水电离出的C(H+)=10-12mol/L,在溶液中肯定能大量存在的离子组是( )A.Na+ 、NO3-、K+、I- B.Ba2+、Cl-、 K+ 、NO3-C.Al3+、Cl-、SO42-、NO3- D.CO32-、K+、Br-、SO42-B17.(03)若某溶液中由水电离产生的C(OH-)=1x10-14mol/L满足此条件的溶液中一定可以大量共存的离子组是( )A.Al3+、 Na+、 NO3- 、Cl- B.K+ 、Na+ 、Cl- 、NO3-C.K+、 Na+ 、Cl- 、AlO2- D.K+ 、NH4+ 、SO42- 、NO3-B18. 某溶液中加入铝粉产生氢气,则该溶液中可能大量共存的离子组是( )A.NH4+ NO3- CO32- Na+ B.Na+ 、Ba2+ 、Mg2+ 、HCO3-C.NO3- 、Mg2+ 、Fe2+ 、Ca2+ D.NO3- 、Na+ 、K+ 、Cl-D19.某无色透明溶液,跟铝反应放出氢气,试判断下列离子:Mg2+ 、Cu2+ 、Ba2+ 、H+ 、Ag+ 、SO42- 、HCO3- 、OH- 、NO3- 何者能大量共存。(1)当生成Al3+时,可能存在:________________;(2)当生成AlO2-时,可能存在:______________。H+ 、Mg2+ 、SO42-OH- 、NO3- 、Ba2+20.某溶液在25℃时由水电离出C(H+)=1x10-12mol L-1,下列说法正确的是( )A.HCO3- 、 HS- 、 HPO42- 等离子在该溶液中不能大量共存。B.该溶液的PH可能为2 C.向溶液中加入铝片后,一定能生成氢气。D.若该溶液中的溶质只有一种,它一定是酸或碱。分析:由水电离出的C(H+)=1x10-12mol L-1,这是水的电离平衡被抑制的结果,抑制水电离的物质,可能是NaOH等碱,可能是HCl等非强氧化性酸,可能是HNO3等这样的强氧化性酸,还可能是NaHSO4这样的盐。AB21.(93)下列各组离子:(1)I- ClO- NO3- H+ (2)K+ NH4+ HCO3- OH- (3)SO32- SO42- Cl- OH- (4)Fe3+ Cu2+ SO42- Cl- (5)H+ K+ AlO2- HSO3- (6)Ca2+ Na+ SO42- CO32-能大量共存的是:A.(1) (6) B.(3)(4) C.(2) (5) D.(1) (4)B22.(97)(1)NaHSO4 溶液中逐滴加入Ba(OH)2溶液至中性,反应的离子方程式为:____________________(2)向以上中性溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为________________________________________23.若将Na+、K+、Al3+ 、H+ 、NH4+ 、AlO2- 、NO3- 、Cl- 、S2- 、OH-等10种阴阳离子分成可以相互共存的A、B两组,每组至少有两种阳离子和两种阴离子,且A组中要有Na+、B组中要有Al3+,则A组可以相互共存的是__________________ ,B 组可以相互共存的是__________________ 。Na+ K+ AlO2- S2- OH- Al3+ H+ NH4+ NO3- Cl-24.讨论:FeBr2与Cl2反应的离子方程式(1)FeBr2 与少量Cl2反应(2)FeBr2 与过量Cl2反应(3)10mL1mol/LFeBr2溶液中通入224mLCl2 (标况)反应的离子方程式2Fe2+ + Cl2 =2Fe3+ +2Cl-2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-2Fe2+ +2Br- +2Cl2=2Fe3+ +Br2 +4Cl-
同课章节目录
