氧化还原反应(云南省曲靖市麒麟区)
图片预览










文档简介
课件69张PPT。 第一节
重要的氧化和还原剂——氧化还原反应1、下列说法中,正确的是( )
??? A、氧化剂具有氧化性
B、氧化剂发生氧化反应
??? C、氧化剂发生反应后生成氧化产物
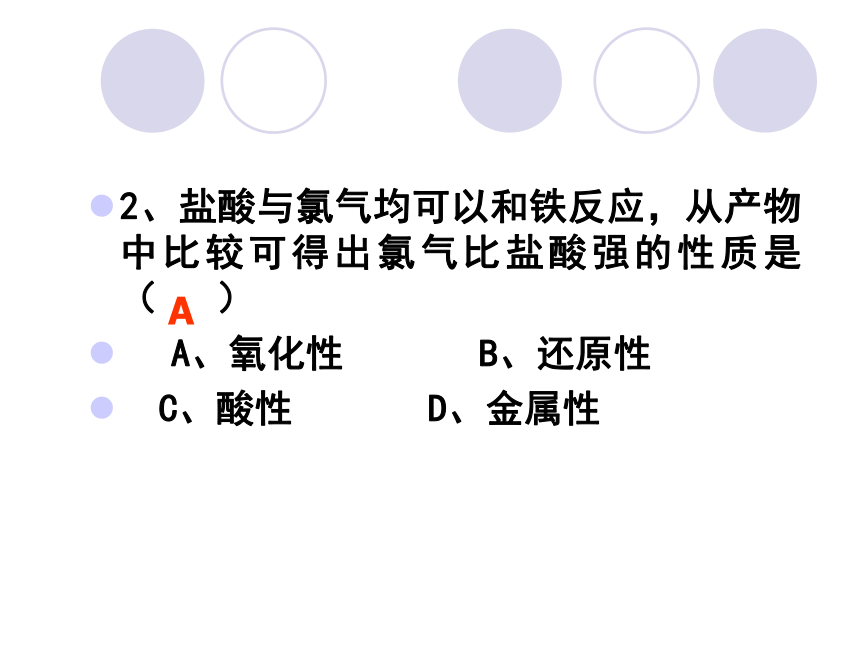
D、氧化还原反应的任何一种反应物不 是氧化剂就必定是还原剂课前热身A2、盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是( )
??? A、氧化性 B、还原性
C、酸性 D、金属性A3、下列说法中完全正确的是( )
??? A、失电子难的原子,其获得电子的能力一定强
??? B、在反应中,金属单质只表现还原性,非金属单质只表现氧化性
??? C、L层比M层多一个电子的元素,其单质一定具有较强的氧化性
??? D、有单质参加的化学反应不一定都是氧化还原反应C D4、下列叙述中,正确的是( )
??? A、含金属元素的离子不一定是阳离子
???B、在氧化还原反应中,非金属单质一定是氧化剂
???C、某元素从化合态变化游离态时,该元素一定被还原
??? D、金属阳离子被还原一定得到金属单质A一、基本概念的理解二、掌握两种电子转移的表示法三、常见的氧化剂和还原剂四、氧化性和还原性强弱比较五、氧化还原反应的基本规律六、有关氧化还原反应的计算七、氧化还原反应的配平氧 化 还 原 反 应一、氧化还原反应基本概念:1.氧化还原反应的基本概念 氧化还原反应从特征来说是指有元素化合价升降的化学反应;
从本质上来看则是指有电子转移(得失或偏移)的反应。(1)氧化剂、还原剂 氧化剂是指在反应中得到电子(或电子对偏向)的反应物,表现为反应后所含元素化合价降低。氧化剂具有氧化性,在反应中本身被还原,其生成物叫还原产物。 还原剂是指在反应中失去电子(或电子对偏离)的反应物,表现为反应后所含元素化合价升高,还原剂具有还原性,反应中本身被氧化,生成物是氧化产物。 升、失、氧、还,
降、得、还、氧。记忆方法2、氧化剂、还原剂、氧化产物、还原产物的关系: 二、氧化还原反应的表示方法表示KClO3+ 6HCl(浓)= 3Cl2+ KCl +
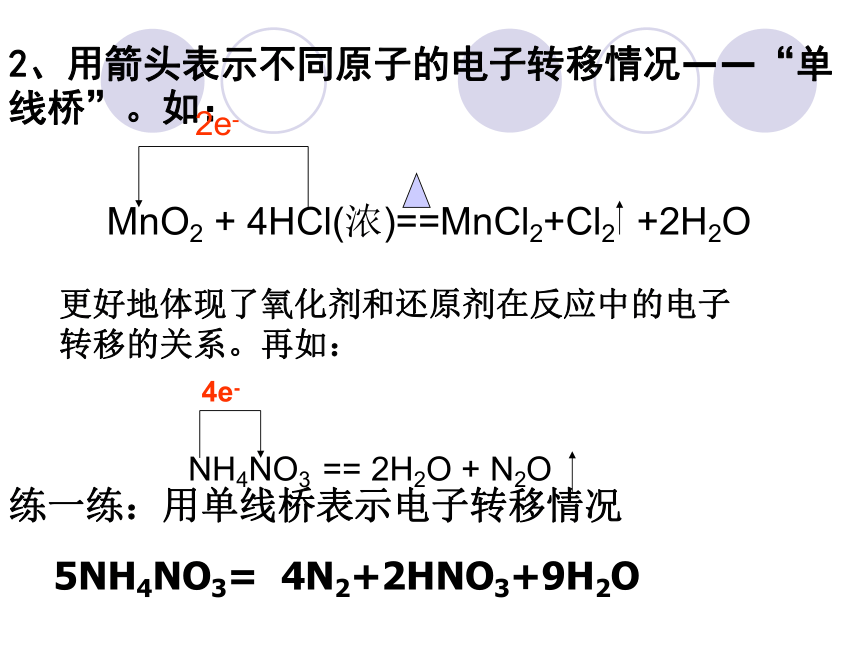
3 H2O电子转移的方向和数目1、用箭头表明同一元素原子的电子转移情况即大家熟悉的“双线桥”。如: 在氧化还原反应化学方程式里,除了可用箭头表明同一元素原子的电子转移情况外(即:双线桥法),还可以用箭头表示不同原子的电子转移情况(称为“单线桥法”)。1、双线桥法(1)两条箭头都是由反应物指向生成物,且对准相应的元素(2)在桥线上标明“失去”或“得到”电子的数目(用n×me-表示),且总数相等(3)箭头不代表电子转移的方向2、用箭头表示不同原子的电子转移情况——“单线桥”。如: 更好地体现了氧化剂和还原剂在反应中的电子转移的关系。再如: 练一练:用单线桥表示电子转移情况
5NH4NO3= 4N2+2HNO3+9H2OMnO2 + 4HCl(浓)==MnCl2+Cl2 +2H2O 2e-NH4NO3 == 2H2O + N2O2、单线桥分析氧化还原反应可简单表示为 ①箭头线由还原剂指向氧化剂
②在单线桥上,只表明电子转移的总数目,不写“得”或“失”
③箭头表示电子转移的方向标电子转移的方向和数目: ① 单线桥法 : 如:KClO3 + 6HCl = KCl + 3Cl2 ↑+ 3H2O5e-② 双线桥法: 失5e-得5×e-[练习] 写出下列反应的化学方程式,并用双线桥或单线
桥法标出电子转移方向和数目。(1)铜跟浓硝酸反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O2e-(2)硫化氢气体通入浓硫酸中: H2S + H2SO4 (浓) = S↓+ SO2 ↑+ 2H2O2e-(3)红热炭投入热的浓硝酸溶液中: 4e-例1.标出反应的电子转移方向和数目,
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
该反应中氧化剂为______,还原剂为________,1mol CuSO4能氧化P原子的物质的量是________ 。1molP能氧化 molP。 失30e-得15e-得15e-P、CuSO4P0.2mol0.6mol例2.氢阴离子(H-)能和NH3反应:
H-+NH3= NH2- +H2↑。根据上述反应事
实可以得到的正确结论是( ) A.NH3具有还原性 B.H-是很强的还原剂 C. H2只是该反应的还原产物 D.该反应属于置换反应 B 例3、需要加入氧化剂才能实现的变化是( )
A.MnO2→MnSO4 B.AlO2-→Al(OH)3 C.KI→KIO3 D.HNO3→NOC三、常用的氧化剂和还原剂2、常用的还原剂(1)部分低价化合物或酸根离子,如H2S、I—、S2— 等;
(2)某些活泼金属单质,如Na、Mg、Al、Fe 等;
(3)某些非金属单质,如 H2、C 等。
(4)元素处于低化合价时的氧化物,如CO、SO2等。(1)部分氧化物和过氧化物,如 MnO2 、Na2O2等;
(2)某些高价含氧酸及含氧酸盐,如 KMnO4、KClO3 、K2Cr2O7 、HNO3、浓H2SO4 等;
(3)某些活泼非金属单质,如F2、Cl2、Br2、I2、O2 等;
(4)某些高价金属离子,如Fe3+、Cu2+ 等。1、常见的氧化剂(1)重要的氧化剂:① 活泼的非金属单质:O2、Cl2、Br2、I2、O3、S等 ② 元素处于高化合价时的氧化物:MnO2 ③ 元素处于高化合价时的含氧酸: HNO3、浓H2SO4、 ④ 元素处于高化合价时的盐:KMnO4、KClO3、
K2Cr2O7、 FeCl3 等 ⑤过氧化物:H2O2、Na2O2⑥高价金属阳离子:Cu2+、Fe3+ Hg2+或H+⑦其他:HClO、漂白粉、NO2、NaHSO4、银氨溶液、新制氢氧化铜(2)重要的还原剂: ① 活泼的金属单质: K、Na、Mg、Al、Zn、Fe等 ② 某些非金属单质:焦炭、H2 、Si等 ③ 元素处于低化合价时的氧化物:如CO、SO2等 ④ 元素处于低化合价时的酸:如HCl、H2S、H2SO3等 ⑤ 元素处于低化合价时的盐:Na2SO3 、FeSO4等 ⑥非金属阴离子:S2-、I-等;
低价金属阳离子: Cu+、Fe2+ [练习] 1、在下列各微粒组中,各种微粒都只有还原性的是( )。
A.H2S(气)、Fe 、S2- B.Na、I-、NO3-
C.Fe2+、SO2、H2O D.S、HSO3-、H2SO3A2、在下列各物质组中,全部都是常见的氧化剂
的是 ( )。
A.HNO3、浓H2SO4 、KMnO4、H3PO4
B. H2O2、O3、Cl2 、 Br2
C.AlCl3、FeCl3 、CuCl2 、O2
D. CH3CHO、HCl、SO2 、COB3、在下列各物质中,因具有强氧化性可作消毒剂的是( )。
A.NaClO溶液 B.苯酚溶液
C.3%双氧水 D.75%酒精溶液 AC三、与其它反应类型间的关系 置换反应 电极反应 化合反应 分解反应氧化还原反应 有机反应 复分解反应?√√??×判断1 、有单质参加的化合反应都是氧化还原反应。2 、有单质生成的分解反应都是氧化还原反应。3 、有单质生成的反应都是氧化还原反应。4 、有单质参加的反应都是氧化还原反应。5 、有机反应都不是氧化还原反应。6 、除同素异形体之间的转化外,有单质参加的 反应都是氧化还原反应。7 、除同素异形体之间的转化外,有单质生成 的反应都是氧化还原反应。√√√√×××1、根据金属活泼性判断金属性越强,单质的还原性越强,其对应离子的氧化性越弱2、根据非金属的活泼性判断非金属性越强,单质的氧化性越强,其对应离子的还原性越弱如:氧化性:F2> Cl2> Br2>I2 >S
还原性:S2- >I- >Br- >Cl- >F-四、氧化性和还原性强弱比较四、氧化性和还原性强弱比较3.根据化学反应判断 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 记忆:“左>右” 4.根据反应条件判断 当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难易来进行判断。越易反应,则氧化剂的氧化性越强。如: 4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑ 16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑ 则氧化性:KMnO4>MnO2 判断还原剂还原性的原理类似。 5.由氧化产物的价态高低来判断当同一还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物元素价态的高低来判断氧化剂氧化性的强弱。即:在相同条件下,使还原剂价态升得越高,则氧化剂的氧化性越强。如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2>S 判断还原剂还原性的原理类似。[注意]
?(1)?? 并非还原产物中元素化合价越低,氧化剂的氧化性就越强。如反应
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(生成物中N的化合价为+2)
Cu+4HNO3(浓) = Cu(NO3)2+NO2↑+2H2O
(生成物中N的化合价为+4)
但HNO3(浓)的氧化性强于HNO3(稀)。
?(2)一般来说,同一种元素的化合价越高,则相应的物质或微粒的氧化性越强,如Fe3+氧化性比Fe2+强。但是,HClO氧化性强于HClO4,H2SO3(稀)氧化性强于H2SO4(稀)。 (2)同周期元素(从左到右):原子或单质还原性逐渐减弱,氧化性逐渐增强。阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。 6.根据元素周期表判断(1)同主族元素(从上到下):非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强;金属原子(或单质)还原性逐渐增强,对应阳离子氧化性逐渐减弱。 金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱 (2)电解池:
阳极:易失去电子的先放电(还原性)
S2->I->Br->Cl->OH-
阴极:易得电子的先放电(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+7、根据电化学原理(1)原电池
负极比正极活泼,易失去电子
还原性:负极>正极(2)元素的非金属性越强,相应单质的氧化性越强,相应阴离子的还原性越弱。
如非金属性:F>O>Cl> Br > I > S
氧化性:F2>O2>Cl2 > Br2 > I2 > S
还原性:F- A.M>N>P>Q B.P>N>M>Q
C.Q>P>N>M D.N>M>P>Q
B例2.现有下列三个氧化还原反应存在:
①2FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。
下列试剂中,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl C例3、根据下列三个反应的化学方程式,下列关系式正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3
A、氧化性:Fe3+>Cl2>H2SO4>I2
B、还原性:SO2>I->Fe2+>Cl-
C、2Fe+3I2 = 2FeI3
D、FeI2+Cl2=FeCl2+I2B例4、在一定条件下,氯酸钾与碘按下式反应:2KClO3+I2=2KIO3+Cl2,由此可推断下列相应的结论,不能推出的是( )
A、该反应属于置换反应
B、还原性:I2>Cl2
C、非金属性:I>Cl
D.氧化性:KClO3>Cl2CD五、氧化还原反应的基本规律2.价态规律3.邻位变化规律4.强弱规律5.优先规律1.遵循三大守恒原则1.遵循三大守恒原则(1)得失电子守恒: 氧化剂得电子总数=还原剂失电子总数。
(2)原子守恒: 某元素的原子的种类及个数在反应前后保持不变。
(3)电荷守恒: 离子反应中,反应前后离子所带总电荷相等
(4)质量守恒: 例题:
下面的离子方程式 : xR2++yH++O2 →mR3++nH2O, 下列R3+、R2+和化学计量数m、n的判断错误的是( )
(A)m=4,R3+是氧化产物 (B)m=y,R2+显还原性 (C)x=3,R3+是氧化产物 (D)x=y,R2+显还原性C2、价态规律(1)当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。如:浓硫酸的S只具有氧化性,H2S中的S只具有还原性,单质S具有氧化性又具有还原性。高价氧,低价还;中间价,两边转。(2)价态归中规律:
不同价态的同种元素之间发生氧化还原反应时遵循“高价+低价→中间价”的规律;而不会出现价态交错现象 如:S+2H2SO4(浓)→3SO2↑+2H2O 6HCl+KClO3→3Cl2↑+KCl+3H2O“只靠拢,不交叉”(3)歧化反应规律(歧化律)发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。反应规律:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价 +低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。如:Cl2+2NaOH=NaCl+NaClO+H2O不同价态的同种元素之间发生氧化还原反应时(不会在相邻价态间进行),向邻价位转化。浓H2SO4与SO2会反应吗?3.邻位变化规律: 4.强弱的规律:如:2Fe3++2I-→2Fe2++I2
氧化性:Fe3+>I2 还原性:I->Fe2+ 强氧化剂+强还原剂→弱还原剂(还原产物)+
弱氧化剂(氧化产物)
(1)氧化剂 →还原产物, 还原剂→氧化产物;
(2)氧化性:氧化剂>氧化产物, (3)还原性:还原剂>还原产物。左>右 例题:
已知:①2Fe3++2I-→2Fe2++I2 ②2Fe2++Br2 →2Fe3++2Br-。 则离子的还原性从强到弱的顺序正确的是( )
(A)Br->Fe2+>I- (B)I->Fe2+>Br- (C)Br->I->Fe2+ (D)Fe2+>I->Br- B例1、(04全国理综10)已知常温下在溶液中可发生如下的两个反应: Ce4++Fe2+= Ce3++Fe3+ Sn2++2Fe3+= Sn4++2Fe2+ 由此可以确定Fe2+ 、 Ce3+ 、 Sn2+三种离子还原性由强到弱的顺序为( )
A. Sn2+ Fe2+ Ce3+ 、 B. Sn2+ Ce3+ Fe2+
C. Ce3+ Fe2+ Sn2+ 、D. Fe2+ Sn2+ Ce3+ A例2、已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2> Z2> X2 >Y2,下列氧化还原反应能发生的是 ( ) A. 2W- + Z2 = 2Z- + W2
B. 2X- + Z2 = 2Z- + X2 C. 2Y- + W2 = 2W- + Y2
D. 2Z- + X2 = 2X- + Z2 BC 当一种氧化剂同时氧化几种还原剂时,
首先氧化最强的还原剂,待最强还原剂完全
氧化后,多余的氧化剂再依次氧化次强还
原剂;当然一种还原剂同时还原几种氧化
剂时,也是如此。 如:将金属Zn投入含Cu2+、Fe2+和Mg2+的
溶液中,因氧化性Cu2+>Fe2+>Zn2 + > Mg2+
,故首先置换出Cu,待Cu被完全置换出来后,
再置换出Fe,但不能置换出Mg。 5. 优先规律:谁强谁优先 例题:
向100mL1mol/L的FeBr2溶液中通入
标准状况下的Cl2,当通入Cl2的体积分别
为(1)1.12L,(2)2.24L,(3)4.48L时,
写出反应的离子方程式。 离子方程式分别为:
(1)2Fe2++Cl2=2Fe3++2Cl-
(2)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
(3)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-氧化还原统一体电子得失必相等两强反应变两弱强弱两极相背离歧化高低分上下高氧低还中两性归中价态不交叉强度 CT 成正比价态相邻不反应先强后弱要牢记升失氧化还原剂降得还原氧化剂氧化还原反应记忆歌诀例2:某金属与稀硝酸均恰好完全反应生成NO,消耗金属和HNO3的物质的量之比为1:3,则该金属可能是( )
(A)Cu (B)Ag (C)Fe (D)AlC例3:2.24(g)铁粉与50mL稀硝酸恰好完全反应(硝酸的还原产物是NO),向反应后的溶液中加入50mL0.2mol/L的KI溶液,I-恰好被完全氧化成单质碘,求硝酸的物质的量浓度。0.6mol/L 六、有关氧化还原反应的计算
利用电子守恒、电荷守恒、原子守恒原理计算,可使计算过程大大简化。 例1:24mL 0.05 mol/L 的Na 2 SO 3 溶液, 恰好与 20 mL0.02mol/L的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
(A) +6 (B) +3 (C) +2 (D) 0B例2、硫酸铵在强热条件下分解生成NH3、SO2、N2和水的反应中氧化产物和还原产物的物质的量之比是( )
??? A、2:3 B、4:3
C、1:1 D、1:3D练习1、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,则HNO3的还原产物可能是( )?
A、NH4NO3 B、N2O
C、NO D、NO2A B练习2.在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑反应中,若有5mol水作还原剂时,则由水还原的BrF3的物质的量为多少? A.0.9 mol B.1 mol C.1.2 mol D.2.2 mol解:根据得失电子守恒,失电子总数=0.3 ×(2+8)=3 摩尔,故硝酸被还原成没有共 1 摩尔。例3.0.3 molCu2S 与足量的硝酸反应,生成硝酸铜,硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸物质的量为( )B分析:未被还原的硝酸以 Cu(NO3)2 形式存在,共有 0.6 molCu ,故未被还原的硝酸有 0.6 × 2=1.2 mol那么,未被还原的硝酸物质的量呢?例 4( 2003 年高考题)在一定的条件下, PbO2 与 Cr3+反应,产物是 Cr2O72-和 Pb2+,则与 1 molCr3+反应所需 PbO2 的物质量为( )
A. 3.0 mol B.1.5 mol
C.1.0mol D.0.75 mol
〖分析〗据题意, PbO2 与 Cr3 +反应, PbO2 作氧化剂, Cr3 +作还原剂
根据氧化还原反应中电子守恒有,1mol×3 =n(PbO2) × 2
n(PbO2)=1.5 mol B例5、(00 年高考题)硫代硫酸钠可作为脱氯剂,已知 25.0 ml0.100mol.L-1 Na2S2O3 溶液恰好把 224 ml (标准状况下) Cl2 完全转化为 Cl-,则 S2O32 -将转化为( )
A.S2 - B .S C. SO32 - D.SO42 -〖分析〗据题意, Cl2 与 S2O32 -反应, Cl2 作氧化剂, S2O32 -作还原剂,设反应后 S 最终价态为 X,
有:
0.224/22.4 × 2=0.100 × 0.0250 ×(X - 2) × 2
解得: X=6
D例6、在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )mol/L
A. a/b B.2a/b C. 3a/b D. 5a/b
〖分析〗 Fe2+, Br-都具有还原性,由 2FeBr2+Br2=2 FeBr3 可以判断出: Fe2+还原性强于Br-因此向 FeBr2 溶液中通入 Cl2 时,氯气先与 Fe2+反应,当 Fe2+全部被氧化为 Fe3+时,再与 Br-反应。A(07全国理综1)10、已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到电子
A、10mol B、11mol C、12mol D、13mol
(07全国理综1)11、等物质的量的下列化合物在相应条件下完全分解后,得到的O2最多的是
A、KClO3(加MnO2催化剂,加热)
B、KMnO4(加热)
C、H2O2(水溶液,加MnO2催化剂)
D、HgO(加热)BA(07全国II)11.在氧化还原反应中,水作为氧化剂的是
A.C+ H2O = CO2+ H2
B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2A(2007年高考理综宁夏卷)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为( )
(A)1:7 (B)7:1
(C)7:8 (D)8:7B26.(2007年高考理综重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为___________________________________。2Fe3++H2S=S↓+2Fe2++2H+(07四川)10.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL A七、氧化还原反应配平1.配平总原则:反应中化合价升降总数相等及反应前后原子种类及个数相等。
2.配平一般步骤:标好价,算变化,总相等,配其它。
3.配平策略:先用观察法,不行再用氧化还原法,同时注意观察。
如: K2MnF6+ SbF5= KSbF6+ MnF3+ F2 (1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平 。
Pt + HNO3+ HCl —H2PtCl6 + NO + H2O
(2)自变从右边配:自身氧化—还原反应(包括分解、歧化)(部分氧化还原)
一般从右边着手配平
例如:Cl2 + KOH —KCl + KClO3 + H2O
(NH4)2PtCl6 —Pt + NH4Cl + HCl + N2
Cu(NO3)2—CuO + NO2 + O2
4. 配平基本技能:
重要的氧化和还原剂——氧化还原反应1、下列说法中,正确的是( )
??? A、氧化剂具有氧化性
B、氧化剂发生氧化反应
??? C、氧化剂发生反应后生成氧化产物
D、氧化还原反应的任何一种反应物不 是氧化剂就必定是还原剂课前热身A2、盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是( )
??? A、氧化性 B、还原性
C、酸性 D、金属性A3、下列说法中完全正确的是( )
??? A、失电子难的原子,其获得电子的能力一定强
??? B、在反应中,金属单质只表现还原性,非金属单质只表现氧化性
??? C、L层比M层多一个电子的元素,其单质一定具有较强的氧化性
??? D、有单质参加的化学反应不一定都是氧化还原反应C D4、下列叙述中,正确的是( )
??? A、含金属元素的离子不一定是阳离子
???B、在氧化还原反应中,非金属单质一定是氧化剂
???C、某元素从化合态变化游离态时,该元素一定被还原
??? D、金属阳离子被还原一定得到金属单质A一、基本概念的理解二、掌握两种电子转移的表示法三、常见的氧化剂和还原剂四、氧化性和还原性强弱比较五、氧化还原反应的基本规律六、有关氧化还原反应的计算七、氧化还原反应的配平氧 化 还 原 反 应一、氧化还原反应基本概念:1.氧化还原反应的基本概念 氧化还原反应从特征来说是指有元素化合价升降的化学反应;
从本质上来看则是指有电子转移(得失或偏移)的反应。(1)氧化剂、还原剂 氧化剂是指在反应中得到电子(或电子对偏向)的反应物,表现为反应后所含元素化合价降低。氧化剂具有氧化性,在反应中本身被还原,其生成物叫还原产物。 还原剂是指在反应中失去电子(或电子对偏离)的反应物,表现为反应后所含元素化合价升高,还原剂具有还原性,反应中本身被氧化,生成物是氧化产物。 升、失、氧、还,
降、得、还、氧。记忆方法2、氧化剂、还原剂、氧化产物、还原产物的关系: 二、氧化还原反应的表示方法表示KClO3+ 6HCl(浓)= 3Cl2+ KCl +
3 H2O电子转移的方向和数目1、用箭头表明同一元素原子的电子转移情况即大家熟悉的“双线桥”。如: 在氧化还原反应化学方程式里,除了可用箭头表明同一元素原子的电子转移情况外(即:双线桥法),还可以用箭头表示不同原子的电子转移情况(称为“单线桥法”)。1、双线桥法(1)两条箭头都是由反应物指向生成物,且对准相应的元素(2)在桥线上标明“失去”或“得到”电子的数目(用n×me-表示),且总数相等(3)箭头不代表电子转移的方向2、用箭头表示不同原子的电子转移情况——“单线桥”。如: 更好地体现了氧化剂和还原剂在反应中的电子转移的关系。再如: 练一练:用单线桥表示电子转移情况
5NH4NO3= 4N2+2HNO3+9H2OMnO2 + 4HCl(浓)==MnCl2+Cl2 +2H2O 2e-NH4NO3 == 2H2O + N2O2、单线桥分析氧化还原反应可简单表示为 ①箭头线由还原剂指向氧化剂
②在单线桥上,只表明电子转移的总数目,不写“得”或“失”
③箭头表示电子转移的方向标电子转移的方向和数目: ① 单线桥法 : 如:KClO3 + 6HCl = KCl + 3Cl2 ↑+ 3H2O5e-② 双线桥法: 失5e-得5×e-[练习] 写出下列反应的化学方程式,并用双线桥或单线
桥法标出电子转移方向和数目。(1)铜跟浓硝酸反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O2e-(2)硫化氢气体通入浓硫酸中: H2S + H2SO4 (浓) = S↓+ SO2 ↑+ 2H2O2e-(3)红热炭投入热的浓硝酸溶液中: 4e-例1.标出反应的电子转移方向和数目,
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
该反应中氧化剂为______,还原剂为________,1mol CuSO4能氧化P原子的物质的量是________ 。1molP能氧化 molP。 失30e-得15e-得15e-P、CuSO4P0.2mol0.6mol例2.氢阴离子(H-)能和NH3反应:
H-+NH3= NH2- +H2↑。根据上述反应事
实可以得到的正确结论是( ) A.NH3具有还原性 B.H-是很强的还原剂 C. H2只是该反应的还原产物 D.该反应属于置换反应 B 例3、需要加入氧化剂才能实现的变化是( )
A.MnO2→MnSO4 B.AlO2-→Al(OH)3 C.KI→KIO3 D.HNO3→NOC三、常用的氧化剂和还原剂2、常用的还原剂(1)部分低价化合物或酸根离子,如H2S、I—、S2— 等;
(2)某些活泼金属单质,如Na、Mg、Al、Fe 等;
(3)某些非金属单质,如 H2、C 等。
(4)元素处于低化合价时的氧化物,如CO、SO2等。(1)部分氧化物和过氧化物,如 MnO2 、Na2O2等;
(2)某些高价含氧酸及含氧酸盐,如 KMnO4、KClO3 、K2Cr2O7 、HNO3、浓H2SO4 等;
(3)某些活泼非金属单质,如F2、Cl2、Br2、I2、O2 等;
(4)某些高价金属离子,如Fe3+、Cu2+ 等。1、常见的氧化剂(1)重要的氧化剂:① 活泼的非金属单质:O2、Cl2、Br2、I2、O3、S等 ② 元素处于高化合价时的氧化物:MnO2 ③ 元素处于高化合价时的含氧酸: HNO3、浓H2SO4、 ④ 元素处于高化合价时的盐:KMnO4、KClO3、
K2Cr2O7、 FeCl3 等 ⑤过氧化物:H2O2、Na2O2⑥高价金属阳离子:Cu2+、Fe3+ Hg2+或H+⑦其他:HClO、漂白粉、NO2、NaHSO4、银氨溶液、新制氢氧化铜(2)重要的还原剂: ① 活泼的金属单质: K、Na、Mg、Al、Zn、Fe等 ② 某些非金属单质:焦炭、H2 、Si等 ③ 元素处于低化合价时的氧化物:如CO、SO2等 ④ 元素处于低化合价时的酸:如HCl、H2S、H2SO3等 ⑤ 元素处于低化合价时的盐:Na2SO3 、FeSO4等 ⑥非金属阴离子:S2-、I-等;
低价金属阳离子: Cu+、Fe2+ [练习] 1、在下列各微粒组中,各种微粒都只有还原性的是( )。
A.H2S(气)、Fe 、S2- B.Na、I-、NO3-
C.Fe2+、SO2、H2O D.S、HSO3-、H2SO3A2、在下列各物质组中,全部都是常见的氧化剂
的是 ( )。
A.HNO3、浓H2SO4 、KMnO4、H3PO4
B. H2O2、O3、Cl2 、 Br2
C.AlCl3、FeCl3 、CuCl2 、O2
D. CH3CHO、HCl、SO2 、COB3、在下列各物质中,因具有强氧化性可作消毒剂的是( )。
A.NaClO溶液 B.苯酚溶液
C.3%双氧水 D.75%酒精溶液 AC三、与其它反应类型间的关系 置换反应 电极反应 化合反应 分解反应氧化还原反应 有机反应 复分解反应?√√??×判断1 、有单质参加的化合反应都是氧化还原反应。2 、有单质生成的分解反应都是氧化还原反应。3 、有单质生成的反应都是氧化还原反应。4 、有单质参加的反应都是氧化还原反应。5 、有机反应都不是氧化还原反应。6 、除同素异形体之间的转化外,有单质参加的 反应都是氧化还原反应。7 、除同素异形体之间的转化外,有单质生成 的反应都是氧化还原反应。√√√√×××1、根据金属活泼性判断金属性越强,单质的还原性越强,其对应离子的氧化性越弱2、根据非金属的活泼性判断非金属性越强,单质的氧化性越强,其对应离子的还原性越弱如:氧化性:F2> Cl2> Br2>I2 >S
还原性:S2- >I- >Br- >Cl- >F-四、氧化性和还原性强弱比较四、氧化性和还原性强弱比较3.根据化学反应判断 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 记忆:“左>右” 4.根据反应条件判断 当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件的难易来进行判断。越易反应,则氧化剂的氧化性越强。如: 4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑ 16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑ 则氧化性:KMnO4>MnO2 判断还原剂还原性的原理类似。 5.由氧化产物的价态高低来判断当同一还原剂在相似的条件下作用于不同的氧化剂时,可由氧化产物元素价态的高低来判断氧化剂氧化性的强弱。即:在相同条件下,使还原剂价态升得越高,则氧化剂的氧化性越强。如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2>S 判断还原剂还原性的原理类似。[注意]
?(1)?? 并非还原产物中元素化合价越低,氧化剂的氧化性就越强。如反应
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(生成物中N的化合价为+2)
Cu+4HNO3(浓) = Cu(NO3)2+NO2↑+2H2O
(生成物中N的化合价为+4)
但HNO3(浓)的氧化性强于HNO3(稀)。
?(2)一般来说,同一种元素的化合价越高,则相应的物质或微粒的氧化性越强,如Fe3+氧化性比Fe2+强。但是,HClO氧化性强于HClO4,H2SO3(稀)氧化性强于H2SO4(稀)。 (2)同周期元素(从左到右):原子或单质还原性逐渐减弱,氧化性逐渐增强。阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱。 6.根据元素周期表判断(1)同主族元素(从上到下):非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强;金属原子(或单质)还原性逐渐增强,对应阳离子氧化性逐渐减弱。 金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱 (2)电解池:
阳极:易失去电子的先放电(还原性)
S2->I->Br->Cl->OH-
阴极:易得电子的先放电(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+7、根据电化学原理(1)原电池
负极比正极活泼,易失去电子
还原性:负极>正极(2)元素的非金属性越强,相应单质的氧化性越强,相应阴离子的还原性越弱。
如非金属性:F>O>Cl> Br > I > S
氧化性:F2>O2>Cl2 > Br2 > I2 > S
还原性:F-
①2FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。
下列试剂中,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl C例3、根据下列三个反应的化学方程式,下列关系式正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3
A、氧化性:Fe3+>Cl2>H2SO4>I2
B、还原性:SO2>I->Fe2+>Cl-
C、2Fe+3I2 = 2FeI3
D、FeI2+Cl2=FeCl2+I2B例4、在一定条件下,氯酸钾与碘按下式反应:2KClO3+I2=2KIO3+Cl2,由此可推断下列相应的结论,不能推出的是( )
A、该反应属于置换反应
B、还原性:I2>Cl2
C、非金属性:I>Cl
D.氧化性:KClO3>Cl2CD五、氧化还原反应的基本规律2.价态规律3.邻位变化规律4.强弱规律5.优先规律1.遵循三大守恒原则1.遵循三大守恒原则(1)得失电子守恒: 氧化剂得电子总数=还原剂失电子总数。
(2)原子守恒: 某元素的原子的种类及个数在反应前后保持不变。
(3)电荷守恒: 离子反应中,反应前后离子所带总电荷相等
(4)质量守恒: 例题:
下面的离子方程式 : xR2++yH++O2 →mR3++nH2O, 下列R3+、R2+和化学计量数m、n的判断错误的是( )
(A)m=4,R3+是氧化产物 (B)m=y,R2+显还原性 (C)x=3,R3+是氧化产物 (D)x=y,R2+显还原性C2、价态规律(1)当元素具有可变化合价时,一般处于最高价态时只具有氧化性,处于最低价态时只具有还原性,处于中间价态时既具有氧化性又具有还原性。如:浓硫酸的S只具有氧化性,H2S中的S只具有还原性,单质S具有氧化性又具有还原性。高价氧,低价还;中间价,两边转。(2)价态归中规律:
不同价态的同种元素之间发生氧化还原反应时遵循“高价+低价→中间价”的规律;而不会出现价态交错现象 如:S+2H2SO4(浓)→3SO2↑+2H2O 6HCl+KClO3→3Cl2↑+KCl+3H2O“只靠拢,不交叉”(3)歧化反应规律(歧化律)发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应,叫做歧化反应。反应规律:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价 +低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。如:Cl2+2NaOH=NaCl+NaClO+H2O不同价态的同种元素之间发生氧化还原反应时(不会在相邻价态间进行),向邻价位转化。浓H2SO4与SO2会反应吗?3.邻位变化规律: 4.强弱的规律:如:2Fe3++2I-→2Fe2++I2
氧化性:Fe3+>I2 还原性:I->Fe2+ 强氧化剂+强还原剂→弱还原剂(还原产物)+
弱氧化剂(氧化产物)
(1)氧化剂 →还原产物, 还原剂→氧化产物;
(2)氧化性:氧化剂>氧化产物, (3)还原性:还原剂>还原产物。左>右 例题:
已知:①2Fe3++2I-→2Fe2++I2 ②2Fe2++Br2 →2Fe3++2Br-。 则离子的还原性从强到弱的顺序正确的是( )
(A)Br->Fe2+>I- (B)I->Fe2+>Br- (C)Br->I->Fe2+ (D)Fe2+>I->Br- B例1、(04全国理综10)已知常温下在溶液中可发生如下的两个反应: Ce4++Fe2+= Ce3++Fe3+ Sn2++2Fe3+= Sn4++2Fe2+ 由此可以确定Fe2+ 、 Ce3+ 、 Sn2+三种离子还原性由强到弱的顺序为( )
A. Sn2+ Fe2+ Ce3+ 、 B. Sn2+ Ce3+ Fe2+
C. Ce3+ Fe2+ Sn2+ 、D. Fe2+ Sn2+ Ce3+ A例2、已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2> Z2> X2 >Y2,下列氧化还原反应能发生的是 ( ) A. 2W- + Z2 = 2Z- + W2
B. 2X- + Z2 = 2Z- + X2 C. 2Y- + W2 = 2W- + Y2
D. 2Z- + X2 = 2X- + Z2 BC 当一种氧化剂同时氧化几种还原剂时,
首先氧化最强的还原剂,待最强还原剂完全
氧化后,多余的氧化剂再依次氧化次强还
原剂;当然一种还原剂同时还原几种氧化
剂时,也是如此。 如:将金属Zn投入含Cu2+、Fe2+和Mg2+的
溶液中,因氧化性Cu2+>Fe2+>Zn2 + > Mg2+
,故首先置换出Cu,待Cu被完全置换出来后,
再置换出Fe,但不能置换出Mg。 5. 优先规律:谁强谁优先 例题:
向100mL1mol/L的FeBr2溶液中通入
标准状况下的Cl2,当通入Cl2的体积分别
为(1)1.12L,(2)2.24L,(3)4.48L时,
写出反应的离子方程式。 离子方程式分别为:
(1)2Fe2++Cl2=2Fe3++2Cl-
(2)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
(3)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-氧化还原统一体电子得失必相等两强反应变两弱强弱两极相背离歧化高低分上下高氧低还中两性归中价态不交叉强度 CT 成正比价态相邻不反应先强后弱要牢记升失氧化还原剂降得还原氧化剂氧化还原反应记忆歌诀例2:某金属与稀硝酸均恰好完全反应生成NO,消耗金属和HNO3的物质的量之比为1:3,则该金属可能是( )
(A)Cu (B)Ag (C)Fe (D)AlC例3:2.24(g)铁粉与50mL稀硝酸恰好完全反应(硝酸的还原产物是NO),向反应后的溶液中加入50mL0.2mol/L的KI溶液,I-恰好被完全氧化成单质碘,求硝酸的物质的量浓度。0.6mol/L 六、有关氧化还原反应的计算
利用电子守恒、电荷守恒、原子守恒原理计算,可使计算过程大大简化。 例1:24mL 0.05 mol/L 的Na 2 SO 3 溶液, 恰好与 20 mL0.02mol/L的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
(A) +6 (B) +3 (C) +2 (D) 0B例2、硫酸铵在强热条件下分解生成NH3、SO2、N2和水的反应中氧化产物和还原产物的物质的量之比是( )
??? A、2:3 B、4:3
C、1:1 D、1:3D练习1、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,则HNO3的还原产物可能是( )?
A、NH4NO3 B、N2O
C、NO D、NO2A B练习2.在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑反应中,若有5mol水作还原剂时,则由水还原的BrF3的物质的量为多少? A.0.9 mol B.1 mol C.1.2 mol D.2.2 mol解:根据得失电子守恒,失电子总数=0.3 ×(2+8)=3 摩尔,故硝酸被还原成没有共 1 摩尔。例3.0.3 molCu2S 与足量的硝酸反应,生成硝酸铜,硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸物质的量为( )B分析:未被还原的硝酸以 Cu(NO3)2 形式存在,共有 0.6 molCu ,故未被还原的硝酸有 0.6 × 2=1.2 mol那么,未被还原的硝酸物质的量呢?例 4( 2003 年高考题)在一定的条件下, PbO2 与 Cr3+反应,产物是 Cr2O72-和 Pb2+,则与 1 molCr3+反应所需 PbO2 的物质量为( )
A. 3.0 mol B.1.5 mol
C.1.0mol D.0.75 mol
〖分析〗据题意, PbO2 与 Cr3 +反应, PbO2 作氧化剂, Cr3 +作还原剂
根据氧化还原反应中电子守恒有,1mol×3 =n(PbO2) × 2
n(PbO2)=1.5 mol B例5、(00 年高考题)硫代硫酸钠可作为脱氯剂,已知 25.0 ml0.100mol.L-1 Na2S2O3 溶液恰好把 224 ml (标准状况下) Cl2 完全转化为 Cl-,则 S2O32 -将转化为( )
A.S2 - B .S C. SO32 - D.SO42 -〖分析〗据题意, Cl2 与 S2O32 -反应, Cl2 作氧化剂, S2O32 -作还原剂,设反应后 S 最终价态为 X,
有:
0.224/22.4 × 2=0.100 × 0.0250 ×(X - 2) × 2
解得: X=6
D例6、在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )mol/L
A. a/b B.2a/b C. 3a/b D. 5a/b
〖分析〗 Fe2+, Br-都具有还原性,由 2FeBr2+Br2=2 FeBr3 可以判断出: Fe2+还原性强于Br-因此向 FeBr2 溶液中通入 Cl2 时,氯气先与 Fe2+反应,当 Fe2+全部被氧化为 Fe3+时,再与 Br-反应。A(07全国理综1)10、已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到电子
A、10mol B、11mol C、12mol D、13mol
(07全国理综1)11、等物质的量的下列化合物在相应条件下完全分解后,得到的O2最多的是
A、KClO3(加MnO2催化剂,加热)
B、KMnO4(加热)
C、H2O2(水溶液,加MnO2催化剂)
D、HgO(加热)BA(07全国II)11.在氧化还原反应中,水作为氧化剂的是
A.C+ H2O = CO2+ H2
B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2A(2007年高考理综宁夏卷)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为( )
(A)1:7 (B)7:1
(C)7:8 (D)8:7B26.(2007年高考理综重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为___________________________________。2Fe3++H2S=S↓+2Fe2++2H+(07四川)10.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL A七、氧化还原反应配平1.配平总原则:反应中化合价升降总数相等及反应前后原子种类及个数相等。
2.配平一般步骤:标好价,算变化,总相等,配其它。
3.配平策略:先用观察法,不行再用氧化还原法,同时注意观察。
如: K2MnF6+ SbF5= KSbF6+ MnF3+ F2 (1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平 。
Pt + HNO3+ HCl —H2PtCl6 + NO + H2O
(2)自变从右边配:自身氧化—还原反应(包括分解、歧化)(部分氧化还原)
一般从右边着手配平
例如:Cl2 + KOH —KCl + KClO3 + H2O
(NH4)2PtCl6 —Pt + NH4Cl + HCl + N2
Cu(NO3)2—CuO + NO2 + O2
4. 配平基本技能:
同课章节目录
