盐类的水解(吉林省延边朝鲜族自治州敦化市)
文档属性
| 名称 | 盐类的水解(吉林省延边朝鲜族自治州敦化市) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-08-23 00:00:00 | ||
图片预览






文档简介
课件16张PPT。盐类的水解
( 第一课时)
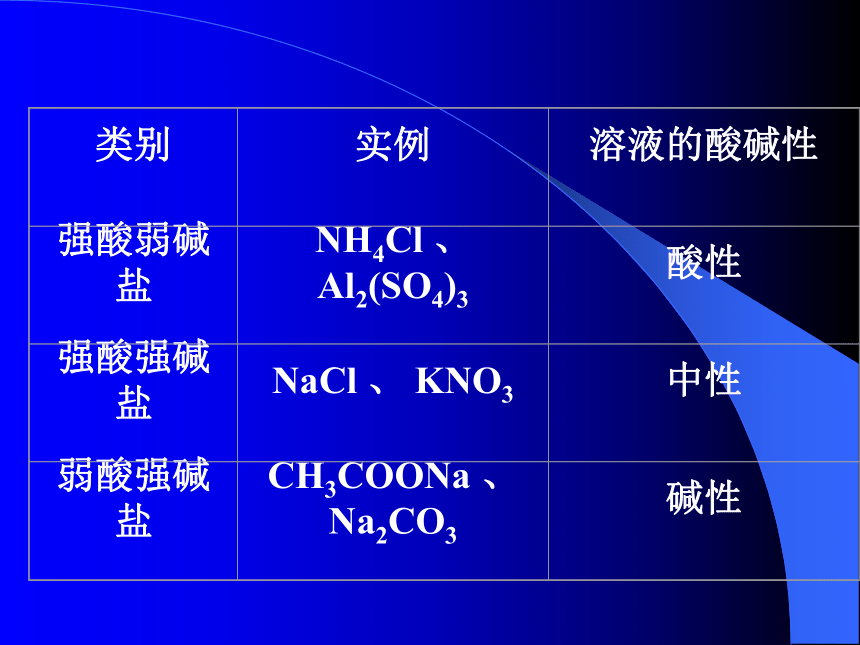
?思考:初中化学中,大家已认识了酸、碱、盐的性质,酸溶液呈酸性,碱溶液呈碱性,那么下列盐溶液呈酸性?碱性?还是中性?
CH3COONa Na2CO3 NH4Cl
Al2(SO4)3 NaCl KNO3?思考:为什么盐溶液可呈中性、酸性或碱性? 溶液中存在水的电离平衡,纯水呈中性:C(H+)=C(OH-),而正盐本身不会电离出氢离子或氢氧根离子,只能是盐电离产生的某些离子与水电离出的氢离子或氢氧根离子结合,使溶液中的C(H+)≠C(OH-),而使溶液呈酸碱性。说明盐类与水发生了复分解反应,这就是我们今天要学习的内容。 一 `盐类的水解定义:在溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。实质:
破坏了水的电离平衡,促进了水的电离
二` 盐类水解的主要类型
⒈弱酸强碱盐的水解
⒉强酸弱碱盐的水解
⒊强酸强碱盐的水解
⒋弱酸弱碱盐的水解⒈弱酸强碱盐的水解规律:①强碱弱酸盐分步水解,以第一步水解为主;
②强碱弱酸盐电离出的弱酸根离子与水电离出的H+结合,促进水的电离,使C(OH-)>C(H+),溶液呈碱性。 ⒉强酸弱碱盐的水解
水解方程式:规律:①强碱弱酸盐分步水解,以第一步水解为主;
②强碱弱酸盐电离出的弱酸根离子与水电离出的H+结合,促进水的电离,使C(OH-)>C(H+),溶液呈碱性。
⒊强酸强碱盐不水解
规律:强酸强碱盐电离出的离子不与水电离的H+或OH-结合生成弱酸或弱碱,故不能破坏水的电离平衡,C(OH-)=C(H+),溶液呈中性。 ⒋弱酸弱碱盐的水解
规律:①弱酸弱碱盐电离出的阴阳离子分别与水电离的H+或OH-结合生成弱酸或弱碱,更加促进水的电离,使水解程度较前二者大。
②该盐溶液的酸碱性取决于水解生成的酸或碱的电离程度。 思考:1、盐类水解有何特点、规律?
2、水解方程式的书写应注意哪些地方?
三`盐类水解的规律:
无弱不水解,谁弱谁水解,都强不水解,都弱都水解,谁强显谁性,都强显中性,都弱具体定 四、盐类水解的特点:是中和反应的逆反应,是吸热反应,水解程度一般很小。五、水解方程式的书写:
⑴应用可逆号 ⑵不标沉淀号、气体号 ⑶多元弱酸盐分步水解且分步书写方程式
⑷多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
练习判断下列盐溶液的酸碱性,并写出水解反应的离子方程式:
KF NH4NO3 Na2SO4 CuSO4答案++再见
( 第一课时)
?思考:初中化学中,大家已认识了酸、碱、盐的性质,酸溶液呈酸性,碱溶液呈碱性,那么下列盐溶液呈酸性?碱性?还是中性?
CH3COONa Na2CO3 NH4Cl
Al2(SO4)3 NaCl KNO3?思考:为什么盐溶液可呈中性、酸性或碱性? 溶液中存在水的电离平衡,纯水呈中性:C(H+)=C(OH-),而正盐本身不会电离出氢离子或氢氧根离子,只能是盐电离产生的某些离子与水电离出的氢离子或氢氧根离子结合,使溶液中的C(H+)≠C(OH-),而使溶液呈酸碱性。说明盐类与水发生了复分解反应,这就是我们今天要学习的内容。 一 `盐类的水解定义:在溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。实质:
破坏了水的电离平衡,促进了水的电离
二` 盐类水解的主要类型
⒈弱酸强碱盐的水解
⒉强酸弱碱盐的水解
⒊强酸强碱盐的水解
⒋弱酸弱碱盐的水解⒈弱酸强碱盐的水解规律:①强碱弱酸盐分步水解,以第一步水解为主;
②强碱弱酸盐电离出的弱酸根离子与水电离出的H+结合,促进水的电离,使C(OH-)>C(H+),溶液呈碱性。 ⒉强酸弱碱盐的水解
水解方程式:规律:①强碱弱酸盐分步水解,以第一步水解为主;
②强碱弱酸盐电离出的弱酸根离子与水电离出的H+结合,促进水的电离,使C(OH-)>C(H+),溶液呈碱性。
⒊强酸强碱盐不水解
规律:强酸强碱盐电离出的离子不与水电离的H+或OH-结合生成弱酸或弱碱,故不能破坏水的电离平衡,C(OH-)=C(H+),溶液呈中性。 ⒋弱酸弱碱盐的水解
规律:①弱酸弱碱盐电离出的阴阳离子分别与水电离的H+或OH-结合生成弱酸或弱碱,更加促进水的电离,使水解程度较前二者大。
②该盐溶液的酸碱性取决于水解生成的酸或碱的电离程度。 思考:1、盐类水解有何特点、规律?
2、水解方程式的书写应注意哪些地方?
三`盐类水解的规律:
无弱不水解,谁弱谁水解,都强不水解,都弱都水解,谁强显谁性,都强显中性,都弱具体定 四、盐类水解的特点:是中和反应的逆反应,是吸热反应,水解程度一般很小。五、水解方程式的书写:
⑴应用可逆号 ⑵不标沉淀号、气体号 ⑶多元弱酸盐分步水解且分步书写方程式
⑷多元弱碱盐分步水解但不分步书写方程式,一步书写到位。
练习判断下列盐溶液的酸碱性,并写出水解反应的离子方程式:
KF NH4NO3 Na2SO4 CuSO4答案++再见
