盐类的水解
图片预览




文档简介
课件17张PPT。高中化学第二册
第三章第三节盐类的水解 〖试一试〗用pH试纸检验下列溶液
显酸性、碱性、中性?
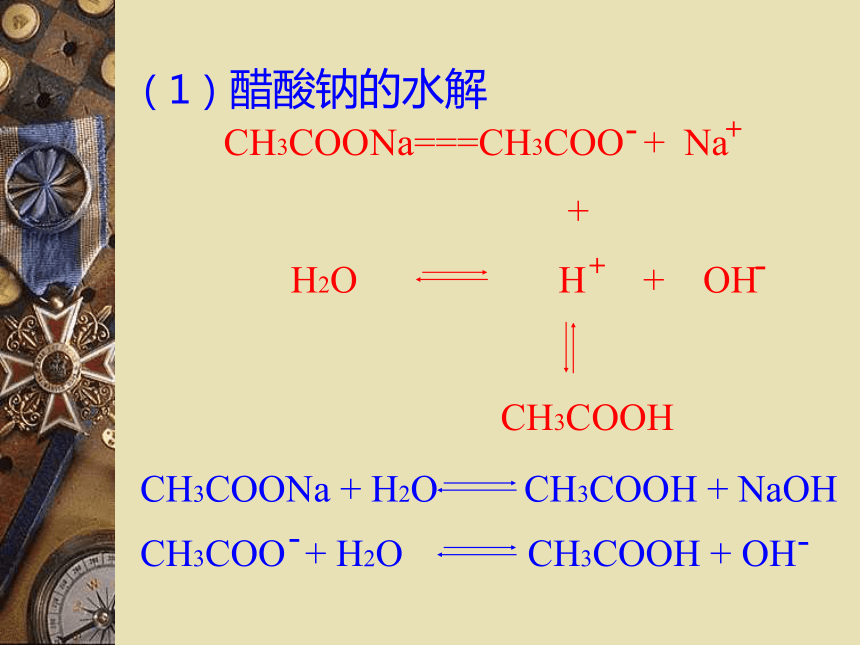
(1)CH3COONa
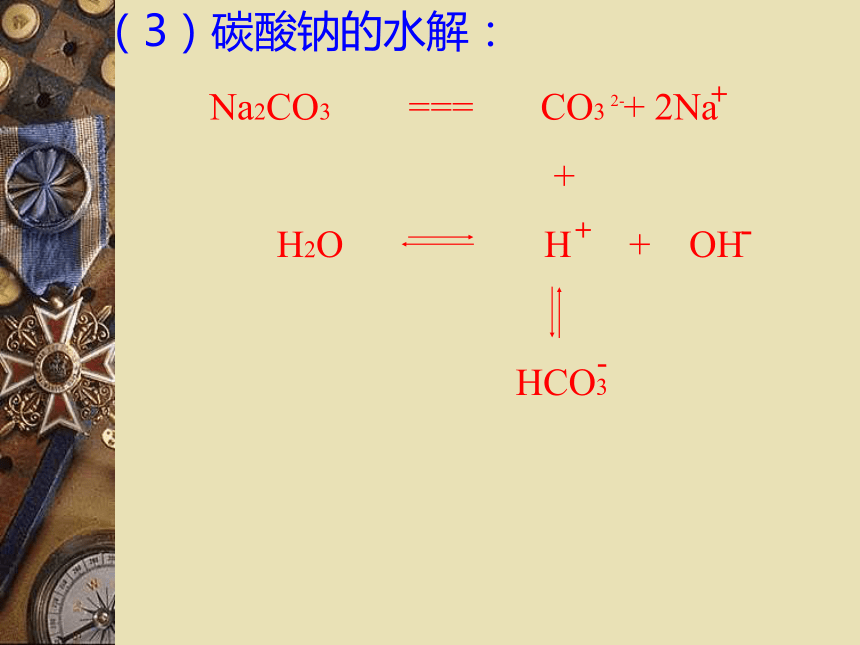
(2)Na2CO3
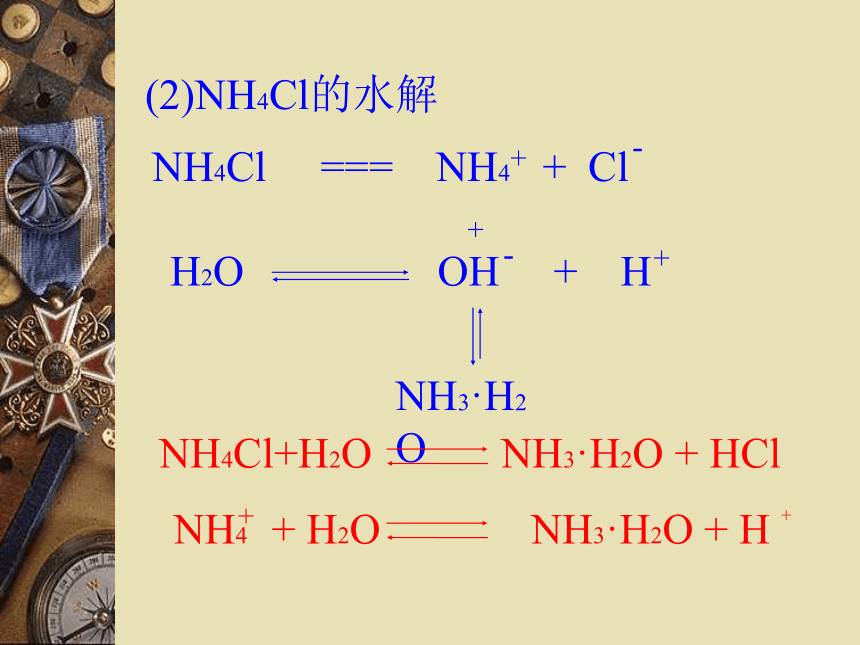
(3)NH4Cl
(4)Al2(SO4)3
(5)NaCl
(6)KNO3
·强碱弱酸所生成的盐的水溶液呈碱性·强酸弱碱所生成的盐的水溶液呈酸性·强酸强碱所生成的盐的水溶液呈中性讨论:盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系? 结论:
CH3COONa 、 Na2CO3 的溶液显碱性
NH4Cl、 Al2(SO4)3 的溶液显酸性
NaCl 、KNO3 的溶液显中性(1)醋酸钠的水解(2)NH4Cl的水解盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐类的水解。(3)碳酸钠的水解:2-第一步:第二步:※碳酸钠水解化学方程式和离子方程式(4)Al2(SO4)3的水解盐类的水解:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐类的水解。弱酸弱碱盐水解复杂,不讨论强酸强碱盐不水解水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:酸+碱 盐+水中和水解对概念的理解(促进水的电离)◎盐类水解的规律:
※谁弱谁水解,
※谁强显谁性,
※都强不水解。
写出下列盐的水解方程式及离子方程式课堂练习课堂练习:1. 下列溶液PH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl-、 NH4+ 、 OH- 、H +
这节课在感性认识的基础上,进行理性思考,逻辑推理,科学抽象,形成“盐类的水解”概念,在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”,并应用规律解决了一些具体问题,盐类水解更深入的应用,下节课再探讨。
课堂小结:再见
第三章第三节盐类的水解 〖试一试〗用pH试纸检验下列溶液
显酸性、碱性、中性?
(1)CH3COONa
(2)Na2CO3
(3)NH4Cl
(4)Al2(SO4)3
(5)NaCl
(6)KNO3
·强碱弱酸所生成的盐的水溶液呈碱性·强酸弱碱所生成的盐的水溶液呈酸性·强酸强碱所生成的盐的水溶液呈中性讨论:盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系? 结论:
CH3COONa 、 Na2CO3 的溶液显碱性
NH4Cl、 Al2(SO4)3 的溶液显酸性
NaCl 、KNO3 的溶液显中性(1)醋酸钠的水解(2)NH4Cl的水解盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐类的水解。(3)碳酸钠的水解:2-第一步:第二步:※碳酸钠水解化学方程式和离子方程式(4)Al2(SO4)3的水解盐类的水解:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐类的水解。弱酸弱碱盐水解复杂,不讨论强酸强碱盐不水解水解的条件:生成弱电解质。水解的实质:破坏了水的电离平衡。水解反应与中和反应的关系:酸+碱 盐+水中和水解对概念的理解(促进水的电离)◎盐类水解的规律:
※谁弱谁水解,
※谁强显谁性,
※都强不水解。
写出下列盐的水解方程式及离子方程式课堂练习课堂练习:1. 下列溶液PH小于7的是A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡2. 下列溶液能使酚酞指示剂显红色的是A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁3.下列离子在水溶液中不会发生水解的是A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4.? 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl-、 NH4+ 、 OH- 、H +
这节课在感性认识的基础上,进行理性思考,逻辑推理,科学抽象,形成“盐类的水解”概念,在挖掘概念内涵的基础上,总结归纳出“盐类的水解规律”,并应用规律解决了一些具体问题,盐类水解更深入的应用,下节课再探讨。
课堂小结:再见
