化学实验基本方法(2)
图片预览






文档简介
课件16张PPT。第一单元 化学实验基本方法(2)我们从实验推开高中化学的大门宝泉岭高级中学 范志华[与你一起交流]利用沙和金不同的
比重进行分离你知道沙里淘金吗?你还知道如何把砂子和铁粉分离吗?二、混合物的分离和提纯[分析思考]分离和提纯有什么不同,分离出的杂质都是有害和无用的吗,请举例说明? 分离是通过适当的方法,把混合物中的几种物质分开,分别得到原状态的纯净物.分离的对象中不分主体物质和杂质(如石油分离) 提纯是通过适当的方法把混合物中的少量杂质除去,以得到纯净物质.提纯的对象中分主体物质和杂质(制蒸馏水)2、物质分离和提纯的一般方法物理法:
化学法:如过滤、蒸发结晶、蒸馏或分馏、萃取、分液、升华等。如沉淀法、吸收法、转化法、离子交换法。从液体中分离出不溶的固体物质获得溶液中的溶质(分离溶剂和溶质)一贴、二低、
三靠玻璃棒要不停的搅拌,防止局部沸腾;先小火后大火 ,出现较多固体时停止加热(一)、过 滤 和 蒸 发1、请设计粗盐提纯的方法粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]
实验方案:(在教师引导下由学生逐步设计实验)
各步目的: 溶解 —过滤 — 蒸发、结晶(将不溶性
杂质除去)(重新得到
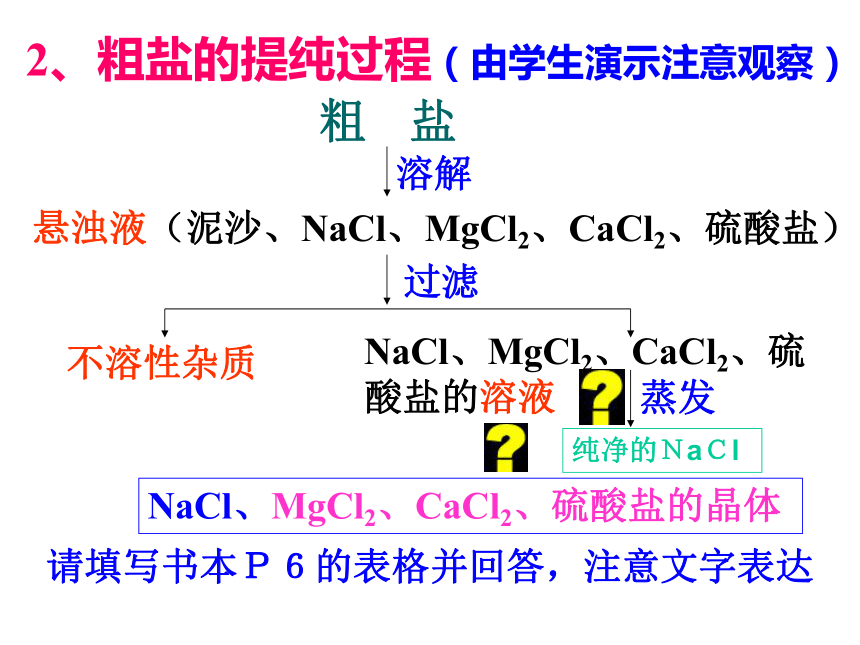
NaCl晶体)实验1-1:阅读教材P5最后一段2、粗盐的提纯过程(由学生演示注意观察)粗 盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体纯净的NaCl请填写书本P6的表格并回答,注意文字表达(二)、物质的检验1、原理:
根据物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体、沉淀等的特殊现象)
2、注意:
(1)选择合理的试剂(操作简单、反应灵敏、现象明显的试剂)
(2)不能在待测物质中直接加入试剂;固体一般先配成溶液。
(3)操作时应注意某些共有现象的干扰。▲Cl-的检验方法 先加入稀HNO3酸化,再加入AgNO3溶液,如果出现不溶于稀硝酸的白色沉淀,则存在氯离子。表述时应说明:
选用什么试剂+出现什么现象+得出什么结论3、几各常见离子的检验:实验1-2: SO42-的检验方法P6 先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰练习如何除去NaCl中的可溶性杂质请参考书本P7的资料卡片填写该页的表格要除去可溶杂质离子是:选择要加入的除杂试剂:为了能完全除去杂质离子,加入的除杂试剂必须过量引入了新的离子:CO3 2-OH -Ba 2+如何除去新引入的杂质?请思考书本P7第二个问题原则加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl
讨论:加入除杂试剂的顺序:1、只要 Na2CO3 加在BaCl2之后便合理
2、最后加入的盐酸只能适量1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发3、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸
D一、实验报告册第一至第二页实验记录及实验习题一、4
二、预习第三部分内容,重点预习分液和萃取实验操作版权所有,翻版必究 二零零七年九月二日课堂练习:
课本第10页:2367[作业]再见练习1、检验Na2CO3中是否含有Na2SO4
应排除CO32-干扰——先酸化
HCl 和BaCl2 或 HNO3和BaCl2
2、检验Na2SO3中是否含有SO42-
排除SO32-的干扰——先酸化,但要避
免引入HNO3 BaCl2和HCl
3 、检验一未知溶液中是否含有SO42-
考虑CO32-、Ag+、SO32-的干扰
最佳方法 — 先加HCl 酸化,无沉淀再加BaCl2
比重进行分离你知道沙里淘金吗?你还知道如何把砂子和铁粉分离吗?二、混合物的分离和提纯[分析思考]分离和提纯有什么不同,分离出的杂质都是有害和无用的吗,请举例说明? 分离是通过适当的方法,把混合物中的几种物质分开,分别得到原状态的纯净物.分离的对象中不分主体物质和杂质(如石油分离) 提纯是通过适当的方法把混合物中的少量杂质除去,以得到纯净物质.提纯的对象中分主体物质和杂质(制蒸馏水)2、物质分离和提纯的一般方法物理法:
化学法:如过滤、蒸发结晶、蒸馏或分馏、萃取、分液、升华等。如沉淀法、吸收法、转化法、离子交换法。从液体中分离出不溶的固体物质获得溶液中的溶质(分离溶剂和溶质)一贴、二低、
三靠玻璃棒要不停的搅拌,防止局部沸腾;先小火后大火 ,出现较多固体时停止加热(一)、过 滤 和 蒸 发1、请设计粗盐提纯的方法粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]
实验方案:(在教师引导下由学生逐步设计实验)
各步目的: 溶解 —过滤 — 蒸发、结晶(将不溶性
杂质除去)(重新得到
NaCl晶体)实验1-1:阅读教材P5最后一段2、粗盐的提纯过程(由学生演示注意观察)粗 盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体纯净的NaCl请填写书本P6的表格并回答,注意文字表达(二)、物质的检验1、原理:
根据物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体、沉淀等的特殊现象)
2、注意:
(1)选择合理的试剂(操作简单、反应灵敏、现象明显的试剂)
(2)不能在待测物质中直接加入试剂;固体一般先配成溶液。
(3)操作时应注意某些共有现象的干扰。▲Cl-的检验方法 先加入稀HNO3酸化,再加入AgNO3溶液,如果出现不溶于稀硝酸的白色沉淀,则存在氯离子。表述时应说明:
选用什么试剂+出现什么现象+得出什么结论3、几各常见离子的检验:实验1-2: SO42-的检验方法P6 先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰练习如何除去NaCl中的可溶性杂质请参考书本P7的资料卡片填写该页的表格要除去可溶杂质离子是:选择要加入的除杂试剂:为了能完全除去杂质离子,加入的除杂试剂必须过量引入了新的离子:CO3 2-OH -Ba 2+如何除去新引入的杂质?请思考书本P7第二个问题原则加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl
讨论:加入除杂试剂的顺序:1、只要 Na2CO3 加在BaCl2之后便合理
2、最后加入的盐酸只能适量1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发3、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸
D一、实验报告册第一至第二页实验记录及实验习题一、4
二、预习第三部分内容,重点预习分液和萃取实验操作版权所有,翻版必究 二零零七年九月二日课堂练习:
课本第10页:2367[作业]再见练习1、检验Na2CO3中是否含有Na2SO4
应排除CO32-干扰——先酸化
HCl 和BaCl2 或 HNO3和BaCl2
2、检验Na2SO3中是否含有SO42-
排除SO32-的干扰——先酸化,但要避
免引入HNO3 BaCl2和HCl
3 、检验一未知溶液中是否含有SO42-
考虑CO32-、Ag+、SO32-的干扰
最佳方法 — 先加HCl 酸化,无沉淀再加BaCl2
