弱电解质的电离平衡(福建省龙岩市长汀县)
图片预览





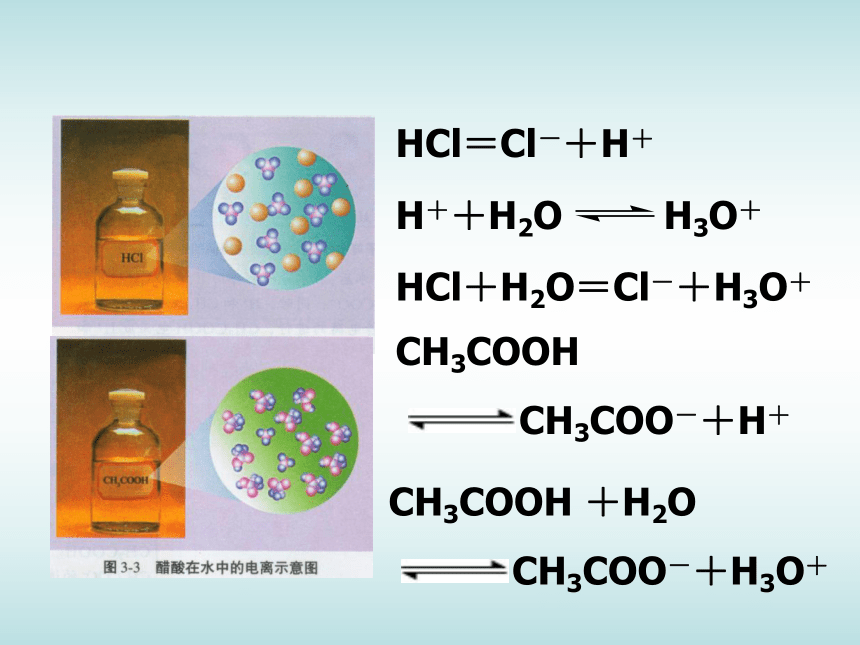





文档简介
课件46张PPT。第一单元 弱电解质的电离平衡一、学习目标
1.了解强、弱电解质在水溶液中电离程度的差异及原因,了解强、弱电解质与物质结构的关系,在化学平衡概念的基础上理解电离平衡概念。
2.了解酸碱电离理论,能运用电离平衡原理解释弱电解质在水溶液中的电离情况,会书写电离方程式。
3.知道水的离子积常数,知道电离平衡常数与弱酸、弱碱的酸碱性强弱之间的关系。
4.通过活动与探究,学习科学探究的一般方法,培养提出问题、探究问题和解决问题的能力。
5.通过强、弱电解质概念的学习,掌握学习概念性知识的常用方法:归纳法和演绎法。电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。在水溶液中和熔融状态时都不能导电的化合物。①NaCl溶液 ②NaOH ③H2SO4、
④Cu ⑤CH3COOH ⑥NH3·H2O、
⑦CO2 ⑧乙醇 ⑨水②③⑤⑥⑨⑦⑧一、强电解质和弱电解质
1、电解质和非电解质强调:①电解质和非电解质都是对化合物来说。
单质既不是电解质也不是非电解质②电解质本身不一定能导电 你能解释下列事实吗?部分电器外壳上有禁止触摸标记 2.电解水制H2、02时,需要向水中加入少量的Na0H溶液或H2SO4溶液。1.潮湿的手触摸正在工作的电器,可能会发生触电事故。手上的汗水中含有电解质,使水溶液具有较强的导电能力 纯水的导电能力太弱,加入NaOH或H2SO4可使溶液中离子浓度增大,导电能力增强。 1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?请说出你的理由。
2.你能设计实验验证你的猜想吗?请写出实验方案并与同学交流。
3.若按如下方案(或按你自己设计的方案)进行实验,请记录实验现象。
(1)测量物质的量浓度均为1mol·L-1的盐酸和醋酸的pH。
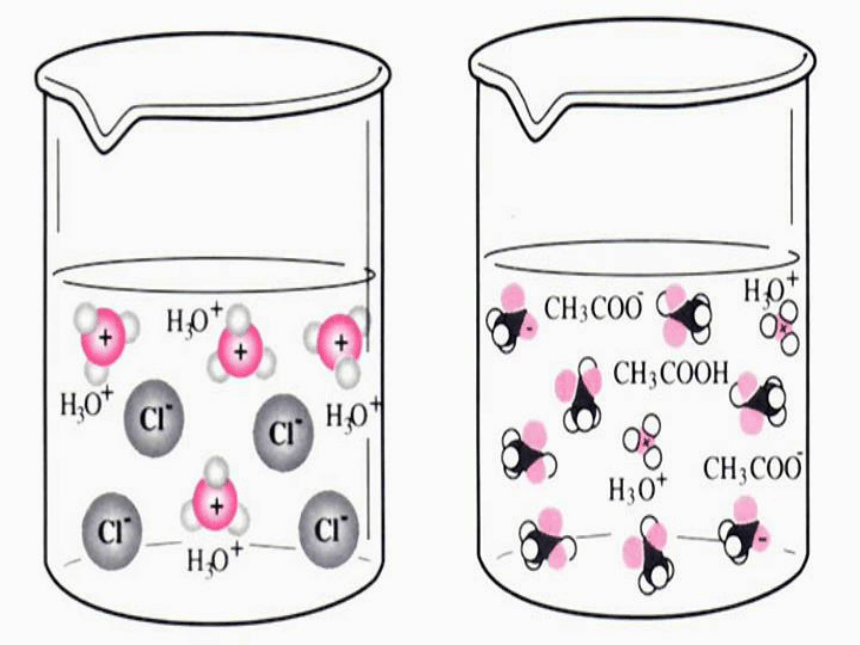
(2)如图3-1所示,在两只锥形瓶中分别加入等体积、物质的量浓度均为1mol·L-1 的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓起的快慢等现象,将实验现象和你对实验现象的解释填入表3-1。现象及解释: 金属于盐酸反应的本质是金属于酸电离出来的氢离子反应。同浓度同体积的盐酸和醋酸分别与金属镁反应,盐酸与镁的反应速率要明显大于醋酸与镁反应的速率,PH测定结果也是盐酸的PH小于醋酸的PH。这说明当两种酸的浓度相同时,盐酸电离出来的氢离子浓度要大于醋酸电离出的氢离子浓度,也就是说,盐酸的电离程度要高于醋酸。 HCl=Cl-+H+HCl+H2O=Cl-+H3O+CH3COOH
CH3COO-+H+CH3COOH +H2O
CH3COO-+H3O+H++H2O H3O+ 根据你的经验,你认为相同浓度的氢氧化钠溶液与氨水的电离程度有无差异?请提出你的假设并设计实验加以验证,完成表3-2。2、强电解质和弱电解质(1)强电解质:在水溶液中完全电离的电解质(2)弱电解质:在水溶液中部分电离的电解质 强 碱:强 酸:弱 酸:弱 碱:记住:HCl、H2SO4、HNO3、HClO4、HBr、HICH3COOH、H2CO3、H2SO3、H3PO4、HClO、HF、所有的有机羧酸NaOH、KOH、Ca(OH)2 、Ba(OH)2NH3·H2O 强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离. BaSO4、Fe(OH)3的溶解度都很小, BaSO4属于强电解质,而Fe(OH)3属于弱电解质; CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。电解质的强弱与 其溶解性有何关系?怎样区分强弱电解质?强调:
①强弱电解质≠溶液的导电能力
②强弱电解质≠物质的溶解性
③强酸(碱)弱酸(碱)≠溶液的酸碱性 用1 mol1·L-1醋酸进行导电性实验,发现灯泡亮度很低;用l mol1·L-1 氨水进行导电性实验,发现灯泡亮度同样很低;但若将两种溶液等体积混合后进行导电性实验,灯泡亮度却显著增加。请分析其中的原因。练习与实践 下列电解质中, ① NaCl、 ② NaOH,
③ NH3·H2O、 ④ CH3COOH, ⑤ BaSO4 、
⑥ AgCl 、 ⑦ Na2O 、 ⑧ K2O, ⑨ H2O
哪些是强电解质,那些是弱电解质?强电解质: ① ② ⑤ ⑥ ⑦ ⑧弱电解质:③ ④ ⑨练习与实践强、弱电解质的比较:回顾: 思考与讨论: 1)电离开始后,V(电离 )和 V(分子化)怎
样变化?二、弱电解质的电离平衡 2)当V(电离) = V(分子化)时,可逆过程达到
一种什么样的状态?画出V~t图。2.特征 1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动。 等 V电离=V分子化≠0逆 弱电解质的电离是可逆过程思考:NH3·H2O的电离方程式为:
NH3·H2O NH4++OH- △H>0
若在氨水中加入下表中的物质,氨的电离平衡及平衡时物质的浓度有何变化?请填写下表。 表3-3是实验测定的醋酸电离达到平衡时各种微粒的浓度(计算结果保留3位有效数字),请填写表中空白,将你的结论与同学交流讨论。0.9960.09871.82×10-51.82×10-50.421%1.34%3.弱电解质电离程度的表示:(1)电离平衡常数:①意义:在相同条件下,K值越大,弱电解质的电离程度越大,相应酸 (或碱)的酸(或碱)性越强。对于一元弱酸:HA H++A-,平衡时对于一元弱碱:MOH M++OH-,平衡时②影响电离平衡常数大小的因素:A.电离平衡常数大小是由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
B.与化学平衡常数一样,同一弱电解质的电离平衡常数只受温度影响,不受浓度影响。
C.化学平衡常数可以比较同一温度下不同弱电解质的电离程度,也可以比较不同温度下同一弱电解质的电离程度。但不能比较同一温度下不同浓度同一弱电解质的电离程度。 相同条件下
①酸性 HF>CH3COOH>HClO
②CH3COOH与NH3·H2O电离程度相同,溶液的
导电能力也相同弱电解质浓度越大,电离度越小。3.弱电解质电离程度的表示:(2)弱电解质的电离度( ):当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来电解质总分子数(包括已电离和未电离的)的百分数强调:①电离度的大小主要是由弱电解质本身性质决定。在同一条件下,电离度大的弱电解质的电离程度就越大。故电离度可以表示弱电解质的相对强弱。
②同一弱电解质的电离度既受温度影响,也受浓度影响。所以在使用电离度时必须指明温度和浓度,若不指明温度通常认为是25℃4.影响电离平衡的因素
(1)温度
电离过程是吸热过程,温度升高,平衡向电离方向移动。K与 均增大
(2)浓度
弱电解质浓度越大,电离程度越小。【练习】在某温度下,质量分数浓度为2%的某一元弱酸HA溶液的密度为1.02g/cm3。测知该溶液的C(H+)=1×10-2mol/L.若此一元弱酸的相对分子质量为60。求该溶液的物质的量浓度及弱酸HA的电离度和电离平衡常数。三、电离方程式的书写NaCl = Na++Cl-CH3COOH+H2O H3O++CH3COO- 强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸的电离 应分步完成电离方程式,多元弱碱则一步完成电离方程式。即CH3COOH H++CH3COO- 酸性:H3PO4>H2CO3>H2S多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……, 如何用平衡移动原理来解释?a、一级电离出H+后,剩下的酸根阴离子带负电
荷,增加了对H+的吸引力,使第二个H+离子
电离困难的多;
b、一级电离出的H+抑制了二级的电离。结论:多元弱酸的酸性由第一步电离决定。电离难的原因:练习:写出下列物质溶于水的电离方程式:磷酸、氢氧化铜、硫酸氢钠、磷酸二氢钠H3PO4 H2PO4- +H+
H2PO4- HPO42-+H+
HPO42- PO43-+H+Cu(OH)2 Cu2++2OH-NaHSO4=Na++H++SO42-NaH2PO4=Na+ + H2PO4-
H2PO4- HPO42- + H+
HPO42- PO43- + H+ 有机弱酸在生活中十分常见。许多水果之所以有酸味,主要是因为它们含有柠檬酸、抗坏血酸(维生素C)等有机弱酸;当你被蚂蚁等昆虫叮咬之后,会产生红疹,这主要是由于蚂蚁等昆虫的体液内含有甲酸(HCOOH,也叫蚁酸);当人经过剧烈运动后会感觉小腿发酸,这主要是由于人体在剧烈运动的过程中产生了乳酸;制造肥皂用的硬脂酸(C17H35C00H)是一种脂肪酸,脂肪酸可以用通式R—COOH表示。
胺类(R-NH2)是我们日常生活中常见的一类有机弱碱。许多相对分子质量较小的胺具有让人很不舒服的刺激性气味。胺类的性质和氨水相似,溶于水显弱碱性:有机弱酸和有机弱碱被蜜蜂或黄蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为蜜蜂分泌物中含有的是一种酸性物质,而黄蜂分泌物中含有的是一种碱性物质。请思考当被蜜蜂或黄蜂叮咬后应如何用家庭常用的物质加以处理。练习与实践例1:在小烧杯中加入一定量的冰醋酸,将连有电流计的导电装置插入其中。向小烧杯中逐渐加水稀释,发现随着水的加入,电流计指针偏转角度逐渐增大,到某一定值时又逐渐减小。试解释产生这种现象的原因。
练习:一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b例2:PH值相同等体积的两份溶液,A为盐酸B为醋酸分别和锌反应。若最后有一份溶液中有锌剩余且放出气体一样多,则正确的判断是
①反应所需时间B>A②开始时反应速率A>B③参加反应的锌的质量为B=A④整个反应阶段的平均反应速率B>A⑤盐酸中锌有剩余⑥醋酸中锌有剩余
A、③④⑤ B、①③⑥ C、②③⑥ D、②④⑤【练习】下列电离方程式书写正确的是
A、醋酸钠溶于水 CH3COONa Na++CH3COO-
B、亚硫酸溶于水 H2SO3 2H++SO32-
C、次氯酸溶于水 HClO+H2O H3O++ClO-
D、磷酸二氢钠溶于水 NaH2PO4=Na++2H++PO43-例3:甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中OH-的物质的量浓度之比_________(填大于、等于或小于)10。请说明理由。 【练习】把0.05 molNaOH固体分别加入到下列100mL液体中,溶液导电能力变化不大的是
A. 自来水 B. 0.5 mol/L盐酸
C. 0.5 mol/L醋酸 D. 0.5 mol/L氯化铵例4:用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA的溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分。)
(a)装HCl的试管中放出H2的速率快;
(b)装HA溶液的试管中入出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价乙方案中难以实现之处不妥善之处: 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
答: 。【练习】有四种一元酸甲、乙、丙、丁,其电离度与浓度、温度关系见下表,则相同条件下他们水溶液的酸性由强到弱的顺序是_____________________【例5】、已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
⑴25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同)
⑵25℃时,C(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是
⑶25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是 增大增大增大减小减小增大增大增大增大增大增大增大减小减小减小减小减小减小减小减小增大增大增大增大例6:(1)Ba(OH)2溶液中滴入H2SO4溶液至过量 (2)醋酸溶液中滴入氨水至过量(3)澄清石灰水中通入CO2至过量 (4)NH4Cl溶液中逐渐加入适量的NaOH固体
下列图像是在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是 ;与B图变化趋势一致的是 ;与C图变化趋势一致是的 。【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入甲溶液,电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3 B.CH3COOH、NH3·H2O C.NaOH、AlCl3 D.H2SO4、Ba(OH)2 练习
1.1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率______________________,
最终收集到的氢气的物质的量____________________。
2.pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率 _____________________,
最终收集到的氢气的物质的量 ____________________。硫酸>盐酸>醋酸硫酸>盐酸=醋酸三者相等醋酸>硫酸=盐酸3.一定量的盐酸跟过量的铁粉反应时,为减缓反应速率而不影响生成氢气的总量,可向盐酸中加入适量的 ( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固) BD4、氯气溶于水的反应是一个可逆反应。
(1)请写出氯气与水反应的化学方程式,并据此推断氯水中含有哪些物质(用化学式表示)。
(2)氯水中哪些物质能发生电离,请写出电离方程式,并据此分析氯水中存在的微粒。
(3)若将氯水置于光照条件下,氯水中的化学平衡如何移动?各种微粒的浓度如何变化?
(4)请设计一个实验方案,促使氯气与水反应的化学平衡向正反应方向移动。5、体积和pH都相等的盐酸和醋酸溶液的
导电能力___________,升高相同温度后
导电能力______________________。相同醋酸大于盐酸6.将0 .1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是
A.c(H+) B.c(OH-)
C.c(OH-)/c(NH3·H2O) D.c(NH4+)AC
1.了解强、弱电解质在水溶液中电离程度的差异及原因,了解强、弱电解质与物质结构的关系,在化学平衡概念的基础上理解电离平衡概念。
2.了解酸碱电离理论,能运用电离平衡原理解释弱电解质在水溶液中的电离情况,会书写电离方程式。
3.知道水的离子积常数,知道电离平衡常数与弱酸、弱碱的酸碱性强弱之间的关系。
4.通过活动与探究,学习科学探究的一般方法,培养提出问题、探究问题和解决问题的能力。
5.通过强、弱电解质概念的学习,掌握学习概念性知识的常用方法:归纳法和演绎法。电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。在水溶液中和熔融状态时都不能导电的化合物。①NaCl溶液 ②NaOH ③H2SO4、
④Cu ⑤CH3COOH ⑥NH3·H2O、
⑦CO2 ⑧乙醇 ⑨水②③⑤⑥⑨⑦⑧一、强电解质和弱电解质
1、电解质和非电解质强调:①电解质和非电解质都是对化合物来说。
单质既不是电解质也不是非电解质②电解质本身不一定能导电 你能解释下列事实吗?部分电器外壳上有禁止触摸标记 2.电解水制H2、02时,需要向水中加入少量的Na0H溶液或H2SO4溶液。1.潮湿的手触摸正在工作的电器,可能会发生触电事故。手上的汗水中含有电解质,使水溶液具有较强的导电能力 纯水的导电能力太弱,加入NaOH或H2SO4可使溶液中离子浓度增大,导电能力增强。 1.醋酸和盐酸是常见的两种酸,根据你的经验,你认为它们的电离程度有无差异?请说出你的理由。
2.你能设计实验验证你的猜想吗?请写出实验方案并与同学交流。
3.若按如下方案(或按你自己设计的方案)进行实验,请记录实验现象。
(1)测量物质的量浓度均为1mol·L-1的盐酸和醋酸的pH。
(2)如图3-1所示,在两只锥形瓶中分别加入等体积、物质的量浓度均为1mol·L-1 的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察、比较气球鼓起的快慢等现象,将实验现象和你对实验现象的解释填入表3-1。现象及解释: 金属于盐酸反应的本质是金属于酸电离出来的氢离子反应。同浓度同体积的盐酸和醋酸分别与金属镁反应,盐酸与镁的反应速率要明显大于醋酸与镁反应的速率,PH测定结果也是盐酸的PH小于醋酸的PH。这说明当两种酸的浓度相同时,盐酸电离出来的氢离子浓度要大于醋酸电离出的氢离子浓度,也就是说,盐酸的电离程度要高于醋酸。 HCl=Cl-+H+HCl+H2O=Cl-+H3O+CH3COOH
CH3COO-+H+CH3COOH +H2O
CH3COO-+H3O+H++H2O H3O+ 根据你的经验,你认为相同浓度的氢氧化钠溶液与氨水的电离程度有无差异?请提出你的假设并设计实验加以验证,完成表3-2。2、强电解质和弱电解质(1)强电解质:在水溶液中完全电离的电解质(2)弱电解质:在水溶液中部分电离的电解质 强 碱:强 酸:弱 酸:弱 碱:记住:HCl、H2SO4、HNO3、HClO4、HBr、HICH3COOH、H2CO3、H2SO3、H3PO4、HClO、HF、所有的有机羧酸NaOH、KOH、Ca(OH)2 、Ba(OH)2NH3·H2O 强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离. BaSO4、Fe(OH)3的溶解度都很小, BaSO4属于强电解质,而Fe(OH)3属于弱电解质; CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。电解质的强弱与 其溶解性有何关系?怎样区分强弱电解质?强调:
①强弱电解质≠溶液的导电能力
②强弱电解质≠物质的溶解性
③强酸(碱)弱酸(碱)≠溶液的酸碱性 用1 mol1·L-1醋酸进行导电性实验,发现灯泡亮度很低;用l mol1·L-1 氨水进行导电性实验,发现灯泡亮度同样很低;但若将两种溶液等体积混合后进行导电性实验,灯泡亮度却显著增加。请分析其中的原因。练习与实践 下列电解质中, ① NaCl、 ② NaOH,
③ NH3·H2O、 ④ CH3COOH, ⑤ BaSO4 、
⑥ AgCl 、 ⑦ Na2O 、 ⑧ K2O, ⑨ H2O
哪些是强电解质,那些是弱电解质?强电解质: ① ② ⑤ ⑥ ⑦ ⑧弱电解质:③ ④ ⑨练习与实践强、弱电解质的比较:回顾: 思考与讨论: 1)电离开始后,V(电离 )和 V(分子化)怎
样变化?二、弱电解质的电离平衡 2)当V(电离) = V(分子化)时,可逆过程达到
一种什么样的状态?画出V~t图。2.特征 1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——电离平衡动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动。 等 V电离=V分子化≠0逆 弱电解质的电离是可逆过程思考:NH3·H2O的电离方程式为:
NH3·H2O NH4++OH- △H>0
若在氨水中加入下表中的物质,氨的电离平衡及平衡时物质的浓度有何变化?请填写下表。 表3-3是实验测定的醋酸电离达到平衡时各种微粒的浓度(计算结果保留3位有效数字),请填写表中空白,将你的结论与同学交流讨论。0.9960.09871.82×10-51.82×10-50.421%1.34%3.弱电解质电离程度的表示:(1)电离平衡常数:①意义:在相同条件下,K值越大,弱电解质的电离程度越大,相应酸 (或碱)的酸(或碱)性越强。对于一元弱酸:HA H++A-,平衡时对于一元弱碱:MOH M++OH-,平衡时②影响电离平衡常数大小的因素:A.电离平衡常数大小是由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
B.与化学平衡常数一样,同一弱电解质的电离平衡常数只受温度影响,不受浓度影响。
C.化学平衡常数可以比较同一温度下不同弱电解质的电离程度,也可以比较不同温度下同一弱电解质的电离程度。但不能比较同一温度下不同浓度同一弱电解质的电离程度。 相同条件下
①酸性 HF>CH3COOH>HClO
②CH3COOH与NH3·H2O电离程度相同,溶液的
导电能力也相同弱电解质浓度越大,电离度越小。3.弱电解质电离程度的表示:(2)弱电解质的电离度( ):当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来电解质总分子数(包括已电离和未电离的)的百分数强调:①电离度的大小主要是由弱电解质本身性质决定。在同一条件下,电离度大的弱电解质的电离程度就越大。故电离度可以表示弱电解质的相对强弱。
②同一弱电解质的电离度既受温度影响,也受浓度影响。所以在使用电离度时必须指明温度和浓度,若不指明温度通常认为是25℃4.影响电离平衡的因素
(1)温度
电离过程是吸热过程,温度升高,平衡向电离方向移动。K与 均增大
(2)浓度
弱电解质浓度越大,电离程度越小。【练习】在某温度下,质量分数浓度为2%的某一元弱酸HA溶液的密度为1.02g/cm3。测知该溶液的C(H+)=1×10-2mol/L.若此一元弱酸的相对分子质量为60。求该溶液的物质的量浓度及弱酸HA的电离度和电离平衡常数。三、电离方程式的书写NaCl = Na++Cl-CH3COOH+H2O H3O++CH3COO- 强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸的电离 应分步完成电离方程式,多元弱碱则一步完成电离方程式。即CH3COOH H++CH3COO- 酸性:H3PO4>H2CO3>H2S多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……, 如何用平衡移动原理来解释?a、一级电离出H+后,剩下的酸根阴离子带负电
荷,增加了对H+的吸引力,使第二个H+离子
电离困难的多;
b、一级电离出的H+抑制了二级的电离。结论:多元弱酸的酸性由第一步电离决定。电离难的原因:练习:写出下列物质溶于水的电离方程式:磷酸、氢氧化铜、硫酸氢钠、磷酸二氢钠H3PO4 H2PO4- +H+
H2PO4- HPO42-+H+
HPO42- PO43-+H+Cu(OH)2 Cu2++2OH-NaHSO4=Na++H++SO42-NaH2PO4=Na+ + H2PO4-
H2PO4- HPO42- + H+
HPO42- PO43- + H+ 有机弱酸在生活中十分常见。许多水果之所以有酸味,主要是因为它们含有柠檬酸、抗坏血酸(维生素C)等有机弱酸;当你被蚂蚁等昆虫叮咬之后,会产生红疹,这主要是由于蚂蚁等昆虫的体液内含有甲酸(HCOOH,也叫蚁酸);当人经过剧烈运动后会感觉小腿发酸,这主要是由于人体在剧烈运动的过程中产生了乳酸;制造肥皂用的硬脂酸(C17H35C00H)是一种脂肪酸,脂肪酸可以用通式R—COOH表示。
胺类(R-NH2)是我们日常生活中常见的一类有机弱碱。许多相对分子质量较小的胺具有让人很不舒服的刺激性气味。胺类的性质和氨水相似,溶于水显弱碱性:有机弱酸和有机弱碱被蜜蜂或黄蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为蜜蜂分泌物中含有的是一种酸性物质,而黄蜂分泌物中含有的是一种碱性物质。请思考当被蜜蜂或黄蜂叮咬后应如何用家庭常用的物质加以处理。练习与实践例1:在小烧杯中加入一定量的冰醋酸,将连有电流计的导电装置插入其中。向小烧杯中逐渐加水稀释,发现随着水的加入,电流计指针偏转角度逐渐增大,到某一定值时又逐渐减小。试解释产生这种现象的原因。
练习:一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b例2:PH值相同等体积的两份溶液,A为盐酸B为醋酸分别和锌反应。若最后有一份溶液中有锌剩余且放出气体一样多,则正确的判断是
①反应所需时间B>A②开始时反应速率A>B③参加反应的锌的质量为B=A④整个反应阶段的平均反应速率B>A⑤盐酸中锌有剩余⑥醋酸中锌有剩余
A、③④⑤ B、①③⑥ C、②③⑥ D、②④⑤【练习】下列电离方程式书写正确的是
A、醋酸钠溶于水 CH3COONa Na++CH3COO-
B、亚硫酸溶于水 H2SO3 2H++SO32-
C、次氯酸溶于水 HClO+H2O H3O++ClO-
D、磷酸二氢钠溶于水 NaH2PO4=Na++2H++PO43-例3:甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中OH-的物质的量浓度之比_________(填大于、等于或小于)10。请说明理由。 【练习】把0.05 molNaOH固体分别加入到下列100mL液体中,溶液导电能力变化不大的是
A. 自来水 B. 0.5 mol/L盐酸
C. 0.5 mol/L醋酸 D. 0.5 mol/L氯化铵例4:用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的HA的配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA的溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”、“<”、“=”)。
乙方案中,说明HA是弱电解质的现象是 (多选扣分。)
(a)装HCl的试管中放出H2的速率快;
(b)装HA溶液的试管中入出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价乙方案中难以实现之处不妥善之处: 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
答: 。【练习】有四种一元酸甲、乙、丙、丁,其电离度与浓度、温度关系见下表,则相同条件下他们水溶液的酸性由强到弱的顺序是_____________________【例5】、已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
⑴25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同)
⑵25℃时,C(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是
⑶25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是 增大增大增大减小减小增大增大增大增大增大增大增大减小减小减小减小减小减小减小减小增大增大增大增大例6:(1)Ba(OH)2溶液中滴入H2SO4溶液至过量 (2)醋酸溶液中滴入氨水至过量(3)澄清石灰水中通入CO2至过量 (4)NH4Cl溶液中逐渐加入适量的NaOH固体
下列图像是在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是 ;与B图变化趋势一致的是 ;与C图变化趋势一致是的 。【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入甲溶液,电灯又会逐渐亮起来。下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3 B.CH3COOH、NH3·H2O C.NaOH、AlCl3 D.H2SO4、Ba(OH)2 练习
1.1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率______________________,
最终收集到的氢气的物质的量____________________。
2.pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率 _____________________,
最终收集到的氢气的物质的量 ____________________。硫酸>盐酸>醋酸硫酸>盐酸=醋酸三者相等醋酸>硫酸=盐酸3.一定量的盐酸跟过量的铁粉反应时,为减缓反应速率而不影响生成氢气的总量,可向盐酸中加入适量的 ( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固) BD4、氯气溶于水的反应是一个可逆反应。
(1)请写出氯气与水反应的化学方程式,并据此推断氯水中含有哪些物质(用化学式表示)。
(2)氯水中哪些物质能发生电离,请写出电离方程式,并据此分析氯水中存在的微粒。
(3)若将氯水置于光照条件下,氯水中的化学平衡如何移动?各种微粒的浓度如何变化?
(4)请设计一个实验方案,促使氯气与水反应的化学平衡向正反应方向移动。5、体积和pH都相等的盐酸和醋酸溶液的
导电能力___________,升高相同温度后
导电能力______________________。相同醋酸大于盐酸6.将0 .1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是
A.c(H+) B.c(OH-)
C.c(OH-)/c(NH3·H2O) D.c(NH4+)AC
