物质的量(山东省日照市五莲县)
图片预览





文档简介
课件19张PPT。
2007.9. 8 第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
(第1课时)教学目标:
(一)知识目标
1、使学生了解物质的量及其单位——摩尔,了解物质的量与微观粒子之间的关系。
2、了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3、使学生了解物质的量、阿伏加德罗常数、微粒个数之间的关系。
(二)能力目标
初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
(三)情感目标
通过对概念的透彻理解,培养学生严谨、认真的学习态度,使学生掌握科学的学习方法。
教学重点:物质的量及其单位。
教学难点:物质的量及其单位想想看:?有一袋大米,假如想知道这袋大米中米粒的个数,你有哪些好的方法?
(假设每粒大米的形状、体积、质量完全一样)方案展示方案一 直接一粒一粒数 方案二 选用合适的模具, 每量一下有100粒大米,即为一堆,再用堆数乘以100 方案三 可先称量出一粒大米的质量,再用大米的总质量除以一
粒大米的质量 ,得到米粒数. 方 案四 先称量出100粒大米的质量,用大米的总质量除以100
粒大米的质量,再乘以100归纳为两种方法模型模型一:直接计量 (方案一)模型二:引入中间量换算
(方案二、四、六、)方 案五 先测量出一粒大米的体积,再用大米的总体积除以一粒
大米的体积,得到米粒数方 案六 可先测量出100粒大米的体积,再用大米的总体积除以100粒大米的体
积 ,再乘以100得到米粒数 宏 观(质量)微 观 (微粒数)
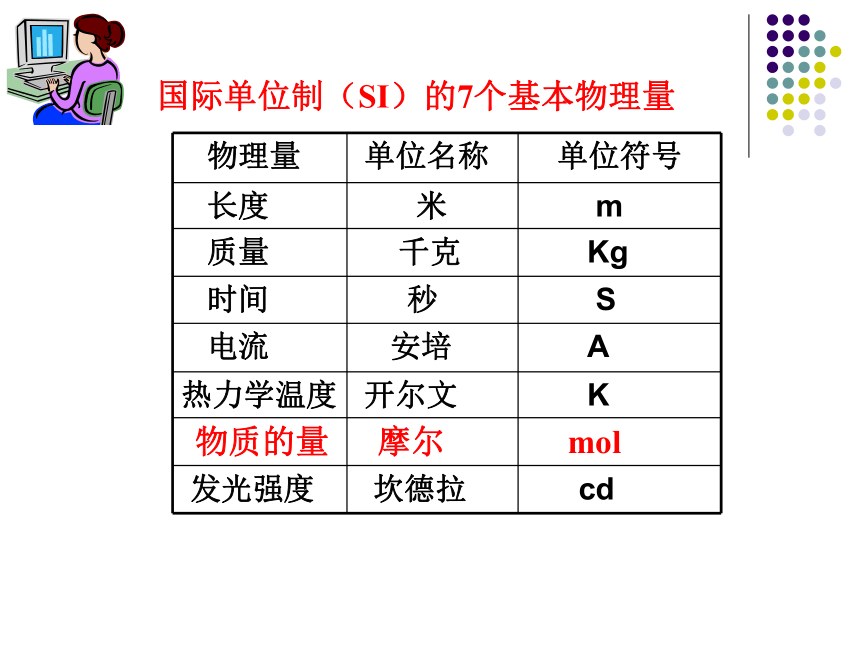
物质的量国际单位制(SI)的7个基本物理量5. 表达格式:如1mol H, 1mol H2, 1mol H+物质的量及其单位1.物质的量是一个物理量。物质的量是专用名词,这四个字是一 个整体,不得简化或增添任何字。2.物质的量用符号“n”表示。 3. 摩尔是物质的量的单位,符号:mol,简称摩。4.物质的量计量的对象为微观粒子,微观粒子可以是原子、分子、离 子、质子、中子等单一粒子,也可以是这些微观粒子的特定组合。使用物质的量时一定要指明微粒的种类(原子、分子、离子等)。判断下列说法是否正确,并说明理由。 (1)1mol氧 (2)0.25molCO2 (3)1mol小麦 (4)摩尔是7个基本物理量之一。 错误。没有指明微粒的种类。改成1molO,1molO2都是正确的。因此使用摩尔作单位时,所指微粒必须十分明确,且微粒的种类一般用化学符号表示。 正确。 不能,因为物质的量及其单位的使用对象只能是微观粒子,不能用来
描述宏观物质.
错误。物质的量是基本物理量之一。摩尔只是它的单位,不能把二者混为一谈 .练一练?[思考]已知:一个碳原子的质量为 1.993 × 10-23kg
求: 0.012kg 碳-12 中所含的碳原子数?解: = 6.02×1023 碳原子数=0.012kg1.993 × 10-23kg用0.012 kg 12C所含的碳原子数作为1mol的标准。 (1)1mol任何微粒中所含的微粒数与
0.012 kg12C所含的碳原子数相等,为6.02×1023 (2) 6.02×1023mol-1称为阿伏加德罗常数
符号为:NA.单位为:mol-1.
1mol任何微粒中所含的微粒数
=0.012 kg12C所含的碳原子数
=阿伏加德罗常数结论:基础达标:1、物质的量是用 作为标准来衡量其它微粒集体所含微粒数目多少的物理量。符号为 ,其单位是 。 2、摩尔是______ __的单位,1摩尔物质含 个微粒。3、 称为阿伏加德罗常数(NA),它不单纯是一个数,而是一个物理量,它的单位是 ,其数值为 。0.012kg 12C所含的原子数目nmol物质的量6.02×1023 6.02×1023 mol-1mol-16.02×1023 2、1molH2O中含 个H2O, 0.5mol含有 个H2O。
3、0.5molO2中的氧原子数为 个.
4、3.01×1023个氧气分子的物质的量为 mol。
5、1.806×1024个Fe的物质的量为 mol。1.下列叙述错误的是( )
A.1mol任何物质都含有6.02×1023个原子
B.0.012kg12C 含有6.02×1023个碳原子
C.在使用摩尔表示物质的量的单位时,应用化学符号指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一 A 6.02×1023 3.01×1023 6.02×1023 0.5 3你学会了吗阿伏加德罗常数微粒个数物质的量NNA n=归纳整合迁移·应用微粒数( )氢原子氧原子( )微粒数物质的量( )H O( )物质的量6.02×1023个水分子1molH2O2× 6.02×10236.02×1023 2mol 1mol 拓展延伸2. 一个O 中含有 个电子,
一个H2O含有 个电子,含有 个质子。1. 1molCO2分子中有 molC, molO,共有 mol原子. 3. 1mol H2O中含有 mol电子,
0.8mol H2O中含有 mol电子,这些电子是 NA 。4. 1mol CO2与 molO2所含原子数相等。 1238101010881.5小结作业布置1、课下去图书馆(或登陆网站)查阅“物质的量”,
进一步加深对“物质的量”的认识。
2、完成讲义(课后作业)。谢 谢!阿伏加德罗生平简介 意大利物理学家。1776年8月9日生于都灵市一个律师家庭,1856年7月9日卒于都灵市。1792年进都灵大学法律系学习,取得法学博士学位后,曾开业当律师。1800年弃法从理,十分勤奋,1820年被聘任都灵大学理科教授。自 18年被选为都灵科学院院士后,还担任过意大利教育委员和度量衡学会会长.
2007.9. 8 第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
(第1课时)教学目标:
(一)知识目标
1、使学生了解物质的量及其单位——摩尔,了解物质的量与微观粒子之间的关系。
2、了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3、使学生了解物质的量、阿伏加德罗常数、微粒个数之间的关系。
(二)能力目标
初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
(三)情感目标
通过对概念的透彻理解,培养学生严谨、认真的学习态度,使学生掌握科学的学习方法。
教学重点:物质的量及其单位。
教学难点:物质的量及其单位想想看:?有一袋大米,假如想知道这袋大米中米粒的个数,你有哪些好的方法?
(假设每粒大米的形状、体积、质量完全一样)方案展示方案一 直接一粒一粒数 方案二 选用合适的模具, 每量一下有100粒大米,即为一堆,再用堆数乘以100 方案三 可先称量出一粒大米的质量,再用大米的总质量除以一
粒大米的质量 ,得到米粒数. 方 案四 先称量出100粒大米的质量,用大米的总质量除以100
粒大米的质量,再乘以100归纳为两种方法模型模型一:直接计量 (方案一)模型二:引入中间量换算
(方案二、四、六、)方 案五 先测量出一粒大米的体积,再用大米的总体积除以一粒
大米的体积,得到米粒数方 案六 可先测量出100粒大米的体积,再用大米的总体积除以100粒大米的体
积 ,再乘以100得到米粒数 宏 观(质量)微 观 (微粒数)
物质的量国际单位制(SI)的7个基本物理量5. 表达格式:如1mol H, 1mol H2, 1mol H+物质的量及其单位1.物质的量是一个物理量。物质的量是专用名词,这四个字是一 个整体,不得简化或增添任何字。2.物质的量用符号“n”表示。 3. 摩尔是物质的量的单位,符号:mol,简称摩。4.物质的量计量的对象为微观粒子,微观粒子可以是原子、分子、离 子、质子、中子等单一粒子,也可以是这些微观粒子的特定组合。使用物质的量时一定要指明微粒的种类(原子、分子、离子等)。判断下列说法是否正确,并说明理由。 (1)1mol氧 (2)0.25molCO2 (3)1mol小麦 (4)摩尔是7个基本物理量之一。 错误。没有指明微粒的种类。改成1molO,1molO2都是正确的。因此使用摩尔作单位时,所指微粒必须十分明确,且微粒的种类一般用化学符号表示。 正确。 不能,因为物质的量及其单位的使用对象只能是微观粒子,不能用来
描述宏观物质.
错误。物质的量是基本物理量之一。摩尔只是它的单位,不能把二者混为一谈 .练一练?[思考]已知:一个碳原子的质量为 1.993 × 10-23kg
求: 0.012kg 碳-12 中所含的碳原子数?解: = 6.02×1023 碳原子数=0.012kg1.993 × 10-23kg用0.012 kg 12C所含的碳原子数作为1mol的标准。 (1)1mol任何微粒中所含的微粒数与
0.012 kg12C所含的碳原子数相等,为6.02×1023 (2) 6.02×1023mol-1称为阿伏加德罗常数
符号为:NA.单位为:mol-1.
1mol任何微粒中所含的微粒数
=0.012 kg12C所含的碳原子数
=阿伏加德罗常数结论:基础达标:1、物质的量是用 作为标准来衡量其它微粒集体所含微粒数目多少的物理量。符号为 ,其单位是 。 2、摩尔是______ __的单位,1摩尔物质含 个微粒。3、 称为阿伏加德罗常数(NA),它不单纯是一个数,而是一个物理量,它的单位是 ,其数值为 。0.012kg 12C所含的原子数目nmol物质的量6.02×1023 6.02×1023 mol-1mol-16.02×1023 2、1molH2O中含 个H2O, 0.5mol含有 个H2O。
3、0.5molO2中的氧原子数为 个.
4、3.01×1023个氧气分子的物质的量为 mol。
5、1.806×1024个Fe的物质的量为 mol。1.下列叙述错误的是( )
A.1mol任何物质都含有6.02×1023个原子
B.0.012kg12C 含有6.02×1023个碳原子
C.在使用摩尔表示物质的量的单位时,应用化学符号指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一 A 6.02×1023 3.01×1023 6.02×1023 0.5 3你学会了吗阿伏加德罗常数微粒个数物质的量NNA n=归纳整合迁移·应用微粒数( )氢原子氧原子( )微粒数物质的量( )H O( )物质的量6.02×1023个水分子1molH2O2× 6.02×10236.02×1023 2mol 1mol 拓展延伸2. 一个O 中含有 个电子,
一个H2O含有 个电子,含有 个质子。1. 1molCO2分子中有 molC, molO,共有 mol原子. 3. 1mol H2O中含有 mol电子,
0.8mol H2O中含有 mol电子,这些电子是 NA 。4. 1mol CO2与 molO2所含原子数相等。 1238101010881.5小结作业布置1、课下去图书馆(或登陆网站)查阅“物质的量”,
进一步加深对“物质的量”的认识。
2、完成讲义(课后作业)。谢 谢!阿伏加德罗生平简介 意大利物理学家。1776年8月9日生于都灵市一个律师家庭,1856年7月9日卒于都灵市。1792年进都灵大学法律系学习,取得法学博士学位后,曾开业当律师。1800年弃法从理,十分勤奋,1820年被聘任都灵大学理科教授。自 18年被选为都灵科学院院士后,还担任过意大利教育委员和度量衡学会会长.
