第一章复习(广东省清远市佛冈县)
文档属性
| 名称 | 第一章复习(广东省清远市佛冈县) |  | |
| 格式 | rar | ||
| 文件大小 | 111.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-19 09:18:00 | ||
图片预览







文档简介
课件20张PPT。选修4复习注意做好笔记!!化学反应原理所研究的范围是2、化学反应的速率、方向及限度的问题3、水溶液中的离子反应的问题4、电化学的基础知识1、化学反应与能量的问题如何来研究一个反应,研究化学反应原理的
基本方法和思路是怎样?即:我们从哪些方面来认识一个反应!先认识几个概念:1、有效碰撞2、活化分子3、活化能4、催化剂有 效 碰 撞1、什么是有效碰撞?引起分子间的化学反应的碰撞结论:分子间的碰撞是发生化学反应的必要条件而有效碰撞是发生化学反应的充分条件推论:某一化学反应的速率大小与单位时间内有效碰撞的次数有关活 化 分 子1、什么是活化分子?具有较高能量,能够发生有效碰撞的分子结论:发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。推论:有效碰撞次数的多少与单位体积内反应物中活化分子
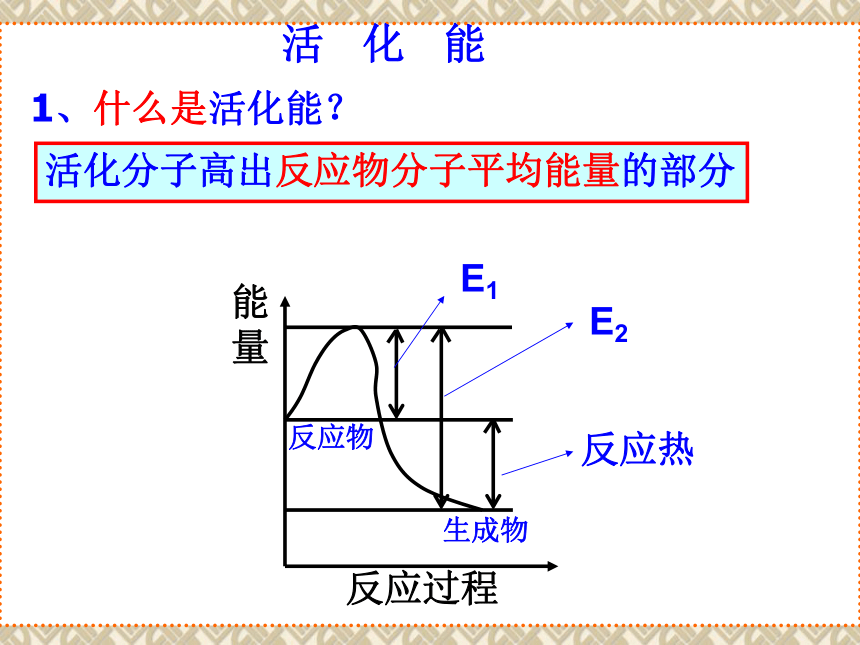
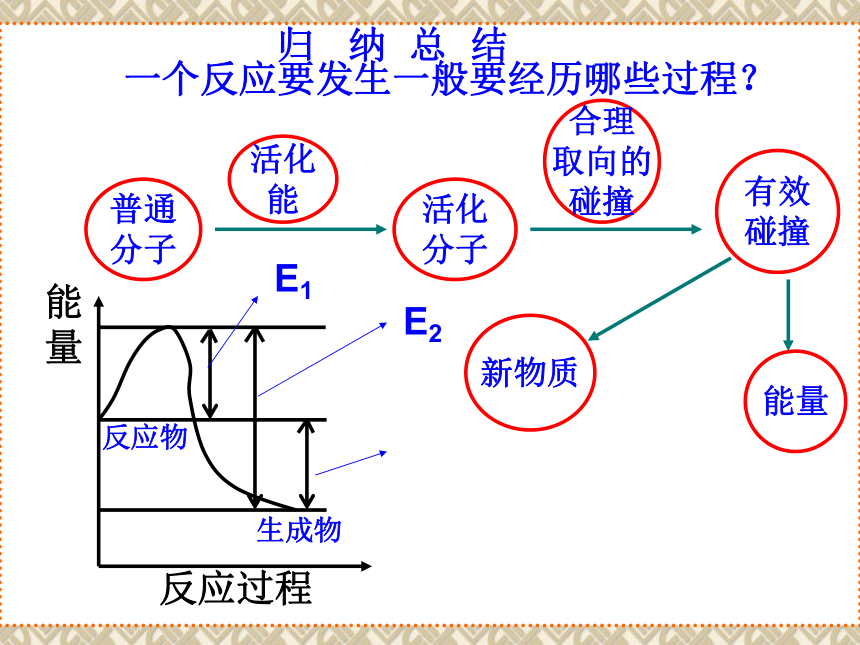
的多少有关。活 化 能1、什么是活化能?活化分子高出反应物分子平均能量的部分能量反应过程E1E2反应热反应物生成物归 纳 总 结一个反应要发生一般要经历哪些过程?普通
分子活化
能活化
分子合理
取向的
碰撞有效
碰撞第一章 化学反应与能量【考点归纳】化学键与化学反应中能量变化的关系
放热反应和吸热反应
反应热和焓变
热化学方程式的书写
理解燃烧热的概念,认识能源
盖斯定律及其应用
反应热的计算(3)在化学反应中, 与 这两个过程所吸收和放出的能量 ,因此化学反应必然伴随着 .考点1:化学键与化学反应中能量变化的关系(1)发生化学反应时,断开反应物中的化学键要 能量,而形成生成物中的化学键要____能量,化学键的 正是化学反应中能量变化的主要原因.(2)在25°C和101kPa下,断开1mol化学键所吸收的能量与生成1mol相同化学键所放出的能量 .吸收放出断裂和形成相等断裂旧键形成新键不相等能量变化考点2:放热反应和吸热反应判断方法: (1)比较反应物总能量与生成物总能量的相对大小,当∑E(反应物)> ∑E (生成物)时该反应为放热反应,反之当∑E (反应物)< ∑E (生成物)时该反应为吸热反应.
(2)从化学键角度分析:断裂旧键所吸收的能量大于形成新键放出的能量时为吸热反应,反之为放热反应.1.下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应 C.反应物和生成物所具有的总能量决定了放热还是吸热 D.吸热反应在一定条件下(如常温、加热等)也能发生反应C、D2、已知反应X+Y==M+N为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M B. Y的能量一定高于N
X和Y的总能量一定高于M和N的总能量
因该反应为放热反应,故不必加热就可发生C考点3:反应热和焓变1.对反应热和焓变的认识(1)、概念(2)对于放热反应,由于反应后放出的热量使反应体系的能量降低,故规定△H为“-”,对于吸热反应由于反应要通过加热、光照等吸收能量,而使反应体系的能量升高,故规定△H为“+”(3)△H的单体为kJ/mol.(4)由键能求反应热的公式为:
△H = 反应物的键能总和 - 生成物的键能总和(5)△H有正负之分。因此比较大小时要连同“+”“-”包含在内,类似数学上正负数比较,如果只比较反应放出热量多少,则只比较数值大小.1、已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H1=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H2=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定 C2、一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5mol·L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应:
C4H10(g)+13/2 O2(g)== 4 CO2 (g)+ 5 H2O(g)的△H为:
A. +8Q mol·kJ-1 B. +16Q mol·kJ-1
C. -8Q mol·kJ-1 D. -16Q mol·kJ-1D考点4:热化学方程式的书写注意问题:随堂通P51、热化学方程式
C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol
表示( ) A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJC2、下列各组热化学方程式中,化学反应的△H前者大于后者的是(06江苏高考题)
① C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2
② S(s)+O2(g)=SO2(g); △H3 S(g)+O2(g)=SO2(g); △H4
③ H2(g)+1/2O2(g)=H2O(l); △H5 2H2(g)+O2(g)=2H2O(l); △H6
④ CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A ① B ④ C ②③④ D ①②③C3、已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是:
A. H2O(g) == H2(g)+1/2 O2(g); △H=-242 kJ·mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H=- 484 kJ·mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ;△H=+242 kJ·mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H=+484 kJ·mol-1A考点5:燃烧热、能源(2)燃烧热一般是实验测得,物质燃烧时放出的热量多少与外界条件有关(如未注明条件,则指250C和101.3kPa时热量),还与反应物和生成物的聚集状态有关。(1)概念(3)定义1mol物质指1mol纯净物(单质或化合物)(4)定义中完全燃烧生成稳定的氧化物则指单质或化合物燃烧后变为最稳定的氧化物,如:
C-CO2(g),H2-H2O(l),P-P2O5(s) (5)燃烧热是以1mol可燃物为标准进行测量的,因此书写燃烧的热化学方程式时,其他物质的计量数可用分数表示。 1、下列热化学方程式中△H代表燃烧热的是 A、CH4(g)+3/2O2 (g)=2H2O(l)+CO(g) △H1
B、S(g)+3/2O2(g)=SO3(s) △H2
C、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D、2CO(g)+O2(g)= 2CO2(g) △H42、由氢气和氧气反应生成1mol水蒸气,放出241.8kJ。写出该反应的热化学方程式:______________________________________
若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+1/2O2(g)==H2O(l) △H=_______ kJ/mol,氢气的燃烧热为_______ kJ/mol H2(g)+1/2O2(g)==H2O(g);△H=-241.8kJ/mol-285.8285.8
基本方法和思路是怎样?即:我们从哪些方面来认识一个反应!先认识几个概念:1、有效碰撞2、活化分子3、活化能4、催化剂有 效 碰 撞1、什么是有效碰撞?引起分子间的化学反应的碰撞结论:分子间的碰撞是发生化学反应的必要条件而有效碰撞是发生化学反应的充分条件推论:某一化学反应的速率大小与单位时间内有效碰撞的次数有关活 化 分 子1、什么是活化分子?具有较高能量,能够发生有效碰撞的分子结论:发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。推论:有效碰撞次数的多少与单位体积内反应物中活化分子
的多少有关。活 化 能1、什么是活化能?活化分子高出反应物分子平均能量的部分能量反应过程E1E2反应热反应物生成物归 纳 总 结一个反应要发生一般要经历哪些过程?普通
分子活化
能活化
分子合理
取向的
碰撞有效
碰撞第一章 化学反应与能量【考点归纳】化学键与化学反应中能量变化的关系
放热反应和吸热反应
反应热和焓变
热化学方程式的书写
理解燃烧热的概念,认识能源
盖斯定律及其应用
反应热的计算(3)在化学反应中, 与 这两个过程所吸收和放出的能量 ,因此化学反应必然伴随着 .考点1:化学键与化学反应中能量变化的关系(1)发生化学反应时,断开反应物中的化学键要 能量,而形成生成物中的化学键要____能量,化学键的 正是化学反应中能量变化的主要原因.(2)在25°C和101kPa下,断开1mol化学键所吸收的能量与生成1mol相同化学键所放出的能量 .吸收放出断裂和形成相等断裂旧键形成新键不相等能量变化考点2:放热反应和吸热反应判断方法: (1)比较反应物总能量与生成物总能量的相对大小,当∑E(反应物)> ∑E (生成物)时该反应为放热反应,反之当∑E (反应物)< ∑E (生成物)时该反应为吸热反应.
(2)从化学键角度分析:断裂旧键所吸收的能量大于形成新键放出的能量时为吸热反应,反之为放热反应.1.下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应 C.反应物和生成物所具有的总能量决定了放热还是吸热 D.吸热反应在一定条件下(如常温、加热等)也能发生反应C、D2、已知反应X+Y==M+N为放热反应,对该反应的下列说法中正确的( )
A.X的能量一定高于M B. Y的能量一定高于N
X和Y的总能量一定高于M和N的总能量
因该反应为放热反应,故不必加热就可发生C考点3:反应热和焓变1.对反应热和焓变的认识(1)、概念(2)对于放热反应,由于反应后放出的热量使反应体系的能量降低,故规定△H为“-”,对于吸热反应由于反应要通过加热、光照等吸收能量,而使反应体系的能量升高,故规定△H为“+”(3)△H的单体为kJ/mol.(4)由键能求反应热的公式为:
△H = 反应物的键能总和 - 生成物的键能总和(5)△H有正负之分。因此比较大小时要连同“+”“-”包含在内,类似数学上正负数比较,如果只比较反应放出热量多少,则只比较数值大小.1、已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H1=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H2=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定 C2、一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5mol·L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应:
C4H10(g)+13/2 O2(g)== 4 CO2 (g)+ 5 H2O(g)的△H为:
A. +8Q mol·kJ-1 B. +16Q mol·kJ-1
C. -8Q mol·kJ-1 D. -16Q mol·kJ-1D考点4:热化学方程式的书写注意问题:随堂通P51、热化学方程式
C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol
表示( ) A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJC2、下列各组热化学方程式中,化学反应的△H前者大于后者的是(06江苏高考题)
① C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2
② S(s)+O2(g)=SO2(g); △H3 S(g)+O2(g)=SO2(g); △H4
③ H2(g)+1/2O2(g)=H2O(l); △H5 2H2(g)+O2(g)=2H2O(l); △H6
④ CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A ① B ④ C ②③④ D ①②③C3、已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是:
A. H2O(g) == H2(g)+1/2 O2(g); △H=-242 kJ·mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H=- 484 kJ·mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ;△H=+242 kJ·mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H=+484 kJ·mol-1A考点5:燃烧热、能源(2)燃烧热一般是实验测得,物质燃烧时放出的热量多少与外界条件有关(如未注明条件,则指250C和101.3kPa时热量),还与反应物和生成物的聚集状态有关。(1)概念(3)定义1mol物质指1mol纯净物(单质或化合物)(4)定义中完全燃烧生成稳定的氧化物则指单质或化合物燃烧后变为最稳定的氧化物,如:
C-CO2(g),H2-H2O(l),P-P2O5(s) (5)燃烧热是以1mol可燃物为标准进行测量的,因此书写燃烧的热化学方程式时,其他物质的计量数可用分数表示。 1、下列热化学方程式中△H代表燃烧热的是 A、CH4(g)+3/2O2 (g)=2H2O(l)+CO(g) △H1
B、S(g)+3/2O2(g)=SO3(s) △H2
C、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D、2CO(g)+O2(g)= 2CO2(g) △H42、由氢气和氧气反应生成1mol水蒸气,放出241.8kJ。写出该反应的热化学方程式:______________________________________
若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+1/2O2(g)==H2O(l) △H=_______ kJ/mol,氢气的燃烧热为_______ kJ/mol H2(g)+1/2O2(g)==H2O(g);△H=-241.8kJ/mol-285.8285.8
