山东聊城 《常见的碱》复习[下学期]
文档属性
| 名称 | 山东聊城 《常见的碱》复习[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 111.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-18 16:06:00 | ||
图片预览






文档简介
课件19张PPT。第五单元 常见的酸和碱
(第二课时)
课题2 常见的碱
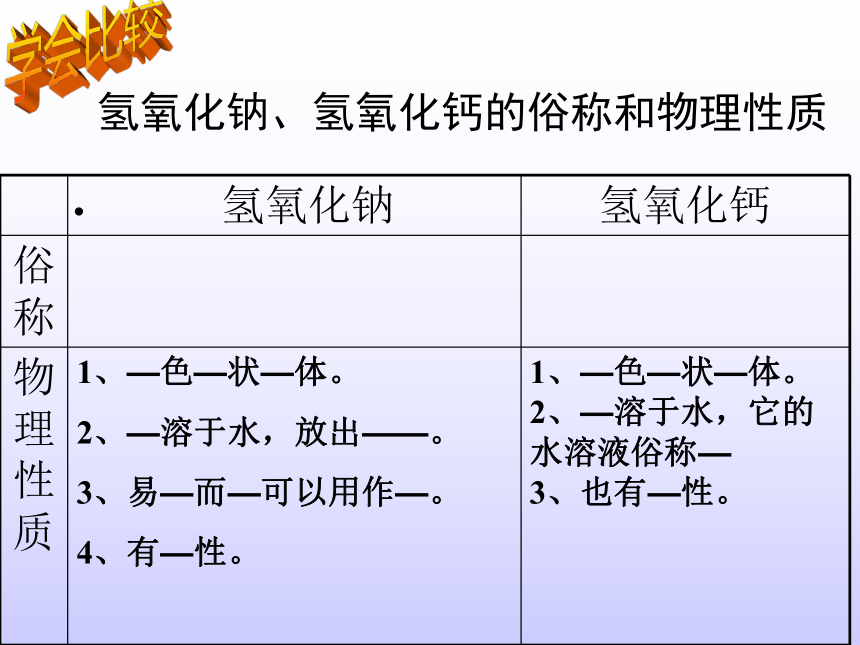
1、知道氢氧化钠、氢氧化钙的物理性质。 2、掌握氢氧化钠、氢氧化钙的化学性质及共性。 3、认识复分解反应,会书写复分解反应的化学方程式。学习目标:你知道吗?什么是碱? 电离时生成的阴离子全部是氢氧根离子的化合物。氢氧化钠、氢氧化钙的俗称和物理性质 学会比较氢氧化钠、氢氧化钙的俗称和物理性质 学会比较火碱、烧碱、苛性钠消石灰、熟石灰在使用氢氧化钠时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。
学会比较氢氧化钠、氢氧化钙的化学性质跟指示剂的
反 应跟非金属氧化物的反应跟酸的反应跟某些盐的反 应氢氧化钠氢氧化钙使石蕊试液变——色,使酚酞试液变——色使石蕊试液变——色 使酚酞试液变——色CO2+NaOH——CO2+Ca(OH)2 —NaOH+HCl——Ca(OH)2 + HCl—CuSO4+NaOH——Na2CO3+Ca(OH)2—学会比较氢氧化钠、氢氧化钙的化学性质跟指示剂的
反 应跟非金属氧化物的反应跟酸的反应跟某些盐的反 应氢氧化钠氢氧化钙使石蕊试液变蓝色,使酚酞试液变红色使石蕊试液变蓝色 使酚酞试液变红色CO2+2NaOH=Na2CO3+H2OCO2+Ca(OH)2 =CaCO 3↓ +H2O NaOH+HCl=NaCl+H2OCa(OH)2 + 2HCl=CaCl2+2H2OCuSO4+2NaOH=Cu(OH)2 ↓ +Na2SO4Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH1.能使指示剂变色 2.碱+ 非金属氧化物=盐+水 3.碱+酸=盐+水(中和反应)4.碱+盐=新碱+新盐碱溶液使紫色的石蕊试液变 色,使无色的酚酞试液变 色蓝红碱的共性学会归纳课堂练习 实验室氢氧化钠固体必须密封保存,因为氢氧化钠暴露在空气中,不仅易吸收空气中的水蒸气而逐渐溶解,而且还易跟空气中的二氧化碳反应而变质。1、实验室的氢氧化钠应该如何保存?为什么?CO2+2NaOH=Na2CO3+H2O课堂练习 A、H2 O2 CO B、H2 O2 HCl
C、H2 SO2 CO D、O2 CO CO2 2、下列各组气体中,均能用固体氢氧化 钠干燥的一组是( )A3、(2006厦门)氢氧化钠与氢氧化钾都是碱,请类比氢氧化钠的化学性质,完成下表:酸2KOH+CO2=K2CO3+H2OKOH+HCl=KCl+H2O盐直面中考什么是复分解反应?复分解反应的发生需要什么条件?
你知道吗?AB + CD=AD + CB1.复分解反应能不能发生,要考虑生成物中是否有沉淀、气体或水生成。
2.盐跟碱、盐跟盐反应时,反应物
必须是可溶的。
学会归纳请完成下列化学方程式:
1、Fe2O3 + HCl===
2、 NaOH+H2SO4==
3、CaCO3 + HCl==
4、CuCl2 + NaOH==
5、NaCl+AgNO3==你会写吗?2FeCl3+3H2ONa2SO4+2H2O2CaCl2+H2O+CO2 ↑2Cu(OH)2 ↓ +2NaClAgCl ↓ +NaNO362主要成份:氢氧化铝3HCl + Al(OH)3 == AlCl3 + 3H2O生活知多少用化学方程式表示斯达舒治疗胃酸过多症的原理:直面中考2、下列物质不能和氢氧化钠溶液反应生成盐和水的是( )
A:三氧化硫 B:二氧化碳
C:氧化镁 D:稀硫酸1、把纯水、稀硫酸和氢氧化钠三种无色溶液区别开的最简单的方法是( )
A:滴入酚酞试液 B:滴入石蕊试液
C:滴入氯化钡溶液 D:通入二氧化碳气体BCACB2NaOH+CuSO4=Cu(OH)2↓+Na2SO42NaOH+CO2=Na2CO3+H2ONaOH+HCl=NaCl+H2O直面中考7、(2006广州)A、B、C、D、E、F、G都是初中化学常见物质。其中A是酸,C、D是盐,E、F是碱,它们相互可以发生如下变化:
①A+E=D+G
②2A+B=C+H2 ↑
③2E+C=F ↓ +2D
根据上述信息,回答:
⑴ G的化学式是—— ,A的化学式是——。
⑵在化合物C中,元素B呈现的化合价是——,含有B元素的化合物除了C外还有——〔填A、B、C、D、E、F、G等符号〕
⑶写出符合反应③的一个化学方程式
—————————。+2FHClH2O2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl直面中考谢谢指导
再 见
(第二课时)
课题2 常见的碱
1、知道氢氧化钠、氢氧化钙的物理性质。 2、掌握氢氧化钠、氢氧化钙的化学性质及共性。 3、认识复分解反应,会书写复分解反应的化学方程式。学习目标:你知道吗?什么是碱? 电离时生成的阴离子全部是氢氧根离子的化合物。氢氧化钠、氢氧化钙的俗称和物理性质 学会比较氢氧化钠、氢氧化钙的俗称和物理性质 学会比较火碱、烧碱、苛性钠消石灰、熟石灰在使用氢氧化钠时必须十分小心,防止皮肤、衣服被它腐蚀,更应防止溅到眼睛里。
学会比较氢氧化钠、氢氧化钙的化学性质跟指示剂的
反 应跟非金属氧化物的反应跟酸的反应跟某些盐的反 应氢氧化钠氢氧化钙使石蕊试液变——色,使酚酞试液变——色使石蕊试液变——色 使酚酞试液变——色CO2+NaOH——CO2+Ca(OH)2 —NaOH+HCl——Ca(OH)2 + HCl—CuSO4+NaOH——Na2CO3+Ca(OH)2—学会比较氢氧化钠、氢氧化钙的化学性质跟指示剂的
反 应跟非金属氧化物的反应跟酸的反应跟某些盐的反 应氢氧化钠氢氧化钙使石蕊试液变蓝色,使酚酞试液变红色使石蕊试液变蓝色 使酚酞试液变红色CO2+2NaOH=Na2CO3+H2OCO2+Ca(OH)2 =CaCO 3↓ +H2O NaOH+HCl=NaCl+H2OCa(OH)2 + 2HCl=CaCl2+2H2OCuSO4+2NaOH=Cu(OH)2 ↓ +Na2SO4Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH1.能使指示剂变色 2.碱+ 非金属氧化物=盐+水 3.碱+酸=盐+水(中和反应)4.碱+盐=新碱+新盐碱溶液使紫色的石蕊试液变 色,使无色的酚酞试液变 色蓝红碱的共性学会归纳课堂练习 实验室氢氧化钠固体必须密封保存,因为氢氧化钠暴露在空气中,不仅易吸收空气中的水蒸气而逐渐溶解,而且还易跟空气中的二氧化碳反应而变质。1、实验室的氢氧化钠应该如何保存?为什么?CO2+2NaOH=Na2CO3+H2O课堂练习 A、H2 O2 CO B、H2 O2 HCl
C、H2 SO2 CO D、O2 CO CO2 2、下列各组气体中,均能用固体氢氧化 钠干燥的一组是( )A3、(2006厦门)氢氧化钠与氢氧化钾都是碱,请类比氢氧化钠的化学性质,完成下表:酸2KOH+CO2=K2CO3+H2OKOH+HCl=KCl+H2O盐直面中考什么是复分解反应?复分解反应的发生需要什么条件?
你知道吗?AB + CD=AD + CB1.复分解反应能不能发生,要考虑生成物中是否有沉淀、气体或水生成。
2.盐跟碱、盐跟盐反应时,反应物
必须是可溶的。
学会归纳请完成下列化学方程式:
1、Fe2O3 + HCl===
2、 NaOH+H2SO4==
3、CaCO3 + HCl==
4、CuCl2 + NaOH==
5、NaCl+AgNO3==你会写吗?2FeCl3+3H2ONa2SO4+2H2O2CaCl2+H2O+CO2 ↑2Cu(OH)2 ↓ +2NaClAgCl ↓ +NaNO362主要成份:氢氧化铝3HCl + Al(OH)3 == AlCl3 + 3H2O生活知多少用化学方程式表示斯达舒治疗胃酸过多症的原理:直面中考2、下列物质不能和氢氧化钠溶液反应生成盐和水的是( )
A:三氧化硫 B:二氧化碳
C:氧化镁 D:稀硫酸1、把纯水、稀硫酸和氢氧化钠三种无色溶液区别开的最简单的方法是( )
A:滴入酚酞试液 B:滴入石蕊试液
C:滴入氯化钡溶液 D:通入二氧化碳气体BCACB2NaOH+CuSO4=Cu(OH)2↓+Na2SO42NaOH+CO2=Na2CO3+H2ONaOH+HCl=NaCl+H2O直面中考7、(2006广州)A、B、C、D、E、F、G都是初中化学常见物质。其中A是酸,C、D是盐,E、F是碱,它们相互可以发生如下变化:
①A+E=D+G
②2A+B=C+H2 ↑
③2E+C=F ↓ +2D
根据上述信息,回答:
⑴ G的化学式是—— ,A的化学式是——。
⑵在化合物C中,元素B呈现的化合价是——,含有B元素的化合物除了C外还有——〔填A、B、C、D、E、F、G等符号〕
⑶写出符合反应③的一个化学方程式
—————————。+2FHClH2O2NaOH+MgCl2=Mg(OH)2 ↓+2NaCl直面中考谢谢指导
再 见
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
