化学平衡移动(浙江省台州市温岭市)
文档属性
| 名称 | 化学平衡移动(浙江省台州市温岭市) |  | |
| 格式 | rar | ||
| 文件大小 | 63.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-22 17:59:00 | ||
图片预览






文档简介
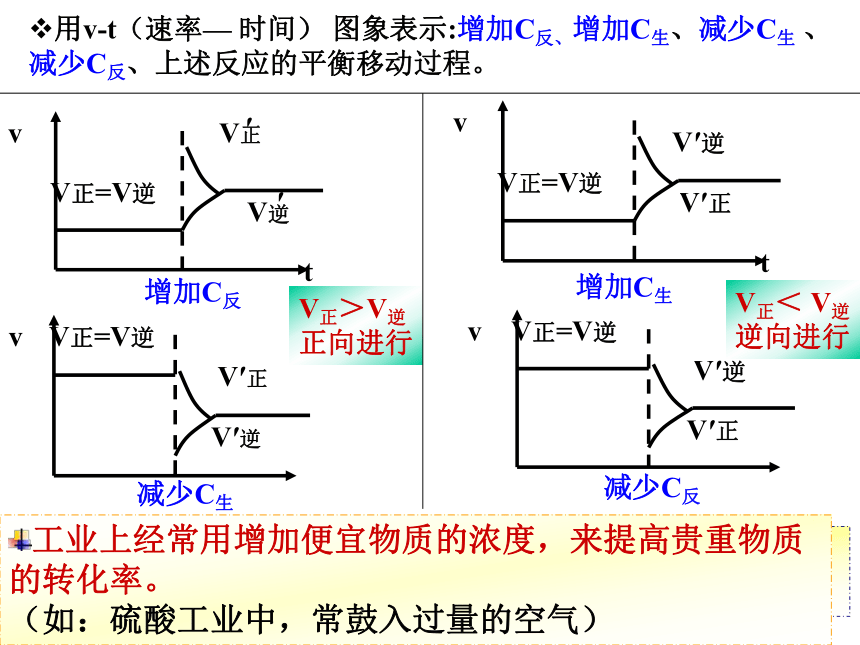
课件18张PPT。化学平衡的移动用v-t(速率— 时间) 图象表示:增加C反、增加C生、减少C生 、减少C反、上述反应的平衡移动过程。总结:增大反应物浓度或减少生成物浓度,平衡正移;
减少反应物浓度或增大生成物浓度,平衡逆移。V正< V逆
逆向进行V正>V逆
正向进行工业上经常用增加便宜物质的浓度,来提高贵重物质的转化率。
(如:硫酸工业中,常鼓入过量的空气)总结:增大反应物浓度或减少生成物浓度,平衡正移;
减少反应物浓度或增大生成物浓度,平衡逆移。固体的浓度是个常数,改变它们的量对V无影响,所以平衡不移动。 反应NH4HS(固) NH3+H2S在某温度下达到平衡,下列各种情况中,平衡不发生移动的是:
其它条件不变时,通入SO2气体
移走一部分的NH4HS固体
容器体积不变充入N2
压强不变充入N2总结:增大反应物浓度或减少生成物浓度,平衡正移;
减少反应物浓度或增大生成物浓度,平衡逆移。1、对于密闭容器中进行的反应:2SO2+O2 2SO3,如果温度保持不变,减少SO2的浓度,下列叙述正确的是:
A、正反应速率始终不变
B、逆反应速率逐渐减小
C、正反应速率比原始速率要慢
D、逆反应速率比原始速率要快压强对平衡的影响本质:压强对化学平衡的影响压强影响体积→ 体积影响浓度→ 正、逆速率不同→ 平衡移动∵压强的改变对无气体参加的反应的 v 无影响
∴方程式中无气体(反应物以及产物)的反应,改变压强,平衡不移动。→ 浓度影响速率压强对化学平衡的影响加压向气体分子数减小的方向进行;
减压向气体分子数增多的方向进行;
对于气体分子数两边相等的反应,改变压强平衡不移动。画出N2 + 3H2 2NH3,I2(g)+H2 2HI
加压、减压v-t(速率— 时间) 图像压强对气体分子数多的影响更大1、H2+I2(g) 2HI反应中达平衡时,加压后下列说法正确的是:
A、平衡不移动 B、 H2的物质的量增大
C、 [H2]增大 D、加压后平衡的速率比原来要大
E、 H2%增大 2、在已经处于化学平衡的体系中,如果下列量发生变化一定能表明平衡发生移动是( )
A、反应混合物的浓度 B、正、逆反应速率
C、反应混合物的压强 D、各组分所占的百分含量
E、反应物的转化率速率改变,平衡不一定移动,只有改变后V正≠V逆才会移动P↑,n减少方向移动;P↓,n增多方向移动;3、将等物质的量的A、B、C、D四种物质混合,发生如下反应: aA + bB cC(固)+ dD,当反应进行一段时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时反应达到平衡。
(1)该反应方程式中,各物质的系数分别为:
a=______,b=_______,c=_______,d=_______
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A_____,B_____,D_______ 4、在相同的A、B密闭容器中分别充入2mol的SO2和1molO2,使它们在一定温度下反应,并达新平衡:
2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为:
A、25% B、大于25%
C、小于25% D、无法判断 2A + B 3C(固) + 2D P↑,n减少方向移动;P↓,n增多方向移动;P↑,n减少方向移动;P↓,n增多方向移动;6、已知N2 + 3H2 2NH3在一密闭容器中反应达平后。
①体积不变,充入一定量的稀有气体平衡是否移动?
②压强不变,充入一定量的稀有气体平衡是否移动? 【例题】某温度下,在固定容积的容器中,可逆反应:N2+3H2 2NH3,达到平衡时:N2:H2:NH3=1:3:2。
再向反应体系中再投入N2:H2:NH3物质的量之比为1:3:2的混合气体,则达到平衡时,则两次达到平衡的N2的转化率的大小关系如何?改变压强对浓度的影响是成比例的
因而对浓度成比例的改变导致的影响相当于改变压强在 下,对
已达平衡的密闭容器中,再通入一定量的NO2气体,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断恒温恒压恒温恒容结合v –t 图象分析升、降温度对上反应化学平衡的影响:
1、升温,V正 、V逆相对大小如何?向什么方向移动?
2、降温,V正 、V逆相对大小如何?向什么方向移动?
升高温度,对吸热反应速率增大更有利,
降低温度,对吸热反应影响也更大温度对化学平衡的影响 在其它条件不变的情况下
升温,使平衡朝着吸热的方向移动;
降温,使平衡朝着放热方向移动1、对于mA(g)+ nB(g) pC(g)+ qD(g)的平衡体系,当升高温度时,体系的平均分子量从16.9变16.5,则下列判断正确的是:
A、m+n>p+q,正反应放热 B、 m+n>p+q,正反应吸热
C、m+n降温,使平衡朝着放热方向移动催化剂对化学平衡的影响——对“正催化剂”而言同等程度的加快正、逆反应速率(V正=V逆);对化学平衡无影响。
催化剂能缩短平衡到达的时间A、E2、对于mA(g)+ nB(g) pC(g) ;△H (已知m+n>p, △H >0)在密闭容器中处于平衡状态,则下列判断正确的是:
当升高温度时,[B]/[C]的比值减小
当降低温度时,新的平衡体系的平均分子量减小
加入B,A的转化率增大
加入催化剂,平衡体系中气体的总的物质的量不变
充入C,则A、B的物质的量增大
A、⑶⑷ B、 ⑴⑵⑸ C、⑵⑶⑸ D、 全部D加入催化剂,对化学平衡无影响,只会加快达到平衡的时间减弱示例:
1、对NO2的平衡体系改变压强
2、向平衡体系中加入一种反应物,可以提高另一反应物的转化率,但其本身转化率反而降低。
平衡移动原理——勒夏特列原理 对于已达平衡的可逆反应,如果改变影响平衡的一个因素,平衡将向着减弱这种改变的方向移动。注意事项
1、是“减弱”这种改变,不是“消除”这种改变
2、其他条件恒定,只有一个条件改变,才能应用
3、勒夏特列原理适用于任何移动的平动态衡体系(如:溶解平衡、电离平衡等)。判断当反应达平衡时,对反应体系加压,容器内颜色如何变化?
加压:V加快;加压 →深 →浅,但最后比原平衡要深
当反应达平衡时,对反应体系减压, 容器内颜色如何变化?
减压:V减慢;减压→浅→深,但最后比原平衡要浅加压后达新平衡与原平衡相比,n总增大还是减小?密度、平均分子量又如何变化的呢?物 化物 化 ;△H <0下列现象可利用勒夏特列原理解释的有:CO2难溶于饱和的NaHCO3溶液
由H2、I2(g)、 HI组成的平衡体系,加压后颜色加深
由H2、I2(g)、 HI组成的平衡体系,加热后颜色加深(体积不变)
实验室常用饱和食盐水除去Cl2中的HCl
加压可使CO2在水中溶解度增大
在醋酸中加入足量NaOH,可使醋酸几乎完全电离
密闭、低温是保存氨水的必要条件
煅烧CaCO3制备CO2时,粉末状比块状燃烧充分。勒沙特列原理适用于任何移动的动态平衡体系
减少反应物浓度或增大生成物浓度,平衡逆移。V正< V逆
逆向进行V正>V逆
正向进行工业上经常用增加便宜物质的浓度,来提高贵重物质的转化率。
(如:硫酸工业中,常鼓入过量的空气)总结:增大反应物浓度或减少生成物浓度,平衡正移;
减少反应物浓度或增大生成物浓度,平衡逆移。固体的浓度是个常数,改变它们的量对V无影响,所以平衡不移动。 反应NH4HS(固) NH3+H2S在某温度下达到平衡,下列各种情况中,平衡不发生移动的是:
其它条件不变时,通入SO2气体
移走一部分的NH4HS固体
容器体积不变充入N2
压强不变充入N2总结:增大反应物浓度或减少生成物浓度,平衡正移;
减少反应物浓度或增大生成物浓度,平衡逆移。1、对于密闭容器中进行的反应:2SO2+O2 2SO3,如果温度保持不变,减少SO2的浓度,下列叙述正确的是:
A、正反应速率始终不变
B、逆反应速率逐渐减小
C、正反应速率比原始速率要慢
D、逆反应速率比原始速率要快压强对平衡的影响本质:压强对化学平衡的影响压强影响体积→ 体积影响浓度→ 正、逆速率不同→ 平衡移动∵压强的改变对无气体参加的反应的 v 无影响
∴方程式中无气体(反应物以及产物)的反应,改变压强,平衡不移动。→ 浓度影响速率压强对化学平衡的影响加压向气体分子数减小的方向进行;
减压向气体分子数增多的方向进行;
对于气体分子数两边相等的反应,改变压强平衡不移动。画出N2 + 3H2 2NH3,I2(g)+H2 2HI
加压、减压v-t(速率— 时间) 图像压强对气体分子数多的影响更大1、H2+I2(g) 2HI反应中达平衡时,加压后下列说法正确的是:
A、平衡不移动 B、 H2的物质的量增大
C、 [H2]增大 D、加压后平衡的速率比原来要大
E、 H2%增大 2、在已经处于化学平衡的体系中,如果下列量发生变化一定能表明平衡发生移动是( )
A、反应混合物的浓度 B、正、逆反应速率
C、反应混合物的压强 D、各组分所占的百分含量
E、反应物的转化率速率改变,平衡不一定移动,只有改变后V正≠V逆才会移动P↑,n减少方向移动;P↓,n增多方向移动;3、将等物质的量的A、B、C、D四种物质混合,发生如下反应: aA + bB cC(固)+ dD,当反应进行一段时间后,测得A减少了nmol,B减少了n/2mol,C增加了3n/2mol,D增加了nmol,此时反应达到平衡。
(1)该反应方程式中,各物质的系数分别为:
a=______,b=_______,c=_______,d=_______
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A_____,B_____,D_______ 4、在相同的A、B密闭容器中分别充入2mol的SO2和1molO2,使它们在一定温度下反应,并达新平衡:
2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为:
A、25% B、大于25%
C、小于25% D、无法判断 2A + B 3C(固) + 2D P↑,n减少方向移动;P↓,n增多方向移动;P↑,n减少方向移动;P↓,n增多方向移动;6、已知N2 + 3H2 2NH3在一密闭容器中反应达平后。
①体积不变,充入一定量的稀有气体平衡是否移动?
②压强不变,充入一定量的稀有气体平衡是否移动? 【例题】某温度下,在固定容积的容器中,可逆反应:N2+3H2 2NH3,达到平衡时:N2:H2:NH3=1:3:2。
再向反应体系中再投入N2:H2:NH3物质的量之比为1:3:2的混合气体,则达到平衡时,则两次达到平衡的N2的转化率的大小关系如何?改变压强对浓度的影响是成比例的
因而对浓度成比例的改变导致的影响相当于改变压强在 下,对
已达平衡的密闭容器中,再通入一定量的NO2气体,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断恒温恒压恒温恒容结合v –t 图象分析升、降温度对上反应化学平衡的影响:
1、升温,V正 、V逆相对大小如何?向什么方向移动?
2、降温,V正 、V逆相对大小如何?向什么方向移动?
升高温度,对吸热反应速率增大更有利,
降低温度,对吸热反应影响也更大温度对化学平衡的影响 在其它条件不变的情况下
升温,使平衡朝着吸热的方向移动;
降温,使平衡朝着放热方向移动1、对于mA(g)+ nB(g) pC(g)+ qD(g)的平衡体系,当升高温度时,体系的平均分子量从16.9变16.5,则下列判断正确的是:
A、m+n>p+q,正反应放热 B、 m+n>p+q,正反应吸热
C、m+n
催化剂能缩短平衡到达的时间A、E2、对于mA(g)+ nB(g) pC(g) ;△H (已知m+n>p, △H >0)在密闭容器中处于平衡状态,则下列判断正确的是:
当升高温度时,[B]/[C]的比值减小
当降低温度时,新的平衡体系的平均分子量减小
加入B,A的转化率增大
加入催化剂,平衡体系中气体的总的物质的量不变
充入C,则A、B的物质的量增大
A、⑶⑷ B、 ⑴⑵⑸ C、⑵⑶⑸ D、 全部D加入催化剂,对化学平衡无影响,只会加快达到平衡的时间减弱示例:
1、对NO2的平衡体系改变压强
2、向平衡体系中加入一种反应物,可以提高另一反应物的转化率,但其本身转化率反而降低。
平衡移动原理——勒夏特列原理 对于已达平衡的可逆反应,如果改变影响平衡的一个因素,平衡将向着减弱这种改变的方向移动。注意事项
1、是“减弱”这种改变,不是“消除”这种改变
2、其他条件恒定,只有一个条件改变,才能应用
3、勒夏特列原理适用于任何移动的平动态衡体系(如:溶解平衡、电离平衡等)。判断当反应达平衡时,对反应体系加压,容器内颜色如何变化?
加压:V加快;加压 →深 →浅,但最后比原平衡要深
当反应达平衡时,对反应体系减压, 容器内颜色如何变化?
减压:V减慢;减压→浅→深,但最后比原平衡要浅加压后达新平衡与原平衡相比,n总增大还是减小?密度、平均分子量又如何变化的呢?物 化物 化 ;△H <0下列现象可利用勒夏特列原理解释的有:CO2难溶于饱和的NaHCO3溶液
由H2、I2(g)、 HI组成的平衡体系,加压后颜色加深
由H2、I2(g)、 HI组成的平衡体系,加热后颜色加深(体积不变)
实验室常用饱和食盐水除去Cl2中的HCl
加压可使CO2在水中溶解度增大
在醋酸中加入足量NaOH,可使醋酸几乎完全电离
密闭、低温是保存氨水的必要条件
煅烧CaCO3制备CO2时,粉末状比块状燃烧充分。勒沙特列原理适用于任何移动的动态平衡体系
