2007年广东省普宁市第一中学高三级第二次阶段考化学科试卷[上学期]
文档属性
| 名称 | 2007年广东省普宁市第一中学高三级第二次阶段考化学科试卷[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 188.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-01 00:00:00 | ||
图片预览



文档简介
课件中心精品资料 www. 找精品资料 到课件中心
2007年广东省普宁市第一中学高三级第二次阶段考试
化学科试题卷 2006年10月20日
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分。考试用时120分钟。
注意事项:
1. 答卷前,考生务必将自己的姓名、考生号,用钢笔或签字笔填写在答题卡密封线内。
2.选择题(一、二题)每小题选出答案后,用B型铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡
擦干净后,再选涂其他答案,不能答在试题卷上。
3.非选择题(三、四、五题)必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡指定区域内的相应位置
如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
可能用到的相对原子质量:
H = 1 O = 16 C = 12 Ca = 40 Cu = 64 Na = 23 Si = 28
第Ⅰ卷选择题部分(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1、六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器行业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到八电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF D.SF6是极性分子
2、下列可用氢键来解释的是
A.浓的氢氟酸溶液中存在HF2-和H2F3- B.SiH4沸点比CH4高
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.H2O比H2S稳定,前者1000oC以上才分解,后者300 oC分解
3、用NA表示阿伏加德罗常数,下列叙述正确的是
A.通常情况下5.6LH2含0.5NA个原子
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.120gSiO2中共价键数目为4NA个
D.0.5L PH=2的H2SO4溶液中含0.005NA个H+
4、X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层子数是其次外
电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3
③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应物质的是
A.② B.①②③④ C.②④ D.②⑤⑥
5、已知(1) △H=-890.3 kJ·,现有和CO的混合气体共0.75 mol,完全燃烧后,生成气体和18 g液态水,并放出515.9 kJ热量,则CO燃烧的热化学方程式是
① △H=-566 kJ·
② △H=-283 kJ·
③ △H=-374.4 kJ·
④ △H=+1406.2KJ·
A.①② B.①③ C.②④ D.③④
6、某无水盐在30℃时的溶解度为50g,20℃时的溶解度为20g。若将100g质量分数为30%的该
盐溶液从30℃降到20℃,析出无水晶体的质量是
A.16 g; B.12 g; C.10 g ; D.1 g;
7、维生素E在国外美称之“生命奇迹丸”,是一种脂溶性维生素,对抗衰老等有特殊作用,
经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下
其中R为-CH2CH2CH2CH2[CH(CH3)CH2CH2CH2]2CH(CH3)2即:
上述互为同分异构体的是
A.α β B.β γ C.γ δ D.α δ
8、在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
9、实验室将NaClO3和Na2SO3按物质的量为2 :1倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
10、有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A. B. C. D.
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意;若正确答案只包括一个选项,多选时,该题为0分。若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分。)
11、最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫
(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正
确的是
A.羰基硫的电子式为: B.羰基硫属于非极性分子
C.羰基硫沸点比CO2低 D.羰基硫中三个原子处于同一直线上
12、在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
A.5:4 B.4:5 C.3:5 D.5:6
13、在一定量饱和的澄清石灰水中,加入5.60克CaO后充分搅拌,静置恢复到原来的温度,发现石灰水下部有白色不溶物形成,则下列叙述正确的是
A.白色不溶物为CaO,其质量为5.60克
B.白色不溶物为Ca(OH)2,其质量为7.40克
C.石灰水的浓度和质量均不会变化
D.石灰水的质量将会减少,石灰水的pH不会发生变化
14、化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.分散系的分类:
B.常温条件下,酚酞的变色范围:
C.HCl和NaAlO2溶液反应后铝元素的存在形式:
D.CO2通入澄清石灰水中反应的产物:
15、一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、HCO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
16、下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7,
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA )+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
17、近年来南通建设了多个主题广场,为市民提供了夏夜纳凉的好去处,夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为
下列有关说法正确的是
A.草酸二酯属于芳香族化合物 B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
18、FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应生成H2S2,H2S2类似于H2O2,易分解:H2S2 = H2S + S↓。实验室制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是
A.FeS B.H2S C.S D.FeCl3
19、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。则a、b正确的答案组合是
A.9~11之间; 0.1 B.9~11之间; 0.2
C.12~13之间; 0.2 D.13; 0.1
20、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
则下列说法正确的是
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42-PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2OPbO2+SO42-+4H+
第Ⅱ卷非选择题部分(共80分)
三、(本题包括3小题,共31分)
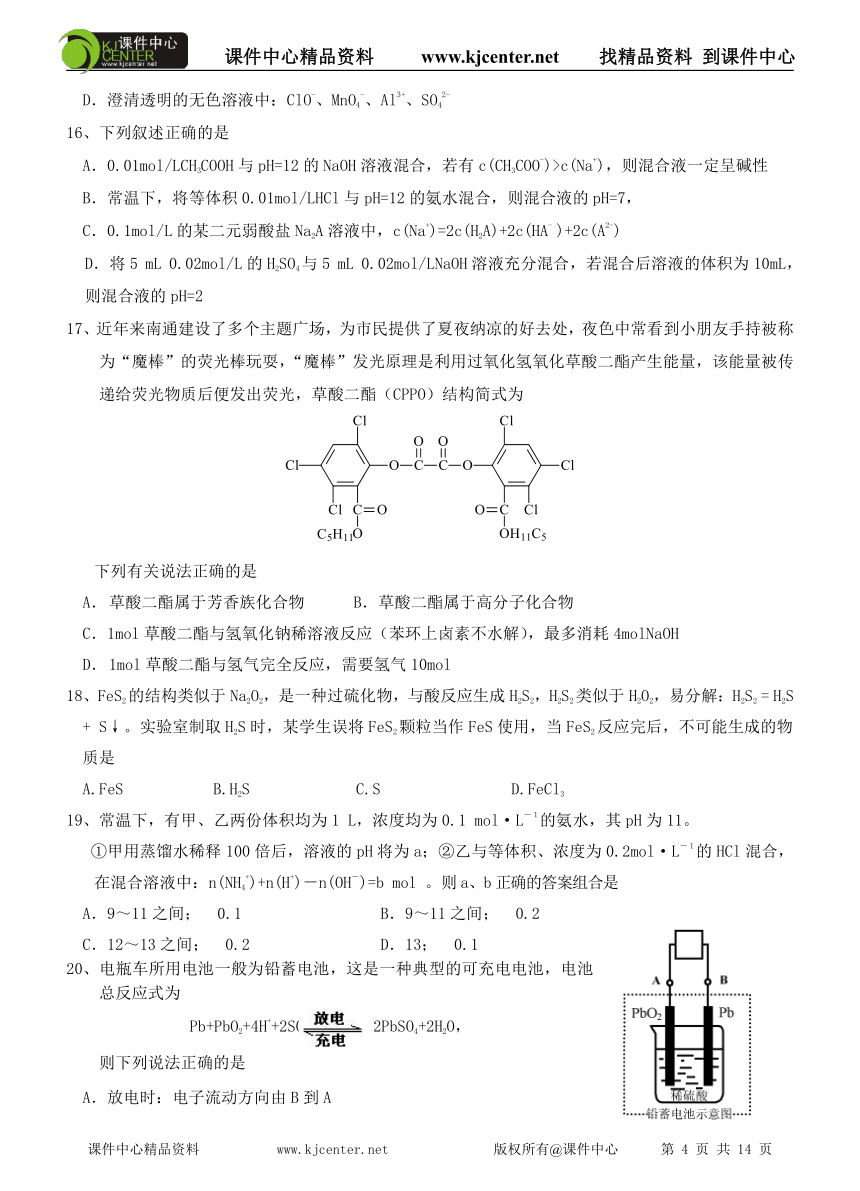
21、(7分)右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛
(2)检验:证明CO中混有CO2,装置内应盛
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的
端通人(填A或B,下同);若收集比空气重的气体,则
气体从 端通入。若用排水法收集O2时,瓶内应先装满水,
气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
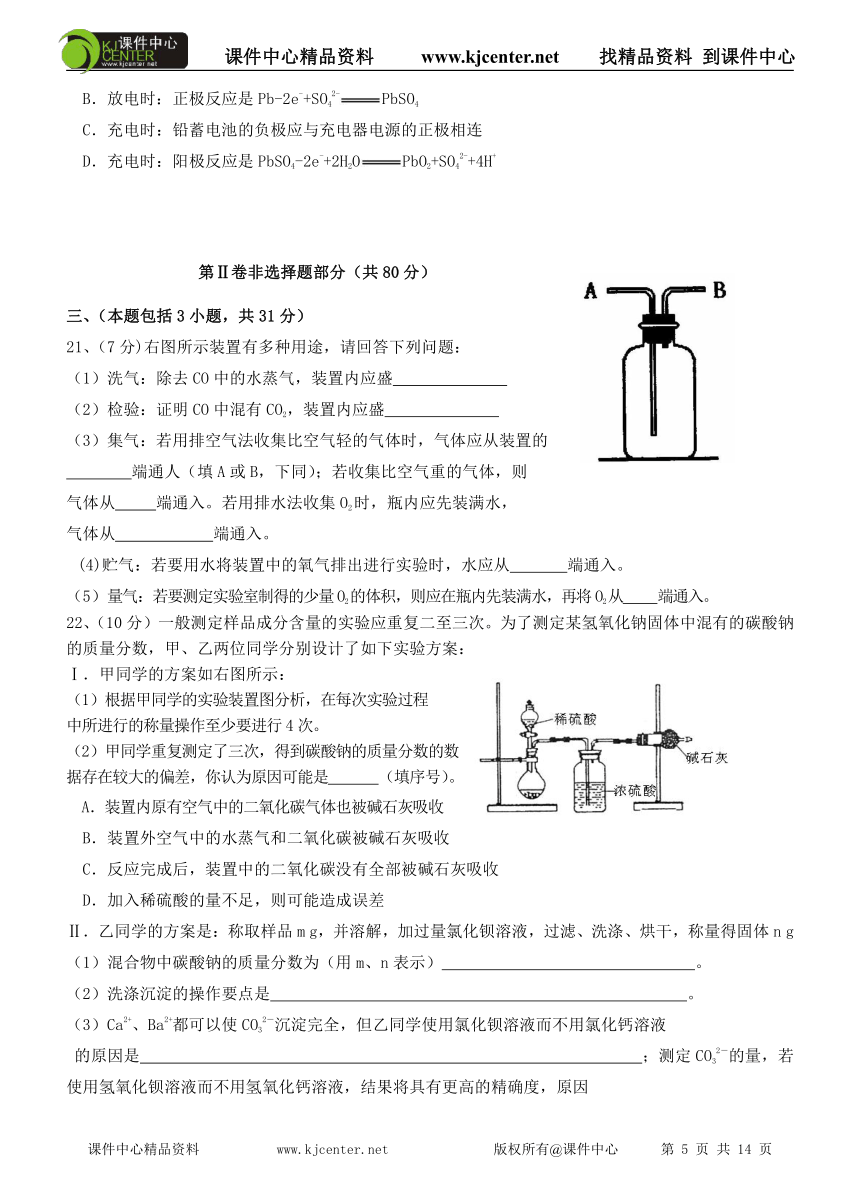
22、(10分)一般测定样品成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程
中所进行的称量操作至少要进行4次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数
据存在较大的偏差,你认为原因可能是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
Ⅱ.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是 。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液
的原因是 ;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因
是 。
23、(14分)某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
四、(本题包括3小题,共30 分)
24、 (6分)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A、O4分子内存在极性共价键 B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体 D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O、O甚至O的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22-的电子式: 。
(4)化合物O2[PtF6]中含有O,则O2[PtF6]属于____________化合物,有一种常见的含有钾元素和O的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:
____________________________________________________________
25、(Ⅰ)(6分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
若上述关系中④是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“大小”、“小于”、或“等于”,下同) c(NH3·H2O),混合前盐酸中c(H+)
和氨水中c(OH-)的关系c(H+) c(OH-)。
(Ⅱ)(5分)在密闭容器中,通入AmolN2和BmolH2,在一定条件下达到平衡,容器中还剩余CmolN2,
(1)生成NH3的物质的量为 ; (2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率 ,逆反应速率 ,
N2转化率 。(填“变大”、“变小”、“不变”)
26、(13分)下图A—J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A—E和F—J中分别含有同一种元素。反应E→A+O2的条件未标出。
请填写下列空白:
(1)化合物H中的阳离子_______;D的化学式___________。
(2)A生成B反应的离子方程式是______________________________________。
(3)A和F的混合物叫做___________,发生反应的化学方程式是:
_________________________________________________________________。
(4)I→J反应的化学方程式是___________________________________________。
该反应过程中发生的现象是______________________________________。
五、(本题包括2小题,共19 分)
27、(8分)已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题:
(1)在(I)~(Ⅵ)6个反应中,属于取代反应的是(填反应编号) 。
(2)写出物质的结构简式:F ,I 。
(3)写出B转化为D的化学方程式: 。
28、 (11分)普鲁卡因为白色、细微的针状晶体,易溶于水;其针剂常用于临床局部麻醉剂。普鲁卡因的结构简式为:
已知: ①将环氧乙烷()通到二乙胺 的醇溶液中可制备二乙胺基乙醇
②烷基苯的支链可以氧化成羧基,如
③硝基苯在铁和盐酸的作用下,能被还原成苯胺()
利用这些反应,可按以下步骤从甲苯得到普鲁卡因,其转变关系如下(X、Y分别为加入的试剂):
普鲁卡因
请填写下列空白:
(1)普鲁卡因在一定条件下水解的化学方程式____________ __________;
(2)写出下列物质的结构简式
A______ _____;B____ _______;C________ ___。
(3)所加试剂X、Y分别为
X______________________;Y______________________。
(4)各反应的类型是
I___________;II___________;III___________;IV___________。
2007年广东省普宁市第一中学高三级第二次阶段考试
化学答题卷
题 号 一 二 三 四 五 总 分总 分
分 数
选择题答题区,用2B铅笔填涂。
一、选择题(单项选择) 二、选择题(一至二项选择)
非选择题区,用黑色字迹的钢笔或签字笔在规定区域内作答,否则答案无效。
三、(本题共3小题,共32分)
21、⑴ ⑵ ⑶ 、 、 ⑷ ⑸
22、 Ⅰ.⑵
Ⅱ.⑴
⑵
。
⑶ 原因是
;
原因是
。
23、实验Ⅰ:目的是_________________________________________________________
实验Ⅱ:红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
产生血红色 现象的离子方程式是 。
实验Ⅲ:结论___________________________________________________________________
离子方程式______________________________________________________
①__________________________
②_____________________________
四、(本题共3小题,共30分)
24、 (1) (2) 、
(3)
(4) 、
25、(Ⅰ) ⑴ 、 ⑵
⑶ 、
(Ⅱ)⑴ ⑵ ⑶ 、 、
26、⑴ 、 ⑵
⑶ 、
⑷方程式是
现象是
五、(本题共2小题,共18分)
27、(1) (2)F I
(3)
28、(1)方程式 ;
(2)写出下列物质的结构简式
A ;B ;C 。
(3)所加试剂X、Y分别为
X ;Y 。
(4)各反应的类型是
I ;II ;III ;IV 。
2007年广东省普宁市第一中学高三级第二次阶段考试
化学科参考答案
1 C 2 A 3 D 4 B 5 A 6 A 7 B 8 B 9 C 10 B 11 AD 12 D 13 D 14 AC 15 B
16 CD 17 A 18 AD 19 B 20 AD
21、(1)浓H2SO4(2)澄清石灰水(3)B;A。B。(4)A (5)B
22、 Ⅰ. (2)A、B、C、D
Ⅱ.(1)106n/197m
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2—3次
(3)过量的Ca2+可与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果;
碳酸钡的相对分子质量比碳酸钙大,在CO32-的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的相对误差较小
23、实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色;有气泡产生;
Fe3+ + 3SCN—==Fe(SCN)3
实验Ⅲ:Fe3+与SO32—同时发生氧化还原反应和双水解反应;
2Fe3++3CO32—+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32—有较强的还原性,CO32—没有还原性;②SO32—水解能力较CO32—小
24、 (1) CD (2) ② , ①③
(3) 〔∶O∶ O∶〕2-
(4)离子 4KO2 + 2CO2 = 2K2CO3+ 3O2
25、(Ⅰ) (1)Ⅰ 氯化铵 Ⅱ ① 。
(2)Ⅰ NH4Cl和NH3(或NH4Cl和NH3·H2O) ;Ⅱ NH4Cl和HCl 。
(3)Ⅰ 小于 ;Ⅱ 大于 。
(Ⅱ)(1)2(A-C)mol (2)3(A-C)/B (3)变大 变大 变大
26、⑴、Fe2+ ;Al(OH)3
⑵、2Al+2OH-+2H2O===2AlO2_+3H2↑
⑶、铝热剂 (1分);2Al+ Fe2O3===2Fe+ Al2O3
⑷、4Fe(OH)2+ O2 +2H2O === 4Fe(OH)3
白色絮状沉淀变为灰绿色,最后变为红褐色沉淀
27、 (1)I、Ⅲ、Ⅳ、Ⅴ(2分)(2);
(3)
28、(1)
(2) A为 B为
C为
(3)所加试剂:X—浓硝酸和浓硫酸 Y—铁和盐酸
(4)反应类型: I取代反应 II氧化反应 III酯化反应 IV还原反应
¨ ¨
¨ ¨
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
[A][A][A][A][A] [A][A][A][A][A] [A][A][A][A][A] [A][A][A][A][A]
[B][B][B][B][B] [B][B][B][B][B] [B][B][B][B][B] [B][B][B][B][B]
[C][C][C][C][C] [C][C][C][C][C] [C][C][C][C][C] [C][C][C][C][C]
[D][D][D][D][D] [D][D][D][D][D] [D][D][D][D][D] [D][D][D][D][D]
密
封
线
内
不
得
答
题
班级 姓名 考试号 试室号
②
③
①
课件中心精品资料 www. 版权所有@课件中心 第 14 页 共 14 页
2007年广东省普宁市第一中学高三级第二次阶段考试
化学科试题卷 2006年10月20日
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分。考试用时120分钟。
注意事项:
1. 答卷前,考生务必将自己的姓名、考生号,用钢笔或签字笔填写在答题卡密封线内。
2.选择题(一、二题)每小题选出答案后,用B型铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡
擦干净后,再选涂其他答案,不能答在试题卷上。
3.非选择题(三、四、五题)必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡指定区域内的相应位置
如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
可能用到的相对原子质量:
H = 1 O = 16 C = 12 Ca = 40 Cu = 64 Na = 23 Si = 28
第Ⅰ卷选择题部分(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1、六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器行业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫 B.SF6中各原子均达到八电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF D.SF6是极性分子
2、下列可用氢键来解释的是
A.浓的氢氟酸溶液中存在HF2-和H2F3- B.SiH4沸点比CH4高
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.H2O比H2S稳定,前者1000oC以上才分解,后者300 oC分解
3、用NA表示阿伏加德罗常数,下列叙述正确的是
A.通常情况下5.6LH2含0.5NA个原子
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.120gSiO2中共价键数目为4NA个
D.0.5L PH=2的H2SO4溶液中含0.005NA个H+
4、X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层子数是其次外
电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3
③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应物质的是
A.② B.①②③④ C.②④ D.②⑤⑥
5、已知(1) △H=-890.3 kJ·,现有和CO的混合气体共0.75 mol,完全燃烧后,生成气体和18 g液态水,并放出515.9 kJ热量,则CO燃烧的热化学方程式是
① △H=-566 kJ·
② △H=-283 kJ·
③ △H=-374.4 kJ·
④ △H=+1406.2KJ·
A.①② B.①③ C.②④ D.③④
6、某无水盐在30℃时的溶解度为50g,20℃时的溶解度为20g。若将100g质量分数为30%的该
盐溶液从30℃降到20℃,析出无水晶体的质量是
A.16 g; B.12 g; C.10 g ; D.1 g;
7、维生素E在国外美称之“生命奇迹丸”,是一种脂溶性维生素,对抗衰老等有特殊作用,
经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下
其中R为-CH2CH2CH2CH2[CH(CH3)CH2CH2CH2]2CH(CH3)2即:
上述互为同分异构体的是
A.α β B.β γ C.γ δ D.α δ
8、在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
9、实验室将NaClO3和Na2SO3按物质的量为2 :1倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
10、有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A. B. C. D.
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意;若正确答案只包括一个选项,多选时,该题为0分。若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分。)
11、最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫
(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正
确的是
A.羰基硫的电子式为: B.羰基硫属于非极性分子
C.羰基硫沸点比CO2低 D.羰基硫中三个原子处于同一直线上
12、在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
A.5:4 B.4:5 C.3:5 D.5:6
13、在一定量饱和的澄清石灰水中,加入5.60克CaO后充分搅拌,静置恢复到原来的温度,发现石灰水下部有白色不溶物形成,则下列叙述正确的是
A.白色不溶物为CaO,其质量为5.60克
B.白色不溶物为Ca(OH)2,其质量为7.40克
C.石灰水的浓度和质量均不会变化
D.石灰水的质量将会减少,石灰水的pH不会发生变化
14、化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.分散系的分类:
B.常温条件下,酚酞的变色范围:
C.HCl和NaAlO2溶液反应后铝元素的存在形式:
D.CO2通入澄清石灰水中反应的产物:
15、一定能在下列溶液中大量共存的离子组是
A.水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、HCO3-
B.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
16、下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7,
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA )+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
17、近年来南通建设了多个主题广场,为市民提供了夏夜纳凉的好去处,夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为
下列有关说法正确的是
A.草酸二酯属于芳香族化合物 B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
18、FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应生成H2S2,H2S2类似于H2O2,易分解:H2S2 = H2S + S↓。实验室制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是
A.FeS B.H2S C.S D.FeCl3
19、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。则a、b正确的答案组合是
A.9~11之间; 0.1 B.9~11之间; 0.2
C.12~13之间; 0.2 D.13; 0.1
20、电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
则下列说法正确的是
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42-PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2OPbO2+SO42-+4H+
第Ⅱ卷非选择题部分(共80分)
三、(本题包括3小题,共31分)
21、(7分)右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛
(2)检验:证明CO中混有CO2,装置内应盛
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的
端通人(填A或B,下同);若收集比空气重的气体,则
气体从 端通入。若用排水法收集O2时,瓶内应先装满水,
气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
22、(10分)一般测定样品成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程
中所进行的称量操作至少要进行4次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数
据存在较大的偏差,你认为原因可能是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
Ⅱ.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是 。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液
的原因是 ;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因
是 。
23、(14分)某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
四、(本题包括3小题,共30 分)
24、 (6分)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是
A、O4分子内存在极性共价键 B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体 D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O、O甚至O的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22-的电子式: 。
(4)化合物O2[PtF6]中含有O,则O2[PtF6]属于____________化合物,有一种常见的含有钾元素和O的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:
____________________________________________________________
25、(Ⅰ)(6分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
若上述关系中④是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“大小”、“小于”、或“等于”,下同) c(NH3·H2O),混合前盐酸中c(H+)
和氨水中c(OH-)的关系c(H+) c(OH-)。
(Ⅱ)(5分)在密闭容器中,通入AmolN2和BmolH2,在一定条件下达到平衡,容器中还剩余CmolN2,
(1)生成NH3的物质的量为 ; (2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率 ,逆反应速率 ,
N2转化率 。(填“变大”、“变小”、“不变”)
26、(13分)下图A—J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A—E和F—J中分别含有同一种元素。反应E→A+O2的条件未标出。
请填写下列空白:
(1)化合物H中的阳离子_______;D的化学式___________。
(2)A生成B反应的离子方程式是______________________________________。
(3)A和F的混合物叫做___________,发生反应的化学方程式是:
_________________________________________________________________。
(4)I→J反应的化学方程式是___________________________________________。
该反应过程中发生的现象是______________________________________。
五、(本题包括2小题,共19 分)
27、(8分)已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题:
(1)在(I)~(Ⅵ)6个反应中,属于取代反应的是(填反应编号) 。
(2)写出物质的结构简式:F ,I 。
(3)写出B转化为D的化学方程式: 。
28、 (11分)普鲁卡因为白色、细微的针状晶体,易溶于水;其针剂常用于临床局部麻醉剂。普鲁卡因的结构简式为:
已知: ①将环氧乙烷()通到二乙胺 的醇溶液中可制备二乙胺基乙醇
②烷基苯的支链可以氧化成羧基,如
③硝基苯在铁和盐酸的作用下,能被还原成苯胺()
利用这些反应,可按以下步骤从甲苯得到普鲁卡因,其转变关系如下(X、Y分别为加入的试剂):
普鲁卡因
请填写下列空白:
(1)普鲁卡因在一定条件下水解的化学方程式____________ __________;
(2)写出下列物质的结构简式
A______ _____;B____ _______;C________ ___。
(3)所加试剂X、Y分别为
X______________________;Y______________________。
(4)各反应的类型是
I___________;II___________;III___________;IV___________。
2007年广东省普宁市第一中学高三级第二次阶段考试
化学答题卷
题 号 一 二 三 四 五 总 分总 分
分 数
选择题答题区,用2B铅笔填涂。
一、选择题(单项选择) 二、选择题(一至二项选择)
非选择题区,用黑色字迹的钢笔或签字笔在规定区域内作答,否则答案无效。
三、(本题共3小题,共32分)
21、⑴ ⑵ ⑶ 、 、 ⑷ ⑸
22、 Ⅰ.⑵
Ⅱ.⑴
⑵
。
⑶ 原因是
;
原因是
。
23、实验Ⅰ:目的是_________________________________________________________
实验Ⅱ:红褐色“液体”是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
产生血红色 现象的离子方程式是 。
实验Ⅲ:结论___________________________________________________________________
离子方程式______________________________________________________
①__________________________
②_____________________________
四、(本题共3小题,共30分)
24、 (1) (2) 、
(3)
(4) 、
25、(Ⅰ) ⑴ 、 ⑵
⑶ 、
(Ⅱ)⑴ ⑵ ⑶ 、 、
26、⑴ 、 ⑵
⑶ 、
⑷方程式是
现象是
五、(本题共2小题,共18分)
27、(1) (2)F I
(3)
28、(1)方程式 ;
(2)写出下列物质的结构简式
A ;B ;C 。
(3)所加试剂X、Y分别为
X ;Y 。
(4)各反应的类型是
I ;II ;III ;IV 。
2007年广东省普宁市第一中学高三级第二次阶段考试
化学科参考答案
1 C 2 A 3 D 4 B 5 A 6 A 7 B 8 B 9 C 10 B 11 AD 12 D 13 D 14 AC 15 B
16 CD 17 A 18 AD 19 B 20 AD
21、(1)浓H2SO4(2)澄清石灰水(3)B;A。B。(4)A (5)B
22、 Ⅰ. (2)A、B、C、D
Ⅱ.(1)106n/197m
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2—3次
(3)过量的Ca2+可与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果;
碳酸钡的相对分子质量比碳酸钙大,在CO32-的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的相对误差较小
23、实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色;有气泡产生;
Fe3+ + 3SCN—==Fe(SCN)3
实验Ⅲ:Fe3+与SO32—同时发生氧化还原反应和双水解反应;
2Fe3++3CO32—+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32—有较强的还原性,CO32—没有还原性;②SO32—水解能力较CO32—小
24、 (1) CD (2) ② , ①③
(3) 〔∶O∶ O∶〕2-
(4)离子 4KO2 + 2CO2 = 2K2CO3+ 3O2
25、(Ⅰ) (1)Ⅰ 氯化铵 Ⅱ ① 。
(2)Ⅰ NH4Cl和NH3(或NH4Cl和NH3·H2O) ;Ⅱ NH4Cl和HCl 。
(3)Ⅰ 小于 ;Ⅱ 大于 。
(Ⅱ)(1)2(A-C)mol (2)3(A-C)/B (3)变大 变大 变大
26、⑴、Fe2+ ;Al(OH)3
⑵、2Al+2OH-+2H2O===2AlO2_+3H2↑
⑶、铝热剂 (1分);2Al+ Fe2O3===2Fe+ Al2O3
⑷、4Fe(OH)2+ O2 +2H2O === 4Fe(OH)3
白色絮状沉淀变为灰绿色,最后变为红褐色沉淀
27、 (1)I、Ⅲ、Ⅳ、Ⅴ(2分)(2);
(3)
28、(1)
(2) A为 B为
C为
(3)所加试剂:X—浓硝酸和浓硫酸 Y—铁和盐酸
(4)反应类型: I取代反应 II氧化反应 III酯化反应 IV还原反应
¨ ¨
¨ ¨
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
[A][A][A][A][A] [A][A][A][A][A] [A][A][A][A][A] [A][A][A][A][A]
[B][B][B][B][B] [B][B][B][B][B] [B][B][B][B][B] [B][B][B][B][B]
[C][C][C][C][C] [C][C][C][C][C] [C][C][C][C][C] [C][C][C][C][C]
[D][D][D][D][D] [D][D][D][D][D] [D][D][D][D][D] [D][D][D][D][D]
密
封
线
内
不
得
答
题
班级 姓名 考试号 试室号
②
③
①
课件中心精品资料 www. 版权所有@课件中心 第 14 页 共 14 页
同课章节目录
