溶液的配制及分析
图片预览






文档简介
课件15张PPT。溶液的配制及分析想一想图片中的标签中的数字表示什么含义?物质的量浓度
1、定义:单位物质体积的溶液中所含有的溶质B的物质的量。
2、表达式:c(B) = (溶液)
3、单位:mol/L 1、将53.0g的碳酸钠溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是多少?
2、配制250mL 0.200mol/L 的NaCl溶液,需要多少克的NaCl固体。试一试1mol/L2.925g练一练1、用1molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L。
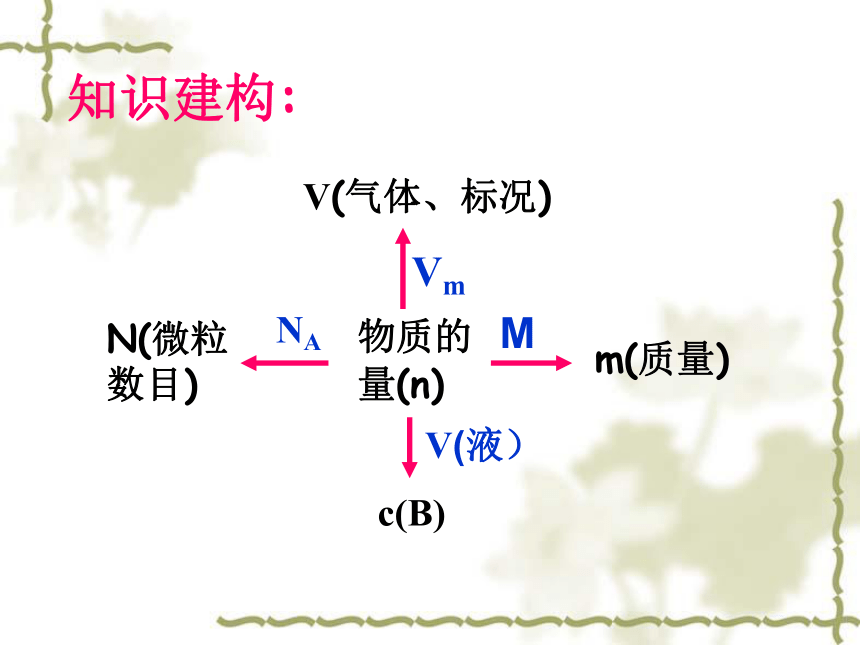
2、从1L 1mol/LNaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?所含溶质各是多少克?22是; 5.85g; 0.585g; 0.0585g知识建构:物质的量(n)N(微粒数目)m(质量)V(气体、标况)c(B)MVmV(液)NA 请你设想怎样来建立这个物理量。并能进行溶液体积和溶质物质的量之间的换算。
例:在40g密度为dg/cm3的硫酸铁溶液中,含有1.4gFe3+离子,则此溶液中Fe3+的物质的量浓度为( )
A.3/8d B.15/16d C.5/16 d D.5/8d算一算
√一定物质的量浓度溶液的配制配制步骤:
1 、计算 2、称量(或量取)
3、溶解 4、转移
5、洗涤 6、定容
7、摇匀 8、装瓶贴签 容量瓶的使用:
1、选择合适的容量瓶
2、检验是否漏水
3、容量瓶的使用六忌:
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯
视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量
器,不是容器) 溶液配制过程注意事项:
1、用量筒取液体试剂时,洗量筒的液体不能
再倒入烧杯中。 2、烧杯及玻璃棒的洗涤液要倒入容量瓶。 3、在液面接近容量瓶的刻度线2—3cm时,应
改用胶头滴管。 4、读数时,视线应与溶液的凹液面恰好相切。 5、容量瓶是配制溶液的容器,不是装试剂用
的容器。 6、若用浓硫酸配制稀硫酸时,一定要注意将
浓硫酸慢慢用玻璃棒引流到水中。切不可相
反操作。误差分析: 现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,应选用的量筒是 (填代号)。算一算
2、7、85.4mL① (3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处。改用 加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。 500引流烧杯和玻璃棒2~3cm胶头滴管凹液面恰好与视线相切 (4)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中。②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中。③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4。④定容时,加蒸馏水超过标线,又用胶头滴管吸出。⑤转移前,容量瓶中含有少量蒸馏水。⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线。⑦定容时,俯视标线1234671、7
1、定义:单位物质体积的溶液中所含有的溶质B的物质的量。
2、表达式:c(B) = (溶液)
3、单位:mol/L 1、将53.0g的碳酸钠溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是多少?
2、配制250mL 0.200mol/L 的NaCl溶液,需要多少克的NaCl固体。试一试1mol/L2.925g练一练1、用1molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L。
2、从1L 1mol/LNaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?所含溶质各是多少克?22是; 5.85g; 0.585g; 0.0585g知识建构:物质的量(n)N(微粒数目)m(质量)V(气体、标况)c(B)MVmV(液)NA 请你设想怎样来建立这个物理量。并能进行溶液体积和溶质物质的量之间的换算。
例:在40g密度为dg/cm3的硫酸铁溶液中,含有1.4gFe3+离子,则此溶液中Fe3+的物质的量浓度为( )
A.3/8d B.15/16d C.5/16 d D.5/8d算一算
√一定物质的量浓度溶液的配制配制步骤:
1 、计算 2、称量(或量取)
3、溶解 4、转移
5、洗涤 6、定容
7、摇匀 8、装瓶贴签 容量瓶的使用:
1、选择合适的容量瓶
2、检验是否漏水
3、容量瓶的使用六忌:
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯
视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量
器,不是容器) 溶液配制过程注意事项:
1、用量筒取液体试剂时,洗量筒的液体不能
再倒入烧杯中。 2、烧杯及玻璃棒的洗涤液要倒入容量瓶。 3、在液面接近容量瓶的刻度线2—3cm时,应
改用胶头滴管。 4、读数时,视线应与溶液的凹液面恰好相切。 5、容量瓶是配制溶液的容器,不是装试剂用
的容器。 6、若用浓硫酸配制稀硫酸时,一定要注意将
浓硫酸慢慢用玻璃棒引流到水中。切不可相
反操作。误差分析: 现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,应选用的量筒是 (填代号)。算一算
2、7、85.4mL① (3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处。改用 加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。 500引流烧杯和玻璃棒2~3cm胶头滴管凹液面恰好与视线相切 (4)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中。②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中。③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4。④定容时,加蒸馏水超过标线,又用胶头滴管吸出。⑤转移前,容量瓶中含有少量蒸馏水。⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线。⑦定容时,俯视标线1234671、7
