专题一第二单元物质的分离和提纯(浙江省舟山市)
文档属性
| 名称 | 专题一第二单元物质的分离和提纯(浙江省舟山市) |  | |
| 格式 | rar | ||
| 文件大小 | 189.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-27 07:28:00 | ||
图片预览






文档简介
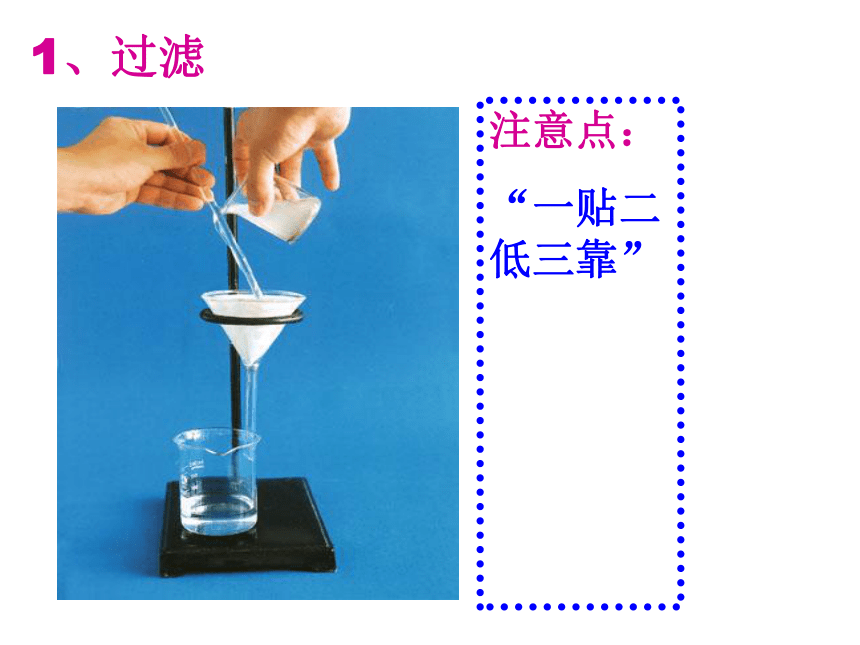
课件29张PPT。物质的分离和提纯 我们在初中化学里也学过一些简单的实验方法,可用于混合物的分离和提纯,请同学们回忆以下,你了解哪些分离、提纯的方法?过滤、结晶、蒸馏等【问题1】难溶固体与液体组成的混合物,例:Ca(OH)2溶液中悬浮CaCO3。溶解度不同的固体混合物,例:NaCl和KNO3混合物分离沸点相差较大(相差30℃以上)的液态混合物,例:实验室制蒸馏水. 不同的分离方法都有一定的适用范围,因此要根据不同混合物的性质来选择合适的分离方法.1、过滤注意点:
“一贴二低三靠”
蒸发
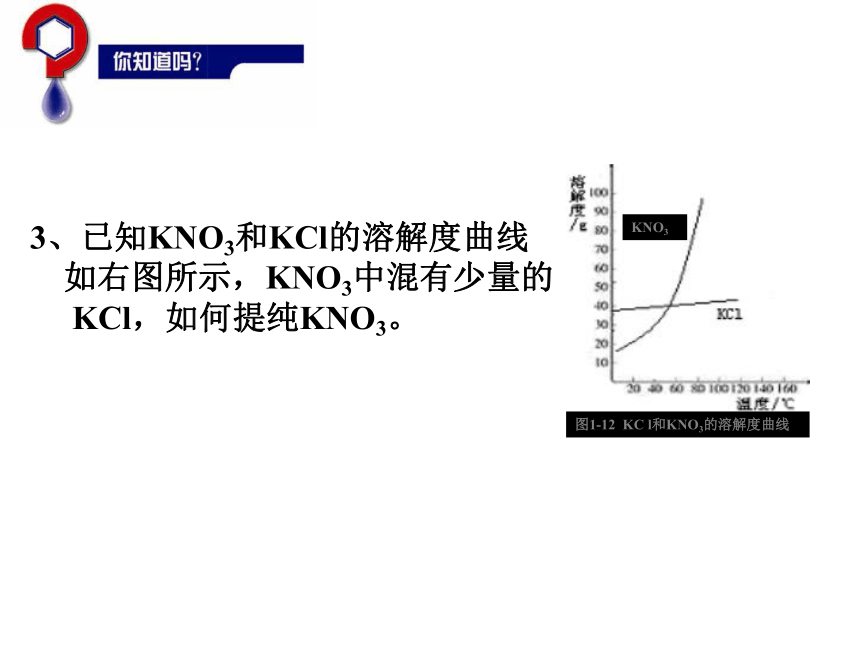
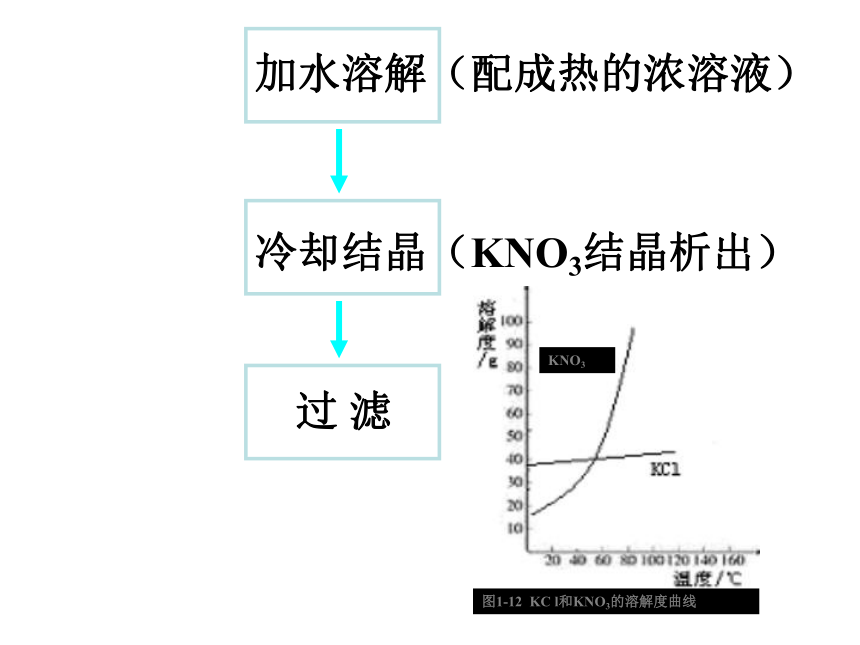
3、已知KNO3和KCl的溶解度曲线
如右图所示,KNO3中混有少量的
KCl,如何提纯KNO3。2、结晶适用于溶解度不同的固体混合物的分离,例:NaCl和KNO3混合物。【实验探究3】实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1mlCCl4,振荡、静置。现象:溴水呈橙色,溶液分层,上层几乎无色,下层呈橙红色。3、萃取利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一溶剂中,从而进行分离的方法称为萃取。选择的萃取剂应符合下列要求:
和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂,并且溶剂易挥发4、分液将互不相溶的液体混合物分离的方法。萃取和分液往往结合进行。【实验探究4】 某些地区的自来水中含有Fe3+,那么如何将含有Fe3+的自来水提纯呢?5、蒸馏利用互溶液体混合物中各组分沸点不同(通常沸点需相差30℃以上)进行分离提纯的操作。其过程是:将液态物质加热至沸点,使之汽化,然后将蒸气重新冷凝为液体的操作过程成为蒸馏。蒸馏实验示意图注意点:①实验前在蒸馏烧瓶中先加入几粒沸石(或碎瓷片)——防液体暴沸③冷凝水的方向:6、层析法【拓宽视野】【课堂小结】物质的分离、提纯注意:不同的分离方法都有一定的适用范围,要根据不同混合物的性质选择合适的方法进行分离,且有时需要多种方法配合使用。1、除去氯化钠中混有的泥沙
2、某地区的自来水中混有少量Fe3+,
实验室如何获得少量纯净的水。
3、已知KNO3和KCl的溶解度曲线
如右图所示,KNO3中混有少量的
KCl,如何提纯KNO3。现需要分离下列物质,请结合初中所学知识选择合适的物质分离方法:4、溴水中溶有少量的溴,如何将溴从水
中分离出来(溴在水中的溶解度较小)。 实验2方案
⑴加水溶解
⑵过滤
⑶加入过量BaCl2溶液
4.加入过量Na2CO3溶液
5.过滤
6.加入过量盐酸
7.加热、蒸发 实验3方案
⑴加水溶解
⑵过滤
⑶加入过量BaCl2溶液
⑷加入过量NaOH溶液
⑸加入过量Na2CO3溶液
⑹过滤
⑺加入过量盐酸
⑻加热、蒸发[练习与实践] 现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。 实 例 分离方法 选择的依据
除去澄清石灰水中的碳酸钙 蒸馏 溶解度随温度变化的差异
用CCl4提取溴水中溴单质 过滤 在不同溶剂中溶解度的差异
分离醋酸(沸点118℃)与乙醇(沸点78.5℃) 分液 沸点的差异较大
分离汽油和水 结晶 两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中提取硝酸钾 萃取 物质在水中溶解度的不同【实验探究3】实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1mlCCl4,振荡、静置。现象:溴水呈橙色,溶液分层,上层几乎无色,下层呈橙红色。实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1ml汽油(或苯),振荡、静置。现象:溴水呈橙色,溶液分层,下层几乎无色,上层呈橙红色。1.下列分离混合物的操作中,必须加热的是( )
A. 过滤 B.升华 C.结晶 D.蒸馏【练习】【实验探究2】 现有氯化钾和硝酸钾的固体混合物50g,其中KCl的质量分数为10%,请设计实验方案提纯硝酸钾。 2.下列实验操作:① 过滤 ② 分液 ③ 萃取 ④ 蒸馏 ⑤ 分馏。不能用于分离相互混溶的溶液的是( )
A? ③和④ B. ①和② C? ③、④和⑤ D. ①、②和③3、右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放 ;
(2)检验:证明CO中混有CO2,装置内应盛放 ; (3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A”或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。【实验探究1】 已知氢氧化镁难溶于水,硫酸钡既难溶于水,又难溶于酸,碳酸钡难溶于水,但可溶于盐酸。现有含硫酸钠、氯化镁和泥沙等杂质的粗食盐,请你设计实验方案,有粗食盐提纯氯化钠。
“一贴二低三靠”
蒸发
3、已知KNO3和KCl的溶解度曲线
如右图所示,KNO3中混有少量的
KCl,如何提纯KNO3。2、结晶适用于溶解度不同的固体混合物的分离,例:NaCl和KNO3混合物。【实验探究3】实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1mlCCl4,振荡、静置。现象:溴水呈橙色,溶液分层,上层几乎无色,下层呈橙红色。3、萃取利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一溶剂中,从而进行分离的方法称为萃取。选择的萃取剂应符合下列要求:
和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂,并且溶剂易挥发4、分液将互不相溶的液体混合物分离的方法。萃取和分液往往结合进行。【实验探究4】 某些地区的自来水中含有Fe3+,那么如何将含有Fe3+的自来水提纯呢?5、蒸馏利用互溶液体混合物中各组分沸点不同(通常沸点需相差30℃以上)进行分离提纯的操作。其过程是:将液态物质加热至沸点,使之汽化,然后将蒸气重新冷凝为液体的操作过程成为蒸馏。蒸馏实验示意图注意点:①实验前在蒸馏烧瓶中先加入几粒沸石(或碎瓷片)——防液体暴沸③冷凝水的方向:6、层析法【拓宽视野】【课堂小结】物质的分离、提纯注意:不同的分离方法都有一定的适用范围,要根据不同混合物的性质选择合适的方法进行分离,且有时需要多种方法配合使用。1、除去氯化钠中混有的泥沙
2、某地区的自来水中混有少量Fe3+,
实验室如何获得少量纯净的水。
3、已知KNO3和KCl的溶解度曲线
如右图所示,KNO3中混有少量的
KCl,如何提纯KNO3。现需要分离下列物质,请结合初中所学知识选择合适的物质分离方法:4、溴水中溶有少量的溴,如何将溴从水
中分离出来(溴在水中的溶解度较小)。 实验2方案
⑴加水溶解
⑵过滤
⑶加入过量BaCl2溶液
4.加入过量Na2CO3溶液
5.过滤
6.加入过量盐酸
7.加热、蒸发 实验3方案
⑴加水溶解
⑵过滤
⑶加入过量BaCl2溶液
⑷加入过量NaOH溶液
⑸加入过量Na2CO3溶液
⑹过滤
⑺加入过量盐酸
⑻加热、蒸发[练习与实践] 现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。 实 例 分离方法 选择的依据
除去澄清石灰水中的碳酸钙 蒸馏 溶解度随温度变化的差异
用CCl4提取溴水中溴单质 过滤 在不同溶剂中溶解度的差异
分离醋酸(沸点118℃)与乙醇(沸点78.5℃) 分液 沸点的差异较大
分离汽油和水 结晶 两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中提取硝酸钾 萃取 物质在水中溶解度的不同【实验探究3】实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1mlCCl4,振荡、静置。现象:溴水呈橙色,溶液分层,上层几乎无色,下层呈橙红色。实验步骤:在两支试管中各加入2~3ml溴水,再向其中的一支试管中滴加1ml汽油(或苯),振荡、静置。现象:溴水呈橙色,溶液分层,下层几乎无色,上层呈橙红色。1.下列分离混合物的操作中,必须加热的是( )
A. 过滤 B.升华 C.结晶 D.蒸馏【练习】【实验探究2】 现有氯化钾和硝酸钾的固体混合物50g,其中KCl的质量分数为10%,请设计实验方案提纯硝酸钾。 2.下列实验操作:① 过滤 ② 分液 ③ 萃取 ④ 蒸馏 ⑤ 分馏。不能用于分离相互混溶的溶液的是( )
A? ③和④ B. ①和② C? ③、④和⑤ D. ①、②和③3、右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放 ;
(2)检验:证明CO中混有CO2,装置内应盛放 ; (3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A”或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。【实验探究1】 已知氢氧化镁难溶于水,硫酸钡既难溶于水,又难溶于酸,碳酸钡难溶于水,但可溶于盐酸。现有含硫酸钠、氯化镁和泥沙等杂质的粗食盐,请你设计实验方案,有粗食盐提纯氯化钠。
