专题一第三单元原子结构模型的转变(浙江省舟山市)
文档属性
| 名称 | 专题一第三单元原子结构模型的转变(浙江省舟山市) |  | |
| 格式 | rar | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-27 07:53:00 | ||
图片预览











文档简介
课件41张PPT。第三单元
人类对原子结构的认识第一课时问题1: 世界是由什么构成的? 宏观上我们认为物质是由不同元素组
成的, 微观上我们认为物质是由不同原子
构成的.问题2: 物质是由什么构成的?问题3: 原子是由什么构成的?——原子核和核外电子. 今天的这些简单问题却是困扰了人类几千年的深奥
无比的问题,几千年的思考,几千年的知识积累,才给予我
们今天如此的智慧!——学会思考!不断探索!图1 硅晶体图2 用扫描隧道显微镜观测到的硅晶体表面 图3 氦原子结构示意图 一,原子结构模型的演变二, 核外电子的排布规律三, 原子结构与原子化学性质的关系一, 原子结构模型的演变带着下列问题:
(1),原子结构模型的演变经历了那些阶段?
(2),每个学说的创始人是谁? 主要内容有那些?
(3),这些学说相互间有何联系?新的学说主要
因为什么而提出?
认真阅读教材P26-27原子
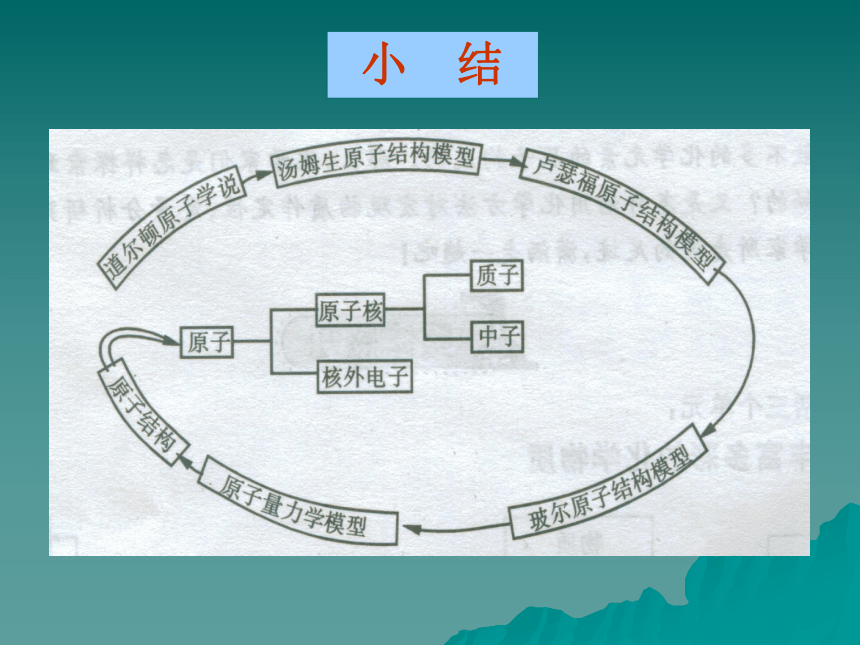
结构模型的演变史 道尔顿原子模型 (实心球) 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。 汤姆生原子模型 (葡萄干面包) 1897年,英国科学家汤姆生发现了电子,认识到原子是由更小的微粒构成. 卢瑟福原子模型 (空心球) 1911年,英国物理学家卢瑟福根据α粒子散射现象认识到原子是由原子核和核外电子 构成. 玻尔原子模型 1913年丹麦物理学家玻尔提出,原子核外,电子在一系列稳定的轨道上运动。 ⒈古希腊哲学家德谟克利特的古代原子学说。
他认为 是构成物质的微粒; 是万物变化的根本原因。
⒉英国科学家道尔顿的近代原子学说。
他认为物质都是由 构成的; 在化学反应中,原子 ; 同种原子的质量和性质 。
⒊英国物理学家汤姆生的“葡萄干面包式” 原子结构模型。
英国科学家( )发现了电子;他认 ,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子; 是 的发现使人们认识到原子是可以再分的。原子原子的结合和分离原子不生不灭、不可再分、本性不变完全相同原子是均匀的带正电的球体电子 ⒋卢瑟福的带核原子结构模型。
物理学家卢瑟福根据 ;他指出原子是由 和 ____ 构成的; 带正电荷,位于 ,它几乎集中了原子的全部质量; 带负电荷,在原子核周围空间作高速运动,就像行星环绕太阳运转一样。
⒌丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家在 时;指出: 电子在原子核外空间内一系列 上绕核作高速运动.
⒍电子云模型(现代原子结构学说)。
现代科学家根据微观世界的波粒二象性规律,提出用量子力学的方法_____ 描述核外电子运动。a粒子的散射现象研究氢原子光谱稳定的轨道电子云 小 结二,原子核外电子的排布规律 1、原子核外电子的分层排布 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层2852,原子结构示意图三、原子结构与原子性质的关系(结构决定性质)(1)稳定结构:最外层电子数为8(注意:He最外层为2),原子既不容易失去电子又不容易得到电子(如He、Ne、Ar、Na+、Cl-等)(2)不稳定结构:最外层电子数不为8,因此可能失去电子或者得到电子转变为稳定结构——最外层为8(氢原子变为0或2 )个电子。(如,能失e-: Na、Mg、Al 能得e-:F、O、Cl)复习回顾⒈古希腊哲学家德谟克利特的古代原子学说。
他认为 是构成物质的微粒; 是万物变化的根本原因。
⒉英国科学家道尔顿的近代原子学说。
他认为物质都是由 构成的; 在化学反应中,原子 ; 同种原子的质量和性质 。
⒊英国物理学家汤姆生的“葡萄干面包式” 原子结构模型。
英国科学家 发现了电子;他认为 ,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子; 是 的发现使人们认识到原子是可以再分的。原子原子的结合和分离原子不生不灭、不可再分、本性不变完全相同原子是均匀的带正电的球体电子 ⒋卢瑟福的带核原子结构模型。
物理学家卢瑟福根据 ;他指出原子是由 和 ____ 构成的; 带正电荷,位于 ,它几乎集中了原子的全部质量; 带负电荷,在原子核周围空间作高速运动,就像行星环绕太阳运转一样。
⒌丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家在 后;指出: 电子在原子核外空间内一系列 上绕核作高速运动.
⒍电子云模型(现代原子结构学说)。
现代科学家根据微观世界的波粒二象性规律,提出用量子力学的方法_____ 描述核外电子运动。a粒子的散射现象研究氢原子光谱稳定的轨道电子云3、原子核外电子排布规律 (1)?电子分层排布,以原子核为参照,由里往外依次排布在K层、L层、M层、N(第4)层、O(第5)层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电 子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过2个);能量最低原理K层L层M层2882+20K层L层2882K层L层N层2882+20K层L层2882最外层 最多8,2, 每一层最多只能容纳2n2;1, 依次排在K~N层;3,4, 能量最低原理.K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?;把原子核外分成多个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。4、原子核外电子运动区域与电子能量的关系: 三、原子结构与原子性质的关系(结构决定性质)(1)稳定结构:最外层电子数为8(注意:He最外层为2),原子既不容易失去电子又不容易得到电子(如He、Ne、Ar、Na+、Cl-等)(2)不稳定结构:最外层电子数不为8,因此可能失去电子或者得到电子转变为稳定结构——最外层为8(氢原子变为0或2 )个电子。(如,能失e-: Na、Mg、Al 能得e-:F、O、Cl)+12282失去电子+1228MgMg2++826+828得到电子OO2-结论1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目。MgMg2+失 2e-(带2个单位正电荷)2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目。OO2-得 2e-
(带2个单位负电荷)交流与讨论:氧化镁的形成宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,Mg2+与O2-相互作用,形成稳定的MgO.如教材图-1-31 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层为8电子的稳定结构。结论:钠,镁,铝等活泼金属原子的最外层电子数较少时,
与活泼非金属反应时容易失去电子,
形成最外层为8电子的稳定的电子层结构.
氧,氟,氯等活泼非金属原子的最外层电子数较多时,
与活泼金属反应时容易得到电子,
形成最外层为8电子的稳定的电子层结构⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2知识归纳:①最外层电子数﹤4时,容易失去电子(化合价=+失去的电子数目)②最外层电子数≥4时,容易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)2、原子核外电子排布规律 (1)?电子分层排布,依次排在K、L、M、N、O层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过8个);
能量最低原理3、原子结构与原子性质的关系(结构决定性质)①最外层电子数﹤4时,容易失去电子(化合价=+失去的电子数目)(化合价=最外层电子数-8)②最外层电子数≥4时,容易得到电子原子结构模型的演变信息博览:
新华网3月27日电 日本奈良尖端科技研究生院的大门宽教授应用“圆偏振光光电子衍射原理”开发成功立体显微镜,能够把原子的排列结构扩大100亿倍,从而使人得以对微观世界的物质进行立体性的观测和摄影。
据这位科学家提供的资料说,使用这种新型显微镜对钨的晶体进行的观测,发现了由4个原子构成的边长为2.74埃(1米的百亿分之一)的菱形结构。
他说,这是在世界上第一次对物质的原子结构进行高倍率的观测,它的观测倍率要比现有最高水平的电子显微镜提高大约200倍,今后在开发超导物质等新功能材料及解析催化剂的反应机制等应用物理和化学领域将会发挥重要作用 3、原子核外电子排布规律 (1)?电子分层排布,以原子核为参照,由里往外依次排布在K层、L层、M层、N(第4)层、O(第5)层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电 子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过2个);能量最低原理⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。练习:K层L层M层2882+20K层L层2882K层L层N层2882+20K层L层2882最外层 最多8,2, 每一层最多只能容纳2n2;1,依次排在K~N层;3,4,能量最低原理.K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?;把原子核外分成多个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。4、原子核外电子运动区域与电子能量的关系:
人类对原子结构的认识第一课时问题1: 世界是由什么构成的? 宏观上我们认为物质是由不同元素组
成的, 微观上我们认为物质是由不同原子
构成的.问题2: 物质是由什么构成的?问题3: 原子是由什么构成的?——原子核和核外电子. 今天的这些简单问题却是困扰了人类几千年的深奥
无比的问题,几千年的思考,几千年的知识积累,才给予我
们今天如此的智慧!——学会思考!不断探索!图1 硅晶体图2 用扫描隧道显微镜观测到的硅晶体表面 图3 氦原子结构示意图 一,原子结构模型的演变二, 核外电子的排布规律三, 原子结构与原子化学性质的关系一, 原子结构模型的演变带着下列问题:
(1),原子结构模型的演变经历了那些阶段?
(2),每个学说的创始人是谁? 主要内容有那些?
(3),这些学说相互间有何联系?新的学说主要
因为什么而提出?
认真阅读教材P26-27原子
结构模型的演变史 道尔顿原子模型 (实心球) 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。 汤姆生原子模型 (葡萄干面包) 1897年,英国科学家汤姆生发现了电子,认识到原子是由更小的微粒构成. 卢瑟福原子模型 (空心球) 1911年,英国物理学家卢瑟福根据α粒子散射现象认识到原子是由原子核和核外电子 构成. 玻尔原子模型 1913年丹麦物理学家玻尔提出,原子核外,电子在一系列稳定的轨道上运动。 ⒈古希腊哲学家德谟克利特的古代原子学说。
他认为 是构成物质的微粒; 是万物变化的根本原因。
⒉英国科学家道尔顿的近代原子学说。
他认为物质都是由 构成的; 在化学反应中,原子 ; 同种原子的质量和性质 。
⒊英国物理学家汤姆生的“葡萄干面包式” 原子结构模型。
英国科学家( )发现了电子;他认 ,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子; 是 的发现使人们认识到原子是可以再分的。原子原子的结合和分离原子不生不灭、不可再分、本性不变完全相同原子是均匀的带正电的球体电子 ⒋卢瑟福的带核原子结构模型。
物理学家卢瑟福根据 ;他指出原子是由 和 ____ 构成的; 带正电荷,位于 ,它几乎集中了原子的全部质量; 带负电荷,在原子核周围空间作高速运动,就像行星环绕太阳运转一样。
⒌丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家在 时;指出: 电子在原子核外空间内一系列 上绕核作高速运动.
⒍电子云模型(现代原子结构学说)。
现代科学家根据微观世界的波粒二象性规律,提出用量子力学的方法_____ 描述核外电子运动。a粒子的散射现象研究氢原子光谱稳定的轨道电子云 小 结二,原子核外电子的排布规律 1、原子核外电子的分层排布 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层2852,原子结构示意图三、原子结构与原子性质的关系(结构决定性质)(1)稳定结构:最外层电子数为8(注意:He最外层为2),原子既不容易失去电子又不容易得到电子(如He、Ne、Ar、Na+、Cl-等)(2)不稳定结构:最外层电子数不为8,因此可能失去电子或者得到电子转变为稳定结构——最外层为8(氢原子变为0或2 )个电子。(如,能失e-: Na、Mg、Al 能得e-:F、O、Cl)复习回顾⒈古希腊哲学家德谟克利特的古代原子学说。
他认为 是构成物质的微粒; 是万物变化的根本原因。
⒉英国科学家道尔顿的近代原子学说。
他认为物质都是由 构成的; 在化学反应中,原子 ; 同种原子的质量和性质 。
⒊英国物理学家汤姆生的“葡萄干面包式” 原子结构模型。
英国科学家 发现了电子;他认为 ,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子; 是 的发现使人们认识到原子是可以再分的。原子原子的结合和分离原子不生不灭、不可再分、本性不变完全相同原子是均匀的带正电的球体电子 ⒋卢瑟福的带核原子结构模型。
物理学家卢瑟福根据 ;他指出原子是由 和 ____ 构成的; 带正电荷,位于 ,它几乎集中了原子的全部质量; 带负电荷,在原子核周围空间作高速运动,就像行星环绕太阳运转一样。
⒌丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家在 后;指出: 电子在原子核外空间内一系列 上绕核作高速运动.
⒍电子云模型(现代原子结构学说)。
现代科学家根据微观世界的波粒二象性规律,提出用量子力学的方法_____ 描述核外电子运动。a粒子的散射现象研究氢原子光谱稳定的轨道电子云3、原子核外电子排布规律 (1)?电子分层排布,以原子核为参照,由里往外依次排布在K层、L层、M层、N(第4)层、O(第5)层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电 子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过2个);能量最低原理K层L层M层2882+20K层L层2882K层L层N层2882+20K层L层2882最外层 最多8,2, 每一层最多只能容纳2n2;1, 依次排在K~N层;3,4, 能量最低原理.K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?;把原子核外分成多个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。4、原子核外电子运动区域与电子能量的关系: 三、原子结构与原子性质的关系(结构决定性质)(1)稳定结构:最外层电子数为8(注意:He最外层为2),原子既不容易失去电子又不容易得到电子(如He、Ne、Ar、Na+、Cl-等)(2)不稳定结构:最外层电子数不为8,因此可能失去电子或者得到电子转变为稳定结构——最外层为8(氢原子变为0或2 )个电子。(如,能失e-: Na、Mg、Al 能得e-:F、O、Cl)+12282失去电子+1228MgMg2++826+828得到电子OO2-结论1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目。MgMg2+失 2e-(带2个单位正电荷)2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目。OO2-得 2e-
(带2个单位负电荷)交流与讨论:氧化镁的形成宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,Mg2+与O2-相互作用,形成稳定的MgO.如教材图-1-31 原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层为8电子的稳定结构。结论:钠,镁,铝等活泼金属原子的最外层电子数较少时,
与活泼非金属反应时容易失去电子,
形成最外层为8电子的稳定的电子层结构.
氧,氟,氯等活泼非金属原子的最外层电子数较多时,
与活泼金属反应时容易得到电子,
形成最外层为8电子的稳定的电子层结构⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、MgO、NaCl、MgCl2知识归纳:①最外层电子数﹤4时,容易失去电子(化合价=+失去的电子数目)②最外层电子数≥4时,容易得到电子(化合价=最外层电子数-8)关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)2、原子核外电子排布规律 (1)?电子分层排布,依次排在K、L、M、N、O层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过8个);
能量最低原理3、原子结构与原子性质的关系(结构决定性质)①最外层电子数﹤4时,容易失去电子(化合价=+失去的电子数目)(化合价=最外层电子数-8)②最外层电子数≥4时,容易得到电子原子结构模型的演变信息博览:
新华网3月27日电 日本奈良尖端科技研究生院的大门宽教授应用“圆偏振光光电子衍射原理”开发成功立体显微镜,能够把原子的排列结构扩大100亿倍,从而使人得以对微观世界的物质进行立体性的观测和摄影。
据这位科学家提供的资料说,使用这种新型显微镜对钨的晶体进行的观测,发现了由4个原子构成的边长为2.74埃(1米的百亿分之一)的菱形结构。
他说,这是在世界上第一次对物质的原子结构进行高倍率的观测,它的观测倍率要比现有最高水平的电子显微镜提高大约200倍,今后在开发超导物质等新功能材料及解析催化剂的反应机制等应用物理和化学领域将会发挥重要作用 3、原子核外电子排布规律 (1)?电子分层排布,以原子核为参照,由里往外依次排布在K层、L层、M层、N(第4)层、O(第5)层等; (2) 每个电子层最多只能容纳2n2个电子; n指的是电 子层数。 (3)最外(倒数第1)层最多只能容纳 8个电子(K层为最外层时不能超过2个);
次外(倒数第2)层最多只能容纳18个电子(K层为次外层时不能超过2个);能量最低原理⒈原子核外电子是 排布的
⒉金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。练习:K层L层M层2882+20K层L层2882K层L层N层2882+20K层L层2882最外层 最多8,2, 每一层最多只能容纳2n2;1,依次排在K~N层;3,4,能量最低原理.K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?;把原子核外分成多个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高。4、原子核外电子运动区域与电子能量的关系:
