铁、铜及其化合物的应用
图片预览



文档简介
铁、铜及其化合物的应用
台州 楚门中学 金华君
一、教材分析
1、在人类认识的金属元素中,铁、铜是较早被人类认识、对人类社会的发展起到重要作用的两种金属。本单元的知识体系打破了以往元素化合物知识学习中的“结构-性质-制备-用途”的传统模式,而是从人们熟悉的这些元素及其化合物在生产生活中的应用事例着手,引发学生对“它们在自然界如何存在?人类如何获取这些物质?”的思考,进而产生探究的欲望。教材这样的安排,是为了使学生在更广阔的视野下,认识在生产生活中有广泛应用的元素及其化合物的相关知识,了解化学在资源的利用和保护中的意义和作用,认识化学与人类生活的密切关系,培养学生运用化学知识解释或解决与化学相关的社会问题的能力,形成正确的情感态度和价值观,增强社会责任感。
2、在本单元有关铁、铜及其化合物知识的教学中,应注意把实验的主动权交还给学生,引导学生从实验中发现新问题,设计实验方案,解决新问题,将探索引向深入。在实验探索中,要引导学生正确的确定实验目的,减少实验的盲目性,加强对实验结果的分析归纳,提高实验的有效性。
3、本单元的第一部分从铁、铜的存在和提取着手,介绍了它们的冶炼方法,回顾比较了铁、铜及其化合物的相关性质,并通过实验探究掌握不同价态的铁元素之间的转化,使学生对铁、铜及其化合物的性质的认识更完整、更系统。
二、教学目标
1、知识与技能:掌握Fe2+、Fe3+的性质及相互转化。学会用图示法自主构建“铁三角”关系。学会用化学方法鉴别Fe2+与Fe3+。系统掌握铁及其化合物的化学性质。
2、过程与方法:通过教材的交流与讨论发挥学生的主观能动性,思考、比较并回忆以前学习过的知识;根据活动与探究中的实验提示,引导学生进行实验,从实验中总结经验以获得自我探究乐趣的过程。
3、情感态度与价值观:在“实验-反思-再实验-再反思”的过程中体验实验探究的方法和技能。通过列表比较和图示联系的方式,在了解、掌握Fe2+、Fe3+的性质的同时,学习科学的思维方法和学习方式。
三、教学重点、难点
重点:1、Fe2+、Fe3+的性质及相互转化
2、学会用化学方法鉴别Fe2+与Fe3+
难点: Fe2+、Fe3+的性质及相互转化;“铁三角”关系的构建
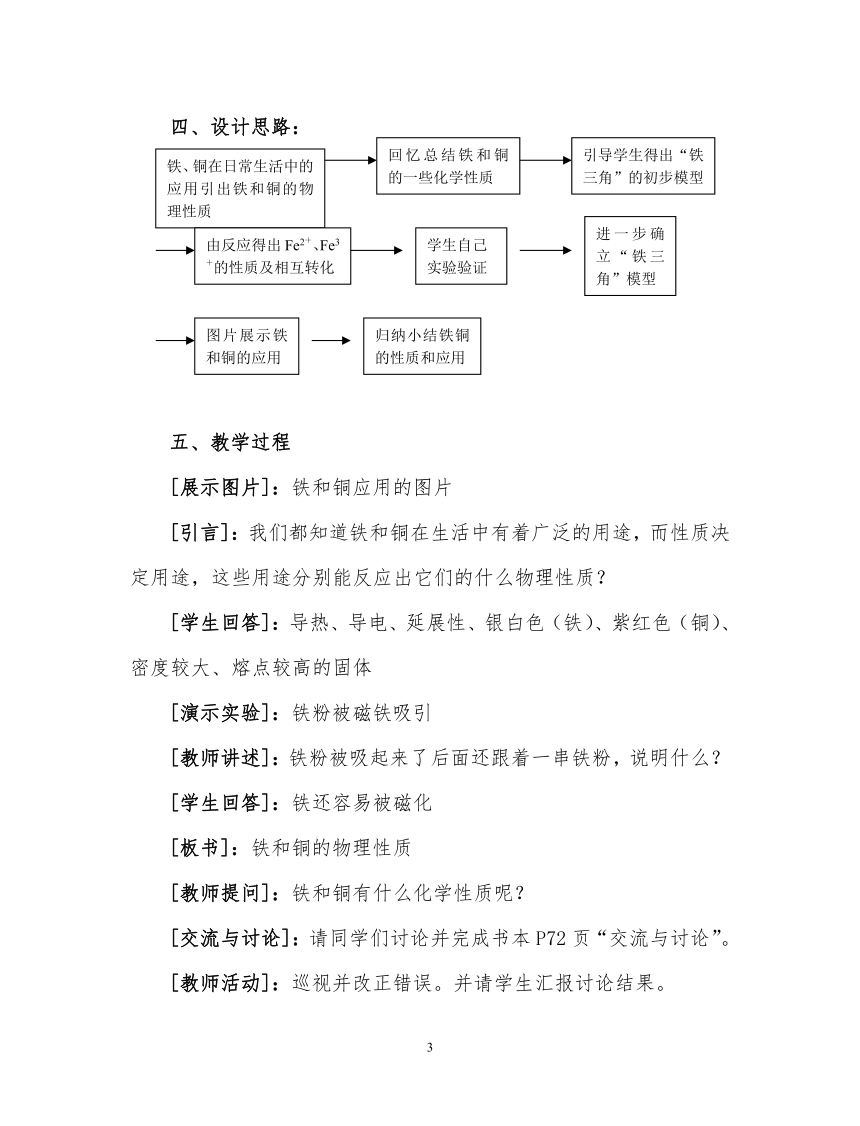
四、设计思路:
五、教学过程
[展示图片]:铁和铜应用的图片
[引言]:我们都知道铁和铜在生活中有着广泛的用途,而性质决定用途,这些用途分别能反应出它们的什么物理性质?
[学生回答]:导热、导电、延展性、银白色(铁)、紫红色(铜)、密度较大、熔点较高的固体
[演示实验]:铁粉被磁铁吸引
[教师讲述]:铁粉被吸起来了后面还跟着一串铁粉,说明什么?
[学生回答]:铁还容易被磁化
[板书]:铁和铜的物理性质
[教师提问]:铁和铜有什么化学性质呢?
[交流与讨论]:请同学们讨论并完成书本P72页“交流与讨论”。
[教师活动]:巡视并改正错误。并请学生汇报讨论结果。
[教师小结]:氧气、氯气等氧化性强的氧化剂能把铁直接氧化到+3价;而氢离子、铜离子、银离子等氧化性较弱的氧化剂只能把铁氧化到+2价,在反应中铁单质表现出的是还原性。
[板书]:
[设疑]:Fe2+与Fe3+能否相互转化呢?
[学生回答]:能
[教师提问]:要把Fe2+变成Fe3+,需要加哪类物质?
[学生回答]:化合价升高被氧化,要加氧化剂
[教师提问]:那具体哪种可以,有谁知道吗?
[学生回答]:Cl2 、O2应该可以,因为Cl2 、O2氧化性强能把铁单质直接氧化到+3价,应该也能将Fe2+氧化为Fe3+
[教师讲述]:好,我们来试试。做实验之前我们先来了解一下Fe2+与Fe3+区别方法,含Fe3+溶液中加入KSCN溶液能看到溶液变血红色,而Fe3+加入KSCN溶液不变色。
[指导学生实验]: Fe3+的检验
[教师讲述]:知道了如何检验Fe3+以后,你们桌上有新制氯水,你们能否设计实验验证Cl2能否使Fe2+变成Fe3+呢?
[学生回答]:在溶液中加氯水,在加KSCN溶液,如果变红说明有Fe3+。
[提出问题]:这个方案严密吗?
[学生回答]:不严密,假如Cl2不能把Fe2+氧化为Fe3+,而原溶液中原来就有Fe3+,则加KSCN溶液,也会变红色。
[教师提问]:如何优化上述实验方案?
[学生回答]:先加入KSCN溶液不变色,再加氯水,如果变红说明Fe2+变成Fe3+了。
[教师讲述]:对了,你们自己就来验证一下氯水能否使Fe2+变成Fe3+吧。
[指导学生实验]:氯化亚铁加KSCN溶液再加氯水。
[学生活动]:记录方案、现象
[设疑]:我们知道Fe2+能变成Fe3+了,那反过来可以吗?
若Fe2+能变成Fe3+,应加氧化剂还是还原剂?
[学生回答]:还原剂
[教师提问]:对,我们知道金属一般都具有还原性,现给你们铁粉,你们设计一下实验方案。
[学生回答]:先在有Fe3+的溶液中加KSCN溶液,再加铁粉,如果红色褪去,说明铁粉可以使Fe3+还原为Fe2+。
[指导学生实验]:氯化铁加KSCN溶液再加铁粉。
[师生小结]:通过以上实验我们知道了Fe2+与Fe3+能相互转化,要使Fe2+变成Fe3+需要加氧化剂,使Fe3+变成Fe2+,加还原剂
[板书]:
[教师讲述]:氯气可以把Fe2+变成Fe3+,那其他氧化剂如氧气可以吗?
[学生回答]:可以
[教师讲述]:已知双氧水能使Fe变成Fe3+,那能把Fe2+变成Fe3+吗?
[学生回答]:可以
[设疑]:铁可以把Fe3+变成Fe2+,那其他金属可以吗,比如铜?我们来试试看。
[指导学生实验]:氯化铁加KSCN溶液再加铜粉。
[教师活动]:指导学生完成书本P73页“活动与探究”;P74页“活动与探究”。
[教师讲述]:在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。大家看P74页图3-13。
[教师小结]:结合板书“铁三角”讲解铁与铜的物理和化学性质并写出各步反应方程式。
随堂检测:
1、能与Fe3+反应且能证明Fe3+具有氧化性的物质是: ( )
①KSCN ②Fe ③FeCl2 ④NaOH
A.④ B. ① C. ③ D. ②
2、要证明某溶液中不含Fe3+而可能含有Fe2+, 进行如下实验操作时最佳顺序为( )
加入足量氯水 加入足量KMnO4 加入少量KSCN溶液
A. ①③ B. ③② C. ③① D. ①②③
六、教学分析:
本节课涉及的是学生常见的铁和铜的性质,在他们知道的基础上加深,应该更容易被接受,主要是“铁三角”的关系难以建立,所以本节课主要以学生已有的知识、日常生活的常识及自己亲自动手实验探究构建及理解“铁三角”的过程。学生对于自己亲手实验获得的结论印象比较深刻,且兴趣浓,学习积极性高。所以尽最大能力为学生创造亲自动手实验的机会。
铁、铜在日常生活中的应用引出铁和铜的物理性质
回忆总结铁和铜的一些化学性质
引导学生得出“铁三角”的初步模型
由反应得出Fe2+、Fe3+的性质及相互转化
进一步确立“铁三角”模型
学生自己实验验证
图片展示铁和铜的应用
归纳小结铁铜的性质和应用
O2
Ag+
Cu2+
H+
Cl2
Fe3+
Fe2+
Fe
O2
Ag+
Cu2+
H+
Cl2
Fe3+
Fe2+
Fe
Cl2
Fe
PAGE
1
台州 楚门中学 金华君
一、教材分析
1、在人类认识的金属元素中,铁、铜是较早被人类认识、对人类社会的发展起到重要作用的两种金属。本单元的知识体系打破了以往元素化合物知识学习中的“结构-性质-制备-用途”的传统模式,而是从人们熟悉的这些元素及其化合物在生产生活中的应用事例着手,引发学生对“它们在自然界如何存在?人类如何获取这些物质?”的思考,进而产生探究的欲望。教材这样的安排,是为了使学生在更广阔的视野下,认识在生产生活中有广泛应用的元素及其化合物的相关知识,了解化学在资源的利用和保护中的意义和作用,认识化学与人类生活的密切关系,培养学生运用化学知识解释或解决与化学相关的社会问题的能力,形成正确的情感态度和价值观,增强社会责任感。
2、在本单元有关铁、铜及其化合物知识的教学中,应注意把实验的主动权交还给学生,引导学生从实验中发现新问题,设计实验方案,解决新问题,将探索引向深入。在实验探索中,要引导学生正确的确定实验目的,减少实验的盲目性,加强对实验结果的分析归纳,提高实验的有效性。
3、本单元的第一部分从铁、铜的存在和提取着手,介绍了它们的冶炼方法,回顾比较了铁、铜及其化合物的相关性质,并通过实验探究掌握不同价态的铁元素之间的转化,使学生对铁、铜及其化合物的性质的认识更完整、更系统。
二、教学目标
1、知识与技能:掌握Fe2+、Fe3+的性质及相互转化。学会用图示法自主构建“铁三角”关系。学会用化学方法鉴别Fe2+与Fe3+。系统掌握铁及其化合物的化学性质。
2、过程与方法:通过教材的交流与讨论发挥学生的主观能动性,思考、比较并回忆以前学习过的知识;根据活动与探究中的实验提示,引导学生进行实验,从实验中总结经验以获得自我探究乐趣的过程。
3、情感态度与价值观:在“实验-反思-再实验-再反思”的过程中体验实验探究的方法和技能。通过列表比较和图示联系的方式,在了解、掌握Fe2+、Fe3+的性质的同时,学习科学的思维方法和学习方式。
三、教学重点、难点
重点:1、Fe2+、Fe3+的性质及相互转化
2、学会用化学方法鉴别Fe2+与Fe3+
难点: Fe2+、Fe3+的性质及相互转化;“铁三角”关系的构建
四、设计思路:
五、教学过程
[展示图片]:铁和铜应用的图片
[引言]:我们都知道铁和铜在生活中有着广泛的用途,而性质决定用途,这些用途分别能反应出它们的什么物理性质?
[学生回答]:导热、导电、延展性、银白色(铁)、紫红色(铜)、密度较大、熔点较高的固体
[演示实验]:铁粉被磁铁吸引
[教师讲述]:铁粉被吸起来了后面还跟着一串铁粉,说明什么?
[学生回答]:铁还容易被磁化
[板书]:铁和铜的物理性质
[教师提问]:铁和铜有什么化学性质呢?
[交流与讨论]:请同学们讨论并完成书本P72页“交流与讨论”。
[教师活动]:巡视并改正错误。并请学生汇报讨论结果。
[教师小结]:氧气、氯气等氧化性强的氧化剂能把铁直接氧化到+3价;而氢离子、铜离子、银离子等氧化性较弱的氧化剂只能把铁氧化到+2价,在反应中铁单质表现出的是还原性。
[板书]:
[设疑]:Fe2+与Fe3+能否相互转化呢?
[学生回答]:能
[教师提问]:要把Fe2+变成Fe3+,需要加哪类物质?
[学生回答]:化合价升高被氧化,要加氧化剂
[教师提问]:那具体哪种可以,有谁知道吗?
[学生回答]:Cl2 、O2应该可以,因为Cl2 、O2氧化性强能把铁单质直接氧化到+3价,应该也能将Fe2+氧化为Fe3+
[教师讲述]:好,我们来试试。做实验之前我们先来了解一下Fe2+与Fe3+区别方法,含Fe3+溶液中加入KSCN溶液能看到溶液变血红色,而Fe3+加入KSCN溶液不变色。
[指导学生实验]: Fe3+的检验
[教师讲述]:知道了如何检验Fe3+以后,你们桌上有新制氯水,你们能否设计实验验证Cl2能否使Fe2+变成Fe3+呢?
[学生回答]:在溶液中加氯水,在加KSCN溶液,如果变红说明有Fe3+。
[提出问题]:这个方案严密吗?
[学生回答]:不严密,假如Cl2不能把Fe2+氧化为Fe3+,而原溶液中原来就有Fe3+,则加KSCN溶液,也会变红色。
[教师提问]:如何优化上述实验方案?
[学生回答]:先加入KSCN溶液不变色,再加氯水,如果变红说明Fe2+变成Fe3+了。
[教师讲述]:对了,你们自己就来验证一下氯水能否使Fe2+变成Fe3+吧。
[指导学生实验]:氯化亚铁加KSCN溶液再加氯水。
[学生活动]:记录方案、现象
[设疑]:我们知道Fe2+能变成Fe3+了,那反过来可以吗?
若Fe2+能变成Fe3+,应加氧化剂还是还原剂?
[学生回答]:还原剂
[教师提问]:对,我们知道金属一般都具有还原性,现给你们铁粉,你们设计一下实验方案。
[学生回答]:先在有Fe3+的溶液中加KSCN溶液,再加铁粉,如果红色褪去,说明铁粉可以使Fe3+还原为Fe2+。
[指导学生实验]:氯化铁加KSCN溶液再加铁粉。
[师生小结]:通过以上实验我们知道了Fe2+与Fe3+能相互转化,要使Fe2+变成Fe3+需要加氧化剂,使Fe3+变成Fe2+,加还原剂
[板书]:
[教师讲述]:氯气可以把Fe2+变成Fe3+,那其他氧化剂如氧气可以吗?
[学生回答]:可以
[教师讲述]:已知双氧水能使Fe变成Fe3+,那能把Fe2+变成Fe3+吗?
[学生回答]:可以
[设疑]:铁可以把Fe3+变成Fe2+,那其他金属可以吗,比如铜?我们来试试看。
[指导学生实验]:氯化铁加KSCN溶液再加铜粉。
[教师活动]:指导学生完成书本P73页“活动与探究”;P74页“活动与探究”。
[教师讲述]:在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。大家看P74页图3-13。
[教师小结]:结合板书“铁三角”讲解铁与铜的物理和化学性质并写出各步反应方程式。
随堂检测:
1、能与Fe3+反应且能证明Fe3+具有氧化性的物质是: ( )
①KSCN ②Fe ③FeCl2 ④NaOH
A.④ B. ① C. ③ D. ②
2、要证明某溶液中不含Fe3+而可能含有Fe2+, 进行如下实验操作时最佳顺序为( )
加入足量氯水 加入足量KMnO4 加入少量KSCN溶液
A. ①③ B. ③② C. ③① D. ①②③
六、教学分析:
本节课涉及的是学生常见的铁和铜的性质,在他们知道的基础上加深,应该更容易被接受,主要是“铁三角”的关系难以建立,所以本节课主要以学生已有的知识、日常生活的常识及自己亲自动手实验探究构建及理解“铁三角”的过程。学生对于自己亲手实验获得的结论印象比较深刻,且兴趣浓,学习积极性高。所以尽最大能力为学生创造亲自动手实验的机会。
铁、铜在日常生活中的应用引出铁和铜的物理性质
回忆总结铁和铜的一些化学性质
引导学生得出“铁三角”的初步模型
由反应得出Fe2+、Fe3+的性质及相互转化
进一步确立“铁三角”模型
学生自己实验验证
图片展示铁和铜的应用
归纳小结铁铜的性质和应用
O2
Ag+
Cu2+
H+
Cl2
Fe3+
Fe2+
Fe
O2
Ag+
Cu2+
H+
Cl2
Fe3+
Fe2+
Fe
Cl2
Fe
PAGE
1
