专题二第一单元氯气的生产原理(浙江省舟山市)
文档属性
| 名称 | 专题二第一单元氯气的生产原理(浙江省舟山市) |

|
|
| 格式 | rar | ||
| 文件大小 | 834.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-10-04 00:00:00 | ||
图片预览




文档简介
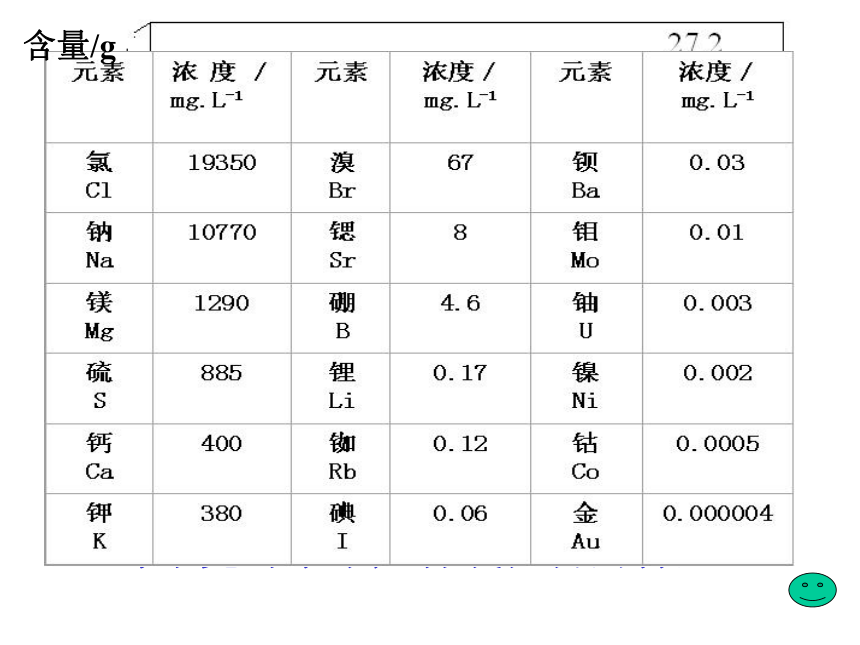
课件17张PPT。专题 2从海水中获得的化学物质江苏省运河中学 郭峰请阅读教材P38前言,思考:1、海水中主要含有的物质和各元素的含量。
2、人们是如何从海水中获得氯化钠并生产氯气
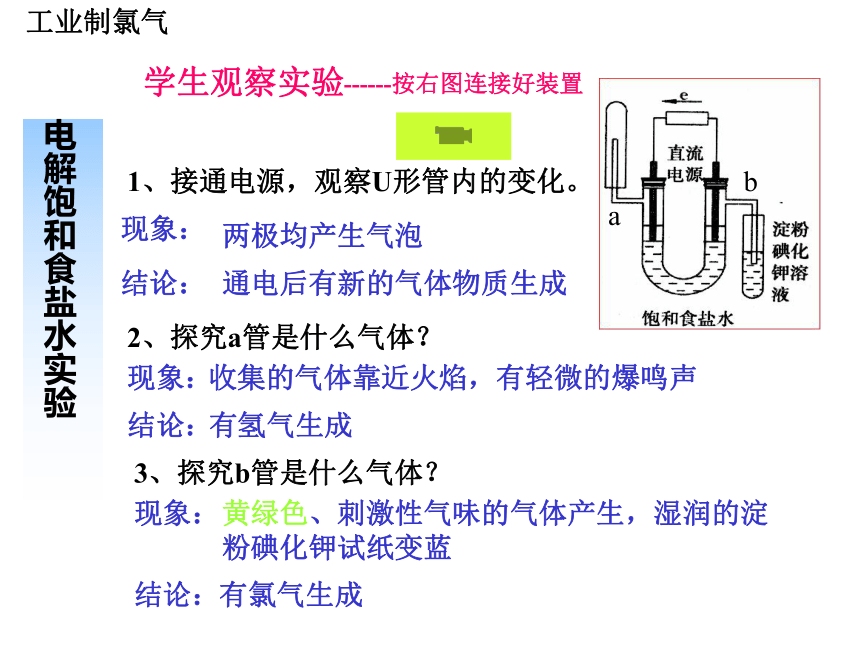
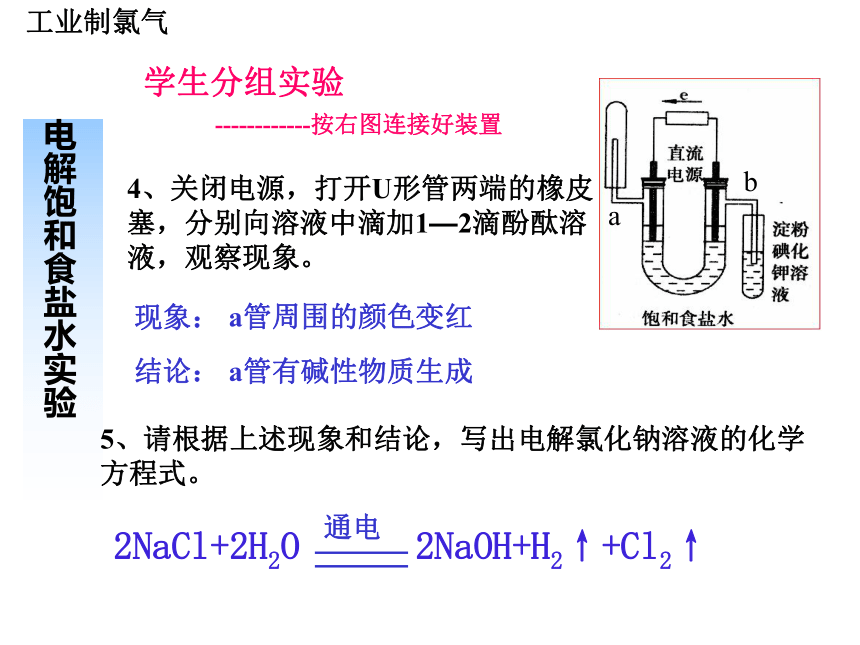
的。每千克海水中几种氯化物的含量含量/g 氯、溴、碘及其化合物第一单元氯气的生产原理一、工业制氯气二、实验室制氯气学生观察实验电解饱和食盐水实验------按右图连接好装置1、接通电源,观察U形管内的变化。 两极均产生气泡通电后有新的气体物质生成现象:结论:ab2、探究a管是什么气体?现象:结论:收集的气体靠近火焰,有轻微的爆鸣声有氢气生成3、探究b管是什么气体?现象:结论:黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝有氯气生成工业制氯气学生分组实验电解饱和食盐水实验------------按右图连接好装置ab4、关闭电源,打开U形管两端的橡皮塞,分别向溶液中滴加1—2滴酚酞溶液,观察现象。 现象:结论:a管周围的颜色变红a管有碱性物质生成5、请根据上述现象和结论,写出电解氯化钠溶液的化学方程式。2NaCl+2H2O 2NaOH+H2↑+Cl2↑通电工业制氯气小结 电解饱和食盐水制氯气的原理就是:通过氯化钠和水发生电解反应,在与电源正极相连的电极(阳极)上产生氯气,同时在与电源负极相连的电极(阴极)上产生氢气和氢氧化钠。
电解饱和食盐水实验2NaCl+2H2O 2NaOH+H2↑+Cl2↑通电电源负极电源正极工业制氯气1、电解槽的组成阳离子交换膜电解槽阳极:金属钛网(涂钛钌氧化 物)。
阴极:碳钢网(有镍涂层) 。
阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室。
2、阳离子交换膜的作用①能防止阴极产生的H2和阳极产 生的Cl2相混合而引起爆炸。②能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量 。工业制氯气电解饱和食盐水实验思考在工业上,若用该装置来收集纯净的氯气、氢气、碱等产品,此装置会存在哪些缺点?①H2和Cl2 混合不安全。
②Cl2会和NaOH反应,会使得到的NaOH不纯。工业制氯气工业制氯气 工业上利用电解饱和食盐水的方法制取 、 和 。在电源正极上方收集到的气体能使湿润的 变蓝色,证明是 ;在电源负极上方收集到的气体是 ,在电极附近的水溶液中滴几滴酚酞溶液,则溶液 ,证明有 生成。若电解一段时间后,电源正极上方收集到的气体在标准状况下为4.48L,则在电源负极上方将收集到 g 气体,在溶液中产生 g 。停止通电后,待溶液混合均匀,溶液的pH会 。 练一练NaOHH2淀粉碘化钾试纸Cl2Cl2H2变红NaOH0.4H216NaOH升高氯气的发现1774年,瑞典化学家舍勒把浓盐酸与软锰矿混在一起加热时发现氯气。
1810年,英国化学家戴维将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
此后,人们根据其反应原理,设计了实验室制氯气的装置。戴维氯气的实验室制法MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O知识回顾1、记得初中学过的实验室制O2、H2、CO2的装置图吗?制O2制H2 、CO22、以上是气体发生装置,一套完整的制取装置还有哪些?收集和尾气处理。3、实验室制氯气能用以上这两套装置吗?为什么?氯气的实验室制法MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O组装仪器阅读书本40页,组装实验室制氯气的装置。主要仪器:分液漏斗、圆底烧瓶、铁架台、石棉网、酒精灯、集气瓶、烧杯、导管、双孔橡皮塞等 动手实验用上述装置图制取并收集氯气。1、实验室制氯气时有如下操作,操作顺序正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出 ③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入氢氧化钠溶液中
A.①②③④⑤ B.④③①②⑤
C.①③④②⑤ D.①④③②⑤C练一练课后作业根据氯碱厂原料和产品的性质,你认为在生产过程中和贮运时应注意哪些问题?氯碱厂的厂址应如何选择? (写一篇调查报告)
2、人们是如何从海水中获得氯化钠并生产氯气
的。每千克海水中几种氯化物的含量含量/g 氯、溴、碘及其化合物第一单元氯气的生产原理一、工业制氯气二、实验室制氯气学生观察实验电解饱和食盐水实验------按右图连接好装置1、接通电源,观察U形管内的变化。 两极均产生气泡通电后有新的气体物质生成现象:结论:ab2、探究a管是什么气体?现象:结论:收集的气体靠近火焰,有轻微的爆鸣声有氢气生成3、探究b管是什么气体?现象:结论:黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝有氯气生成工业制氯气学生分组实验电解饱和食盐水实验------------按右图连接好装置ab4、关闭电源,打开U形管两端的橡皮塞,分别向溶液中滴加1—2滴酚酞溶液,观察现象。 现象:结论:a管周围的颜色变红a管有碱性物质生成5、请根据上述现象和结论,写出电解氯化钠溶液的化学方程式。2NaCl+2H2O 2NaOH+H2↑+Cl2↑通电工业制氯气小结 电解饱和食盐水制氯气的原理就是:通过氯化钠和水发生电解反应,在与电源正极相连的电极(阳极)上产生氯气,同时在与电源负极相连的电极(阴极)上产生氢气和氢氧化钠。
电解饱和食盐水实验2NaCl+2H2O 2NaOH+H2↑+Cl2↑通电电源负极电源正极工业制氯气1、电解槽的组成阳离子交换膜电解槽阳极:金属钛网(涂钛钌氧化 物)。
阴极:碳钢网(有镍涂层) 。
阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室。
2、阳离子交换膜的作用①能防止阴极产生的H2和阳极产 生的Cl2相混合而引起爆炸。②能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量 。工业制氯气电解饱和食盐水实验思考在工业上,若用该装置来收集纯净的氯气、氢气、碱等产品,此装置会存在哪些缺点?①H2和Cl2 混合不安全。
②Cl2会和NaOH反应,会使得到的NaOH不纯。工业制氯气工业制氯气 工业上利用电解饱和食盐水的方法制取 、 和 。在电源正极上方收集到的气体能使湿润的 变蓝色,证明是 ;在电源负极上方收集到的气体是 ,在电极附近的水溶液中滴几滴酚酞溶液,则溶液 ,证明有 生成。若电解一段时间后,电源正极上方收集到的气体在标准状况下为4.48L,则在电源负极上方将收集到 g 气体,在溶液中产生 g 。停止通电后,待溶液混合均匀,溶液的pH会 。 练一练NaOHH2淀粉碘化钾试纸Cl2Cl2H2变红NaOH0.4H216NaOH升高氯气的发现1774年,瑞典化学家舍勒把浓盐酸与软锰矿混在一起加热时发现氯气。
1810年,英国化学家戴维将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
此后,人们根据其反应原理,设计了实验室制氯气的装置。戴维氯气的实验室制法MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O知识回顾1、记得初中学过的实验室制O2、H2、CO2的装置图吗?制O2制H2 、CO22、以上是气体发生装置,一套完整的制取装置还有哪些?收集和尾气处理。3、实验室制氯气能用以上这两套装置吗?为什么?氯气的实验室制法MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O组装仪器阅读书本40页,组装实验室制氯气的装置。主要仪器:分液漏斗、圆底烧瓶、铁架台、石棉网、酒精灯、集气瓶、烧杯、导管、双孔橡皮塞等 动手实验用上述装置图制取并收集氯气。1、实验室制氯气时有如下操作,操作顺序正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出 ③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入氢氧化钠溶液中
A.①②③④⑤ B.④③①②⑤
C.①③④②⑤ D.①④③②⑤C练一练课后作业根据氯碱厂原料和产品的性质,你认为在生产过程中和贮运时应注意哪些问题?氯碱厂的厂址应如何选择? (写一篇调查报告)
