从铝土矿中提取铝
图片预览





文档简介
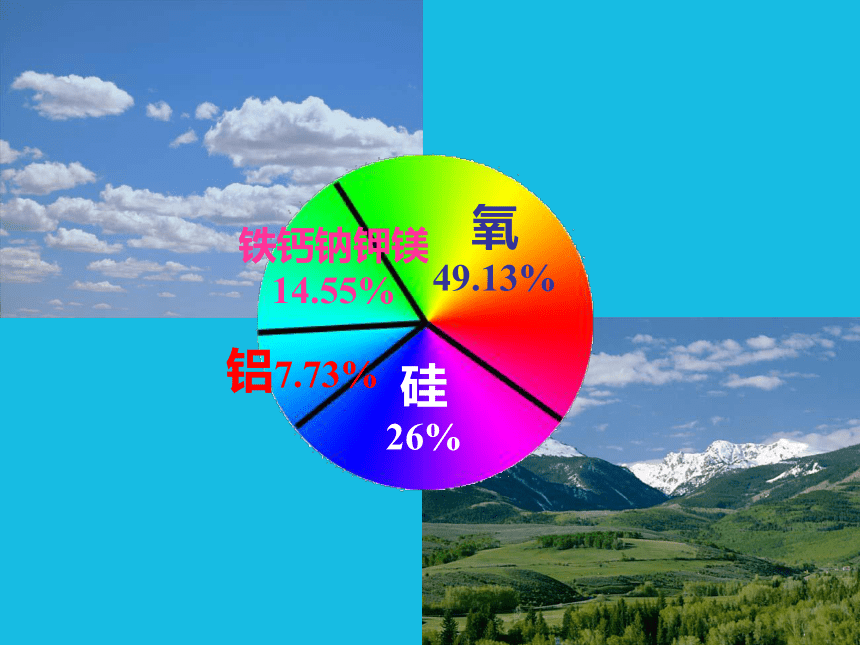
课件14张PPT。氧
49.13%硅
26%铝7.73%铁钙钠钾镁
14.55% 铝的冶炼史传说拿破仑三世的刀叉具是用铝制造的。筵席上,他为多数客人提供金餐具,而只让少数客人使用铝餐具,是为了让用铝餐具的客人留下更深刻印象。
1885年,在美国首都华盛顿特区落成的华盛顿纪念碑上的顶帽也是用金属铝制造的。
因为在19世纪,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。因为从铝矿石中把铝提炼出来,是极其困难的。1884年,在美国奥伯林学院化学系,有一位叫做查尔斯·马丁·霍尔的青年学生。当时他只有二十一岁。一次,他听一位教授说:“不管谁能发明一种低成本的炼铝法,都会出人头地。”这使霍尔意识到只有探索廉价的炼铝方法,才能使铝被普遍应用。
霍尔采用瓷坩埚,碳棒(阳极)和自制电池,对氧化铝,即精制的氧化铝矿进行电解。1886年2月的一天,他终于看到小球状的铝聚集在阴极上。霍尔此时异常激动,带着他第一次获得的一把金属铝球去见他的教授。后来,这些铝球竟成为“王冠宝石”,至今仍珍存在美国制铝公司的陈列厅中。
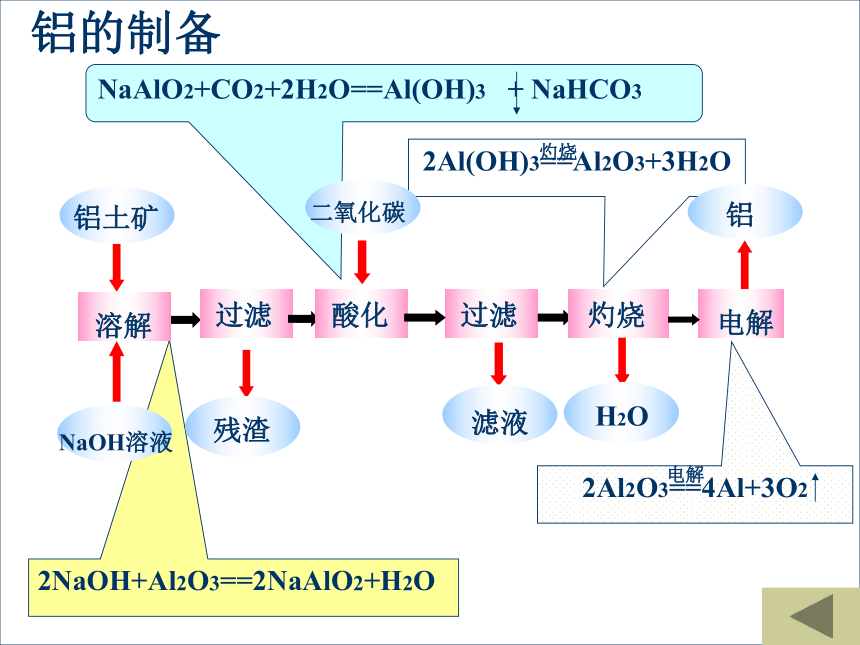
廉价炼铝方法的发明,使铝这种在地壳中含量约占8%的元素,从此成了为人类提供多方面重要用途的材料。而发明家霍尔,当时还不满23周岁。从铝土矿中提取铝一、从铝土矿中提取铝的过程和原理阅读教材P62,写出有关反应化学方程式。2NaOH+Al2O3==2NaAlO2+H2O铝的制备氧化铝( Al2O3 )1、物理性质
白色难熔的固体物质,难溶于水。
2、化学性质
典型的两性氧化物,既能与酸反应生成盐和水,又能与碱反应生成盐和水。
Al2O3+ 6H+ == 2Al3++3H2O
Al2O3+2OH– == 2AlO2– +H2O三:氢氧化铝在氯化铝溶液分两份分别滴加氨水——典型的两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = NaAlO2 + 2H2O两性氢氧化物:既与酸反应又可与碱反应生成
盐和水的氢氧化物。实验1实验1的两支试管分别滴加盐酸和氢氧化钠实验2现象:出现白色沉淀现象:白色沉淀都消失偏铝酸盐与弱酸的反应AlO2- + 2H2O + CO2 == Al(OH)3↓ + HCO3-(过量CO2) Al(OH)3 + NaOH = NaAlO2 + 2H2OAl(OH)3 + 3 H+ == Al3+ + 3H2O 2NaOH+Al2O3==2NaAlO2+H2O偏铝酸盐与强酸的反应AlO2- + H2O + H+ == Al(OH)3↓ 铝及其合金的应用主要用途:常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。生活生产中的铝制品天然氧化铝—刚玉红宝石(Al2O3)蓝宝石(Al2O3)加氨水沉淀溶解沉淀溶解沉淀不溶解思考:
49.13%硅
26%铝7.73%铁钙钠钾镁
14.55% 铝的冶炼史传说拿破仑三世的刀叉具是用铝制造的。筵席上,他为多数客人提供金餐具,而只让少数客人使用铝餐具,是为了让用铝餐具的客人留下更深刻印象。
1885年,在美国首都华盛顿特区落成的华盛顿纪念碑上的顶帽也是用金属铝制造的。
因为在19世纪,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金相当。因为从铝矿石中把铝提炼出来,是极其困难的。1884年,在美国奥伯林学院化学系,有一位叫做查尔斯·马丁·霍尔的青年学生。当时他只有二十一岁。一次,他听一位教授说:“不管谁能发明一种低成本的炼铝法,都会出人头地。”这使霍尔意识到只有探索廉价的炼铝方法,才能使铝被普遍应用。
霍尔采用瓷坩埚,碳棒(阳极)和自制电池,对氧化铝,即精制的氧化铝矿进行电解。1886年2月的一天,他终于看到小球状的铝聚集在阴极上。霍尔此时异常激动,带着他第一次获得的一把金属铝球去见他的教授。后来,这些铝球竟成为“王冠宝石”,至今仍珍存在美国制铝公司的陈列厅中。
廉价炼铝方法的发明,使铝这种在地壳中含量约占8%的元素,从此成了为人类提供多方面重要用途的材料。而发明家霍尔,当时还不满23周岁。从铝土矿中提取铝一、从铝土矿中提取铝的过程和原理阅读教材P62,写出有关反应化学方程式。2NaOH+Al2O3==2NaAlO2+H2O铝的制备氧化铝( Al2O3 )1、物理性质
白色难熔的固体物质,难溶于水。
2、化学性质
典型的两性氧化物,既能与酸反应生成盐和水,又能与碱反应生成盐和水。
Al2O3+ 6H+ == 2Al3++3H2O
Al2O3+2OH– == 2AlO2– +H2O三:氢氧化铝在氯化铝溶液分两份分别滴加氨水——典型的两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = NaAlO2 + 2H2O两性氢氧化物:既与酸反应又可与碱反应生成
盐和水的氢氧化物。实验1实验1的两支试管分别滴加盐酸和氢氧化钠实验2现象:出现白色沉淀现象:白色沉淀都消失偏铝酸盐与弱酸的反应AlO2- + 2H2O + CO2 == Al(OH)3↓ + HCO3-(过量CO2) Al(OH)3 + NaOH = NaAlO2 + 2H2OAl(OH)3 + 3 H+ == Al3+ + 3H2O 2NaOH+Al2O3==2NaAlO2+H2O偏铝酸盐与强酸的反应AlO2- + H2O + H+ == Al(OH)3↓ 铝及其合金的应用主要用途:常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。生活生产中的铝制品天然氧化铝—刚玉红宝石(Al2O3)蓝宝石(Al2O3)加氨水沉淀溶解沉淀溶解沉淀不溶解思考:
