从铝土矿中提取铝
图片预览











文档简介
课件47张PPT。在19世纪中期,法兰西第二共和国总统拿破仑三世,珍藏着一套铝制的餐具,平时舍不得用,直到国宴时才拿出来炫耀一番,而元素周期表的创始人门捷列夫在受到英国皇家学会的表彰时,得到的却是一只铝杯。为什么拿破仑没有珍藏金制的餐具,而门捷列夫也没有给奖励一只金杯呢?从铝土矿到铝合金一、铝的物理性质和应用:1.物理性质:铝为银白色金属,质地柔软,
密度较小(2.70g/cm3),熔沸点较低,
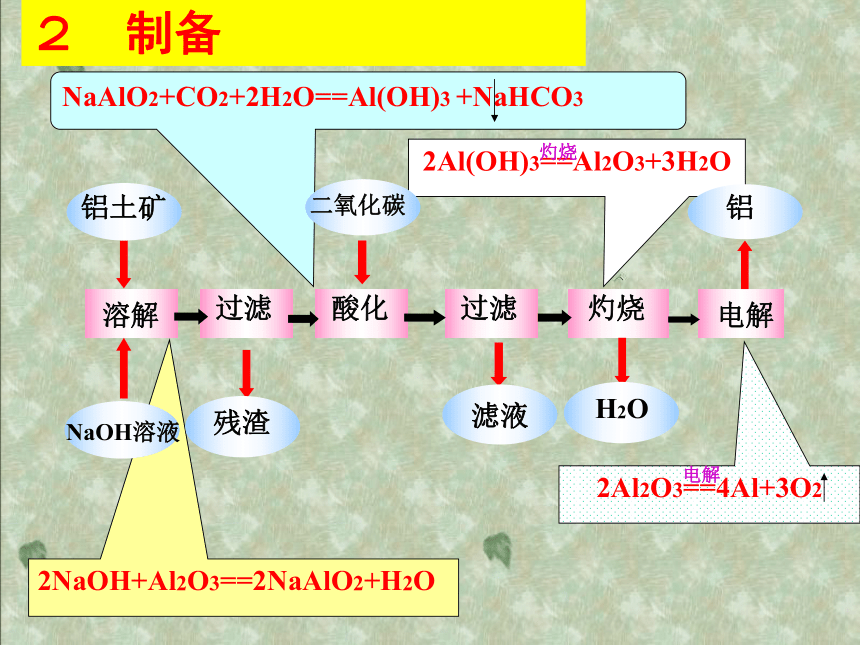
具有良好的导电性、延展性。2. 主要用途:常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。什么叫合金?合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。想一想:列举你所熟悉的铝和铝合金制品,并指出它们分别利用了铝的哪些性质?战斧式巡航导弹二、铝的存在和制备:1铝在自然界以化合态形式存在,铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)是铝元素在地壳中的主要存在形式之一。铝元素占地壳总量的7.73%,是地壳中含量最多的金属。2NaOH+Al2O3==2NaAlO2+H2O2 制备思考:铝是一种较活泼的金属,那为什么其在空气中不易被腐蚀呢?1.与O2、S、Cl2等反应:有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?4Al + 3O2 = 2Al2O3三、铝的化学性质:2.与酸的反应:② 钝化:想一想:铝能与酸反应,为什么工业上还用铝槽车贮运浓硝酸、浓硫酸呢?铝的性质实验无现象无现象表面钝化表面钝化氢氧化钠溶液铝片上产生大量气泡并逸出试一试将表面已完全钝化的铝条投入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠 C3、与强碱溶液或水的反应2Al+6H2O= 2Al(OH)3+3H2↑
? 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
? 2Al(OH)3+2NaOH=2NaAlO2+4H2O ?
2Al+2NaOH+6H2O =2NaAlO2+ 4H2O +3H2↑ 练习:相同物质的量的铝与足量的酸或足量的氢氧化钠反应时,用去的酸和氢氧化钠的物质的量相等吗?产生的氢气的物质的量相等吗?4.与金属氧化物的反应:铝 热 反 应Al的还原性强,且反应能放
出大量的热,将生成物熔化
发出耀眼的光芒写方程式:Al与V2O5 Al与Cr2O3铝热反应的实质是高温下,较活泼的铝置换出较不活泼的金属,工业上常用于冶炼难熔金属,或焊接铁轨。利用铝的强还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物,这类反应被称为铝热反应。练一练和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉
C.氧化钨 D.硫粉C注意铝热反应用于焊接钢轨 焊接铁轨铝热反应用于“定向爆破” ,主要是利用铝热反应熔断钢筋 使楼房定向倒塌 5、铝和盐溶液反应根据金属活动性顺序的应用,铝能把排在它后面的金属从它们的盐溶液中置换出来,如2Al+3CuSO4 =3Cu+Al2(SO4)32Al+3Cu2+=3Cu+2Al3+小结:
一、铝在自然界以化合态形式存在
二、物理性质及用途
三、化学性质
1、与氧气等非金属反应
2、与酸反应
3、与强碱溶液反应
4、与氧化物反应
5、与盐溶液反应练习1:铝粉投入某无色溶液中产生H2,则下列离子组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-试一试AB练习2、向一装满CO2的铝制易拉罐中迅速加入足量NaOH溶液,立即将口封住,摇动易拉罐,经过一段时间后罐壁内凹变瘪,再过一段时间后又鼓起来,解释发生这一现象的原因,并写出必要的化学方程式
①罐壁内凹的原因是----------方程式为---------
②罐壁又鼓起的原因是-------方程式为---------四、铝的化合物1、氧化铝2、氢氧化铝3、明矾(一)氧化铝Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 3H2SO4 = Al2(SO4)3 +3H2O偏铝酸钠两性氧化物既可以和酸反应,又可以和碱反应
生成盐和水的氧化物。——典型的两性氧化物1.物理性质:
氧化铝:高硬度、高沸点,不溶于水的白色固体。常用作耐火材料。2.化学性质:天然氧化铝—刚玉红宝石(Al2O3)蓝宝石(Al2O3)铬元素铁和钛元素(二)氢氧化铝实验在氯化铝溶液中滴加氨水,然后
把产生的沉淀分成三份。——典型的两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = NaAlO2 + 2H2O两性氢氧化物既可以与酸反应又可以与碱反应生成盐和水的氢氧化物。加氨水沉淀溶解沉淀溶解沉淀不溶解典型的两性氢氧化物氢氧化铝电离方程式当Al(OH)3遇碱时反应向左方向发展,遇酸时反
应向右方向发展。 注意:(1)氢氧化铝作为碱时是三元碱;作为酸时
是一元酸(HAlO2)。 (2)氢氧化铝与酸、碱反应时,弱酸弱碱是
不能把氢氧化铝溶解的。(比醋酸弱的)
1.氢氧化铝的物理性质
白色、胶状、难溶的固体
2.化学性质
典型的两性氢氧化物的性质
——与酸、强碱反应生成盐和水Al(OH)3的性质小结:Al(OH)3的制法练习:用离子方程式表示以上转化关系, Al3+和 AlO2? 可以直接相互转化吗? Al(OH)3 +3H+ = Al3+ + 3H2O Al(OH)3+OH- = AlO2- + 2H2O 课堂讨论:
课本P68第6题实验方案设计以铝、盐酸和氢氧化钠溶液为原料制备Al(OH)3实验方案的设计优化途径:1mol3mol1mol1mol3mol3/4mol1mol1mol3/4mol以铝屑为原料制备Al(OH)3实验方案的设计Al(OH)3最佳方案(节省原料):常用净水剂明矾KAl(SO4)2 = K++Al3++2SO42-KAl(SO4)2·12H2OAl3+ +3H2O = Al(OH)3(胶体) +3H+ 吸附能力1.下列关于铝的叙述中,不正确的是:
A.铝属于金属单质,不与任何碱反应
B.铝是地壳中含量最多的金属
C.在常温下,铝不能与氧气反应
D.铝既能与酸反应,也能与强碱反应AC课 堂 练 习2、铝粉投入某无色溶液中产生H2,则下列离子
组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-AB课 堂 练 习3.铝具有较强的抗腐蚀性,主要因为( )
A.铝不活泼??? B.具有两性??
C.铝与氧气在常温下不反应
D.铝表面在常温下能形成一层致密的氧化物薄膜D课 堂 练 习4、将一个用金属铝做的易拉罐内充满CO2,然后
往罐内注入足量的NaOH溶液,立即用胶布密封
罐口。经过一段时间后,罐壁内凹而瘪,再过一段
时间后,瘪了的罐壁重新鼓起来。
(1)罐壁内凹而瘪的原因是___________ ;
(2)罐再鼓起的原因是______________ 。课 堂 练 习5、某金属片浸入烧碱溶液一会,取出洗净,再放入
Hg(NO3)2溶液中,表面逐渐附着层灰白色
固体,取出后用滤纸轻轻地将其表面吸干,然后
将其置于干燥的滤纸上,片刻即观察其表面生长
出白色毛状物,则原金属及毛状物分别是( )
A、Mg HgO B、Al Al2O3
C、Mg Mg D、Al HgO
B课 堂 练 习
密度较小(2.70g/cm3),熔沸点较低,
具有良好的导电性、延展性。2. 主要用途:常用于制造轻质合金,用于飞机、汽车、轮船部件;做导线、炊具、建筑装饰材料等。什么叫合金?合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。特性:合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属。想一想:列举你所熟悉的铝和铝合金制品,并指出它们分别利用了铝的哪些性质?战斧式巡航导弹二、铝的存在和制备:1铝在自然界以化合态形式存在,铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)是铝元素在地壳中的主要存在形式之一。铝元素占地壳总量的7.73%,是地壳中含量最多的金属。2NaOH+Al2O3==2NaAlO2+H2O2 制备思考:铝是一种较活泼的金属,那为什么其在空气中不易被腐蚀呢?1.与O2、S、Cl2等反应:有人对铝制品因为表面氧化出现灰色而总感到不美观,所以常用钢丝球进行擦洗,你认为有必要吗?为什么?4Al + 3O2 = 2Al2O3三、铝的化学性质:2.与酸的反应:② 钝化:想一想:铝能与酸反应,为什么工业上还用铝槽车贮运浓硝酸、浓硫酸呢?铝的性质实验无现象无现象表面钝化表面钝化氢氧化钠溶液铝片上产生大量气泡并逸出试一试将表面已完全钝化的铝条投入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠 C3、与强碱溶液或水的反应2Al+6H2O= 2Al(OH)3+3H2↑
? 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
? 2Al(OH)3+2NaOH=2NaAlO2+4H2O ?
2Al+2NaOH+6H2O =2NaAlO2+ 4H2O +3H2↑ 练习:相同物质的量的铝与足量的酸或足量的氢氧化钠反应时,用去的酸和氢氧化钠的物质的量相等吗?产生的氢气的物质的量相等吗?4.与金属氧化物的反应:铝 热 反 应Al的还原性强,且反应能放
出大量的热,将生成物熔化
发出耀眼的光芒写方程式:Al与V2O5 Al与Cr2O3铝热反应的实质是高温下,较活泼的铝置换出较不活泼的金属,工业上常用于冶炼难熔金属,或焊接铁轨。利用铝的强还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物,这类反应被称为铝热反应。练一练和铝粉可以发生铝热反应的是 ( )
A.氧化钠 B.镁粉
C.氧化钨 D.硫粉C注意铝热反应用于焊接钢轨 焊接铁轨铝热反应用于“定向爆破” ,主要是利用铝热反应熔断钢筋 使楼房定向倒塌 5、铝和盐溶液反应根据金属活动性顺序的应用,铝能把排在它后面的金属从它们的盐溶液中置换出来,如2Al+3CuSO4 =3Cu+Al2(SO4)32Al+3Cu2+=3Cu+2Al3+小结:
一、铝在自然界以化合态形式存在
二、物理性质及用途
三、化学性质
1、与氧气等非金属反应
2、与酸反应
3、与强碱溶液反应
4、与氧化物反应
5、与盐溶液反应练习1:铝粉投入某无色溶液中产生H2,则下列离子组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-试一试AB练习2、向一装满CO2的铝制易拉罐中迅速加入足量NaOH溶液,立即将口封住,摇动易拉罐,经过一段时间后罐壁内凹变瘪,再过一段时间后又鼓起来,解释发生这一现象的原因,并写出必要的化学方程式
①罐壁内凹的原因是----------方程式为---------
②罐壁又鼓起的原因是-------方程式为---------四、铝的化合物1、氧化铝2、氢氧化铝3、明矾(一)氧化铝Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 3H2SO4 = Al2(SO4)3 +3H2O偏铝酸钠两性氧化物既可以和酸反应,又可以和碱反应
生成盐和水的氧化物。——典型的两性氧化物1.物理性质:
氧化铝:高硬度、高沸点,不溶于水的白色固体。常用作耐火材料。2.化学性质:天然氧化铝—刚玉红宝石(Al2O3)蓝宝石(Al2O3)铬元素铁和钛元素(二)氢氧化铝实验在氯化铝溶液中滴加氨水,然后
把产生的沉淀分成三份。——典型的两性氢氧化物Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = NaAlO2 + 2H2O两性氢氧化物既可以与酸反应又可以与碱反应生成盐和水的氢氧化物。加氨水沉淀溶解沉淀溶解沉淀不溶解典型的两性氢氧化物氢氧化铝电离方程式当Al(OH)3遇碱时反应向左方向发展,遇酸时反
应向右方向发展。 注意:(1)氢氧化铝作为碱时是三元碱;作为酸时
是一元酸(HAlO2)。 (2)氢氧化铝与酸、碱反应时,弱酸弱碱是
不能把氢氧化铝溶解的。(比醋酸弱的)
1.氢氧化铝的物理性质
白色、胶状、难溶的固体
2.化学性质
典型的两性氢氧化物的性质
——与酸、强碱反应生成盐和水Al(OH)3的性质小结:Al(OH)3的制法练习:用离子方程式表示以上转化关系, Al3+和 AlO2? 可以直接相互转化吗? Al(OH)3 +3H+ = Al3+ + 3H2O Al(OH)3+OH- = AlO2- + 2H2O 课堂讨论:
课本P68第6题实验方案设计以铝、盐酸和氢氧化钠溶液为原料制备Al(OH)3实验方案的设计优化途径:1mol3mol1mol1mol3mol3/4mol1mol1mol3/4mol以铝屑为原料制备Al(OH)3实验方案的设计Al(OH)3最佳方案(节省原料):常用净水剂明矾KAl(SO4)2 = K++Al3++2SO42-KAl(SO4)2·12H2OAl3+ +3H2O = Al(OH)3(胶体) +3H+ 吸附能力1.下列关于铝的叙述中,不正确的是:
A.铝属于金属单质,不与任何碱反应
B.铝是地壳中含量最多的金属
C.在常温下,铝不能与氧气反应
D.铝既能与酸反应,也能与强碱反应AC课 堂 练 习2、铝粉投入某无色溶液中产生H2,则下列离子
组合可存在于该无色溶液中的是 ( )
A. H+,Mg2+,Ba2+,Cl-
B. OH-, NO3- , Cl-, Ba2+
C. H+,Cu2+,K+ ,SO42-
D. OH-, Mg2+, CO32-, NO3-AB课 堂 练 习3.铝具有较强的抗腐蚀性,主要因为( )
A.铝不活泼??? B.具有两性??
C.铝与氧气在常温下不反应
D.铝表面在常温下能形成一层致密的氧化物薄膜D课 堂 练 习4、将一个用金属铝做的易拉罐内充满CO2,然后
往罐内注入足量的NaOH溶液,立即用胶布密封
罐口。经过一段时间后,罐壁内凹而瘪,再过一段
时间后,瘪了的罐壁重新鼓起来。
(1)罐壁内凹而瘪的原因是___________ ;
(2)罐再鼓起的原因是______________ 。课 堂 练 习5、某金属片浸入烧碱溶液一会,取出洗净,再放入
Hg(NO3)2溶液中,表面逐渐附着层灰白色
固体,取出后用滤纸轻轻地将其表面吸干,然后
将其置于干燥的滤纸上,片刻即观察其表面生长
出白色毛状物,则原金属及毛状物分别是( )
A、Mg HgO B、Al Al2O3
C、Mg Mg D、Al HgO
B课 堂 练 习
