分散系--电解质与非电解质(福建省漳州市)
文档属性
| 名称 | 分散系--电解质与非电解质(福建省漳州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 266.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-10-07 00:00:00 | ||
图片预览




文档简介
课件12张PPT。物质的分散系(二)
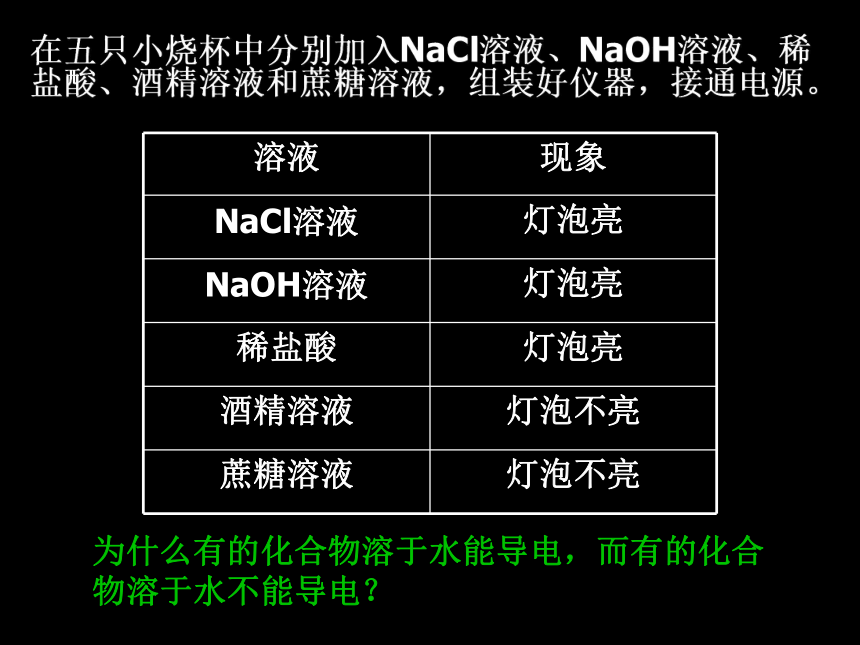
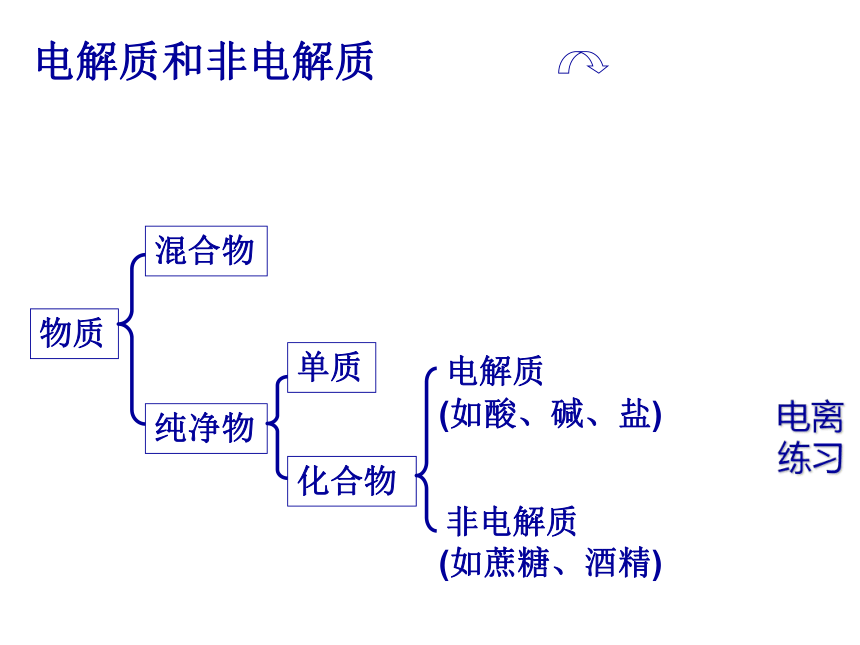
----电解质与非电解质在五只小烧杯中分别加入NaCl溶液、NaOH溶液、稀盐酸、酒精溶液和蔗糖溶液,组装好仪器,接通电源。 为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电?电解质和非电解质物质混合物纯净物单质化合物电解质非电解质(如酸、碱、盐)(如蔗糖、酒精)练习电离电解质:在水溶液中或者熔融状态下能导电的化合物。非电解质:无论在水溶液中还是在熔融状态下均以分子形式存在,都不能导电的化合物。电解质与非电解质的概念:思考1: 电解质导电必须是用化合物本身能电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电。如:CO2、SO2溶于水能导电,是由于它们与水反应生成的H2CO3、H2SO3能导电,而不是本身能够导电,所以CO2、SO2不是电解质。 CO2、SO2是否属于电解质,请说出理由?思考2: CaCO3、BaSO4 、AgCl是否属于电解质,请说出理由? CaCO3、BaSO4 、AgCl是属于电解质,虽然在水中难溶,但他们熔融状态能电离出离子,或溶解时,溶解的那一小部分也能电离出离子,所以能导电.所以是否是电解质与溶解度无关,只与是否电离出离子有关.电离方程式:
NaCl = Na++Cl-
H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。电离方程式书写的方法:5、检验“=”两边是否守恒(质量、电荷)1、写出化学式2、阳离子,阴离子——离子所带的电荷与相应的化合价相同4、阴、阳离子前面配上系数——阴、阳离子所带的电荷总数相等(方程式中正负电荷代数和为0)3、原子团不能拆开写,如OH-,SO42-等。NaCl = Na++Cl- H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-写出下列物质的电离方程式:HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl--2Al3+ + 3SO42--Ba2+ + 2Cl--Ag+ + NO3--判断下列说法是否正确
1、Cu单质可以导电,所以Cu是电解质
2、NaCl溶液有很好的导电性,所以NaCl溶液是电解质
3、SO2溶于水得到H2SO3(亚硫酸),也具有导电性所以是电解质
4、CaCO3,BaSO4在水中溶解性很小,导电性也不好,所以是非电解质××××练习:下列物质中① CO2 ② HNO3 ③KOH ④石墨⑤ Fe ⑥葡萄糖 ⑦Na2CO3 ⑧酒精 ⑨食盐水 (1)属于电解质的是_______________
(2)属于非电解质的是_____________(3)写出电解质的电离方程式②③⑦①⑥⑧HNO3 = H++NO3-
KOH = K+ + OH-
Na2CO3 = 2Na+ + CO32-练习:注意:(1)、电解质、非电解质它们都是化合物,单质、混合物既不属于电解质,也不属于非电解质。(2) 、电解质必须在水溶液或熔融状态下才能导电。(3)能导电的并不一定是电解质(3)、酸,碱,和大多数盐是电解质;
大部分气体、有机物为非电解质。(5)NH3, CO2,SO2,SO3,P2O5等物质的水溶液虽然能导电,但是属于非电解质。(4)、是否为电解质与溶解度无关,只与是否电离出离子有关,如BaSO4,CaCO3等难溶物质是电解质。(5)、水是电解质。
----电解质与非电解质在五只小烧杯中分别加入NaCl溶液、NaOH溶液、稀盐酸、酒精溶液和蔗糖溶液,组装好仪器,接通电源。 为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电?电解质和非电解质物质混合物纯净物单质化合物电解质非电解质(如酸、碱、盐)(如蔗糖、酒精)练习电离电解质:在水溶液中或者熔融状态下能导电的化合物。非电解质:无论在水溶液中还是在熔融状态下均以分子形式存在,都不能导电的化合物。电解质与非电解质的概念:思考1: 电解质导电必须是用化合物本身能电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电。如:CO2、SO2溶于水能导电,是由于它们与水反应生成的H2CO3、H2SO3能导电,而不是本身能够导电,所以CO2、SO2不是电解质。 CO2、SO2是否属于电解质,请说出理由?思考2: CaCO3、BaSO4 、AgCl是否属于电解质,请说出理由? CaCO3、BaSO4 、AgCl是属于电解质,虽然在水中难溶,但他们熔融状态能电离出离子,或溶解时,溶解的那一小部分也能电离出离子,所以能导电.所以是否是电解质与溶解度无关,只与是否电离出离子有关.电离方程式:
NaCl = Na++Cl-
H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。电离方程式书写的方法:5、检验“=”两边是否守恒(质量、电荷)1、写出化学式2、阳离子,阴离子——离子所带的电荷与相应的化合价相同4、阴、阳离子前面配上系数——阴、阳离子所带的电荷总数相等(方程式中正负电荷代数和为0)3、原子团不能拆开写,如OH-,SO42-等。NaCl = Na++Cl- H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-写出下列物质的电离方程式:HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl--2Al3+ + 3SO42--Ba2+ + 2Cl--Ag+ + NO3--判断下列说法是否正确
1、Cu单质可以导电,所以Cu是电解质
2、NaCl溶液有很好的导电性,所以NaCl溶液是电解质
3、SO2溶于水得到H2SO3(亚硫酸),也具有导电性所以是电解质
4、CaCO3,BaSO4在水中溶解性很小,导电性也不好,所以是非电解质××××练习:下列物质中① CO2 ② HNO3 ③KOH ④石墨⑤ Fe ⑥葡萄糖 ⑦Na2CO3 ⑧酒精 ⑨食盐水 (1)属于电解质的是_______________
(2)属于非电解质的是_____________(3)写出电解质的电离方程式②③⑦①⑥⑧HNO3 = H++NO3-
KOH = K+ + OH-
Na2CO3 = 2Na+ + CO32-练习:注意:(1)、电解质、非电解质它们都是化合物,单质、混合物既不属于电解质,也不属于非电解质。(2) 、电解质必须在水溶液或熔融状态下才能导电。(3)能导电的并不一定是电解质(3)、酸,碱,和大多数盐是电解质;
大部分气体、有机物为非电解质。(5)NH3, CO2,SO2,SO3,P2O5等物质的水溶液虽然能导电,但是属于非电解质。(4)、是否为电解质与溶解度无关,只与是否电离出离子有关,如BaSO4,CaCO3等难溶物质是电解质。(5)、水是电解质。
