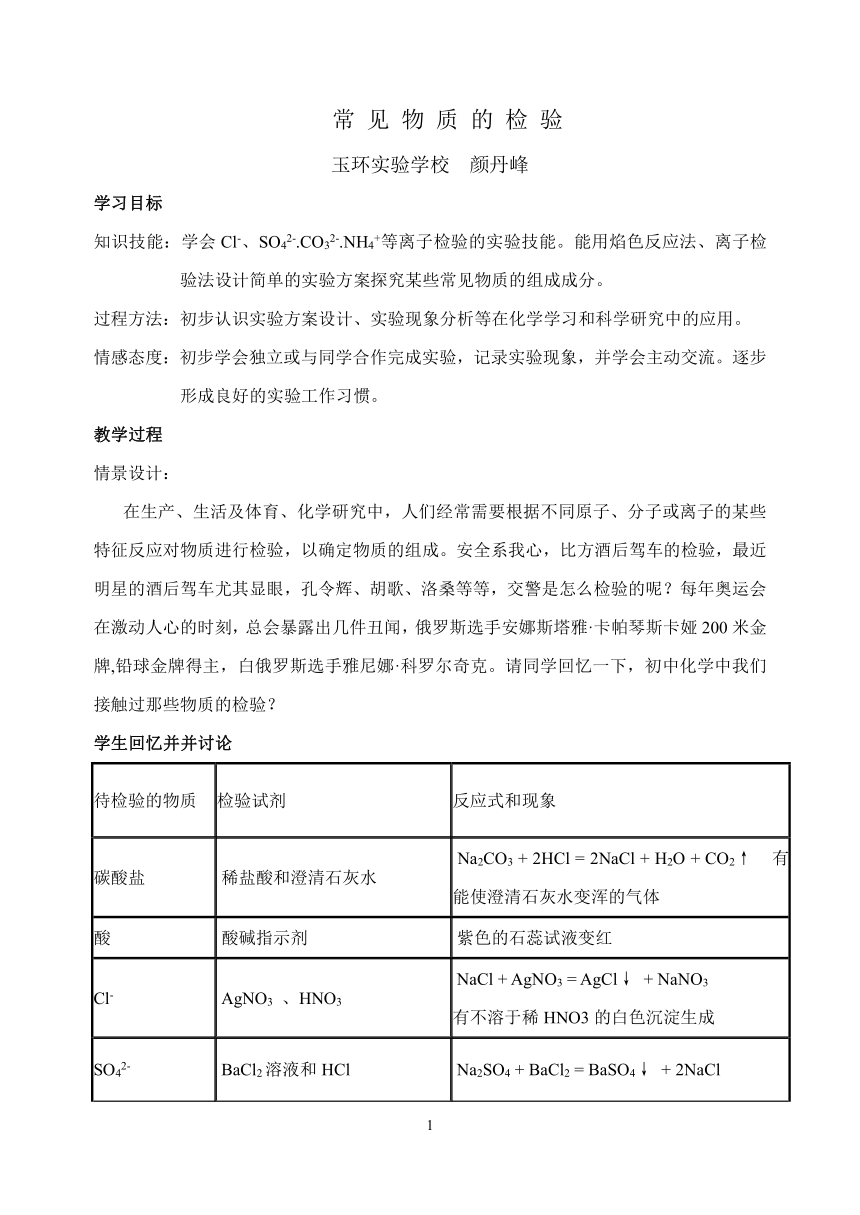
常 见 物 质 的 检 验
图片预览


文档简介
常 见 物 质 的 检 验
玉环实验学校 颜丹峰
学习目标
知识技能:学会Cl-、SO42-.CO32-.NH4+等离子检验的实验技能。能用焰色反应法、离子检验法设计简单的实验方案探究某些常见物质的组成成分。
过程方法:初步认识实验方案设计、实验现象分析等在化学学习和科学研究中的应用。
情感态度:初步学会独立或与同学合作完成实验,记录实验现象,并学会主动交流。逐步形成良好的实验工作习惯。
教学过程
情景设计:
在生产、生活及体育、化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成。安全系我心,比方酒后驾车的检验,最近明星的酒后驾车尤其显眼,孔令辉、胡歌、洛桑等等,交警是怎么检验的呢?每年奥运会在激动人心的时刻,总会暴露出几件丑闻,俄罗斯选手安娜斯塔雅·卡帕琴斯卡娅200米金牌,铅球金牌得主,白俄罗斯选手雅尼娜·科罗尔奇克。请同学回忆一下,初中化学中我们接触过那些物质的检验?
学生回忆并并讨论
待检验的物质 检验试剂 反应式和现象
碳酸盐 稀盐酸和澄清石灰水 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 有能使澄清石灰水变浑的气体
酸 酸碱指示剂 紫色的石蕊试液变红
Cl- AgNO3 、HNO3 NaCl + AgNO3 = AgCl↓ + NaNO3有不溶于稀HNO3的白色沉淀生成
SO42- BaCl2溶液和HCl Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl有不溶于稀HCl的白色沉淀生成
NH4+ NaOH溶液和红色石蕊试纸 NH4Cl + NaOH = NaCl + NH3↑ + H2O 湿润的红色试纸变蓝
师:那我们就用已知知识来检验下列为何物质吧?
实验探究:
演示:课本19页活动与探究1。
根据学过的知识请同学设计实验把氯化铵、硫酸铵、氯化钾、硫酸钾四种白色化肥区分开来。
学生设计实验方案
教师循视并参与讨论
方案1:实验步骤:(NH4)2SO4和K2SO4各少量,各滴几滴稀HCl ,再各滴几滴BaCl2
实验现象:闻气味及观试纸颜色的变化
方案2:实验步骤:NH4Cl和(NH4)2SO4各2mL,分别2mLNaOH,稍加热,将先准备好的湿润的试纸靠近试管口
实验现象:闻气味及观试纸颜色的变化
方案3:实验步骤:NH4Cl和KCl各少量2mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3
实验现象:观察液体变化
教师肯定学生的方案:请同学们通过实验检验设计方案的正确性。
教师演示或者学生演示
交流讨论、整理归纳:一些物质的检验方法。
铵盐是通过铵盐与强碱溶液混合加热时有氨气放出。如氯化铵与氢氧化钠混合溶液的反应。(学生写出化学反应方程式)。氨气能使湿润的红色石试纸变蓝。人们常用氨的这一性质来检验铵根离子。
盐酸、氯化钠、氯化铵等溶液中的氯离子能与硝酸银溶液中的银离子反应,生成氯化银白色沉淀,该沉淀不溶于稀硝酸。(学生写出化学反应方程式)。化学上常用这种方法检验溶液中是否含有氯离子。
溶液中的硫酸根离子能与氯化钡溶液中的钡离子反应,生成硫酸钡白色沉淀,该沉淀不溶于稀盐酸。(学生写出化学反应方程式)。
人们常用向溶液中加入酸性氯化钡溶液的方法来检验溶液中是否含有硫酸根离子。
教师设问:①只用一种试剂鉴别Cl-和SO42-时,能否选用AgNO3溶液?
②现有一瓶NaCl溶液和一瓶KCl溶液,用我们以前学过的检验方法能不能鉴别开来
引入焰色反应
演示:氯化钠、硫酸钠、氯化钾、硫酸钾的焰色反应。
指出许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫焰色反应。
根据火焰所呈现的特征焰色,可以检验金属或金属离子的存在。
交流讨论、整理归纳:
注意事项:
1、铂丝在灯焰上灼烧至无色再蘸取试样
2、要用盐酸洗涤铂丝
3、观察钾的焰色时,要透过蓝色钴玻璃
4、焰色反应是物理变化
师追问:既然我们又学了一种新的鉴别方法,那鉴别氯化铵、硫酸铵、氯化钾、硫酸钾有没有新的方案呢?
学生思考:
教师表扬:请同学们归纳一下学过的几种物质的检验方法。
介绍性信息博览
现代化学分析测试中,常用一些仪器来分析化学物质的组成。如红外光谱仪,原子吸收光谱仪等。
红外光谱法
红外光谱法是鉴别化合物和确定物质分子结构的常用手段之一。对单一组分或混合物中各组分也可以进行定量分析,尤其是对于一些较难分离并在紫外、可见区找不到明显特征峰的样品也可以方便、迅速地完成定量分析。随着计算机的高速发展,光声光谱、时间分辨光谱和联用技术更有独到之处,红外与色谱联用可以进行多组分样品的分离和定性;与显微镜红外联用可进行微区(10μm×10μm)和微量(10-12g)样品的分析鉴定;与热失重联用可进行材料的热稳定性研究;与拉曼光谱联用可得到红外光谱弱吸收的信息。这些新技术为物质结构的研究提供了更多的手段,使红外光谱法广泛地应用于有机化学、高分子化学、无机化学、化工、催化、石油、材料、生物、医药、环境等领域。
红外光谱仪的发展大体可分为三代,第一代是用棱镜作为分光元件,其缺点是分辨率较低,仪器的操作环境要求恒温恒湿等;第二代是衍射光栅作为分光元件,与第一代相比,分辨率大大提高、能量较高、价格较便宜、对恒温恒湿的要求不高;第三代红外光谱仪是20世纪70年代以后发展起来的傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy, FTIR),傅里叶变换红外光谱仪具有高光通量、低噪音、测量速度快、分辨率高、波数准确度高、光谱范围宽等优点。但是,通常的透射红外光谱,即使是傅里叶变换透射红外光谱,都存在如下不足:①固体压片或液膜法制样麻烦,光程很难控制一致,给测量结果带来误差。另外,无论是添加红外惰性物质或是压制自支撑片,都会给粉末状态的样品造成形态变化或表面污染,使其在一定程度上失去其“本来面目”。②大多数物质都有独特的红外吸收,多组分共存时,普遍存在谱峰重叠现象。③透射样品池无法解决催化气相反应中反应物的“短路”问题,使得催化剂表面的吸附物种浓度较低,影响检测的灵敏度。④不能用于原位(在线)研究,只能在少数研究中应用。因此,漫反射傅里叶变换红外光谱技术和衰减全反射傅里叶变换红外光谱技术应运而生。
课堂训练
1.溶液中可能有下列阴离子中的一种或几种:SO、、CO、Cl-。
(1)当溶液中有大量H+存在时,则不可能有______存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有______存在。
(3)当溶液中有______和______的阳离子存在时,上述所有阴离子都不可能存在。
2.为了除去粗盐中Ca2+、Mg2+、SO及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( CD )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
3.实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_____或_____仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断SO已除尽,方法是__________。
(4)操作③的目的是_________,为什么不先过滤后加碳酸钠溶液?理由是________。
(5)操作④的目的是____________________________________。
答案:(1)蒸发皿坩埚
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO,以后操作中无法除去
(3)取上层清液加入BaCl2溶液,若无沉淀说明SO已除尽
(4)除去过量的Ba2+减少一次过滤操作
(5)除去溶解在溶液中的CO2
课后记:本节课从明星的故事出发,容易激发学生的兴趣,从初中的常见物质的检验来回归知识,衔接比较自然,这堂课如果采取学生实验,效果会更好,但是从目前的实验课堂效果来讲,都不尽如意,是教师本身开设太少,还是学生过于激动,导致不好控制呢?
玉环实验学校 颜丹峰
2006-9-29
K2SO4
KCl
白色沉淀
无沉淀
BaCl2溶液,稀HCl
KCl,K2SO4
(NH4)2SO4
NH4Cl
白色沉淀
无沉淀
BaCl2溶液,稀HCl
NH4Cl,(NH4)2SO4
火焰呈紫色(透过蓝色钴玻璃观察)
无焰色反应现象
焰色反应
NH4Cl,(NH4)2SO4,KCl,K2SO4
实验方案4
PAGE
1
玉环实验学校 颜丹峰
学习目标
知识技能:学会Cl-、SO42-.CO32-.NH4+等离子检验的实验技能。能用焰色反应法、离子检验法设计简单的实验方案探究某些常见物质的组成成分。
过程方法:初步认识实验方案设计、实验现象分析等在化学学习和科学研究中的应用。
情感态度:初步学会独立或与同学合作完成实验,记录实验现象,并学会主动交流。逐步形成良好的实验工作习惯。
教学过程
情景设计:
在生产、生活及体育、化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成。安全系我心,比方酒后驾车的检验,最近明星的酒后驾车尤其显眼,孔令辉、胡歌、洛桑等等,交警是怎么检验的呢?每年奥运会在激动人心的时刻,总会暴露出几件丑闻,俄罗斯选手安娜斯塔雅·卡帕琴斯卡娅200米金牌,铅球金牌得主,白俄罗斯选手雅尼娜·科罗尔奇克。请同学回忆一下,初中化学中我们接触过那些物质的检验?
学生回忆并并讨论
待检验的物质 检验试剂 反应式和现象
碳酸盐 稀盐酸和澄清石灰水 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 有能使澄清石灰水变浑的气体
酸 酸碱指示剂 紫色的石蕊试液变红
Cl- AgNO3 、HNO3 NaCl + AgNO3 = AgCl↓ + NaNO3有不溶于稀HNO3的白色沉淀生成
SO42- BaCl2溶液和HCl Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl有不溶于稀HCl的白色沉淀生成
NH4+ NaOH溶液和红色石蕊试纸 NH4Cl + NaOH = NaCl + NH3↑ + H2O 湿润的红色试纸变蓝
师:那我们就用已知知识来检验下列为何物质吧?
实验探究:
演示:课本19页活动与探究1。
根据学过的知识请同学设计实验把氯化铵、硫酸铵、氯化钾、硫酸钾四种白色化肥区分开来。
学生设计实验方案
教师循视并参与讨论
方案1:实验步骤:(NH4)2SO4和K2SO4各少量,各滴几滴稀HCl ,再各滴几滴BaCl2
实验现象:闻气味及观试纸颜色的变化
方案2:实验步骤:NH4Cl和(NH4)2SO4各2mL,分别2mLNaOH,稍加热,将先准备好的湿润的试纸靠近试管口
实验现象:闻气味及观试纸颜色的变化
方案3:实验步骤:NH4Cl和KCl各少量2mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3
实验现象:观察液体变化
教师肯定学生的方案:请同学们通过实验检验设计方案的正确性。
教师演示或者学生演示
交流讨论、整理归纳:一些物质的检验方法。
铵盐是通过铵盐与强碱溶液混合加热时有氨气放出。如氯化铵与氢氧化钠混合溶液的反应。(学生写出化学反应方程式)。氨气能使湿润的红色石试纸变蓝。人们常用氨的这一性质来检验铵根离子。
盐酸、氯化钠、氯化铵等溶液中的氯离子能与硝酸银溶液中的银离子反应,生成氯化银白色沉淀,该沉淀不溶于稀硝酸。(学生写出化学反应方程式)。化学上常用这种方法检验溶液中是否含有氯离子。
溶液中的硫酸根离子能与氯化钡溶液中的钡离子反应,生成硫酸钡白色沉淀,该沉淀不溶于稀盐酸。(学生写出化学反应方程式)。
人们常用向溶液中加入酸性氯化钡溶液的方法来检验溶液中是否含有硫酸根离子。
教师设问:①只用一种试剂鉴别Cl-和SO42-时,能否选用AgNO3溶液?
②现有一瓶NaCl溶液和一瓶KCl溶液,用我们以前学过的检验方法能不能鉴别开来
引入焰色反应
演示:氯化钠、硫酸钠、氯化钾、硫酸钾的焰色反应。
指出许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫焰色反应。
根据火焰所呈现的特征焰色,可以检验金属或金属离子的存在。
交流讨论、整理归纳:
注意事项:
1、铂丝在灯焰上灼烧至无色再蘸取试样
2、要用盐酸洗涤铂丝
3、观察钾的焰色时,要透过蓝色钴玻璃
4、焰色反应是物理变化
师追问:既然我们又学了一种新的鉴别方法,那鉴别氯化铵、硫酸铵、氯化钾、硫酸钾有没有新的方案呢?
学生思考:
教师表扬:请同学们归纳一下学过的几种物质的检验方法。
介绍性信息博览
现代化学分析测试中,常用一些仪器来分析化学物质的组成。如红外光谱仪,原子吸收光谱仪等。
红外光谱法
红外光谱法是鉴别化合物和确定物质分子结构的常用手段之一。对单一组分或混合物中各组分也可以进行定量分析,尤其是对于一些较难分离并在紫外、可见区找不到明显特征峰的样品也可以方便、迅速地完成定量分析。随着计算机的高速发展,光声光谱、时间分辨光谱和联用技术更有独到之处,红外与色谱联用可以进行多组分样品的分离和定性;与显微镜红外联用可进行微区(10μm×10μm)和微量(10-12g)样品的分析鉴定;与热失重联用可进行材料的热稳定性研究;与拉曼光谱联用可得到红外光谱弱吸收的信息。这些新技术为物质结构的研究提供了更多的手段,使红外光谱法广泛地应用于有机化学、高分子化学、无机化学、化工、催化、石油、材料、生物、医药、环境等领域。
红外光谱仪的发展大体可分为三代,第一代是用棱镜作为分光元件,其缺点是分辨率较低,仪器的操作环境要求恒温恒湿等;第二代是衍射光栅作为分光元件,与第一代相比,分辨率大大提高、能量较高、价格较便宜、对恒温恒湿的要求不高;第三代红外光谱仪是20世纪70年代以后发展起来的傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy, FTIR),傅里叶变换红外光谱仪具有高光通量、低噪音、测量速度快、分辨率高、波数准确度高、光谱范围宽等优点。但是,通常的透射红外光谱,即使是傅里叶变换透射红外光谱,都存在如下不足:①固体压片或液膜法制样麻烦,光程很难控制一致,给测量结果带来误差。另外,无论是添加红外惰性物质或是压制自支撑片,都会给粉末状态的样品造成形态变化或表面污染,使其在一定程度上失去其“本来面目”。②大多数物质都有独特的红外吸收,多组分共存时,普遍存在谱峰重叠现象。③透射样品池无法解决催化气相反应中反应物的“短路”问题,使得催化剂表面的吸附物种浓度较低,影响检测的灵敏度。④不能用于原位(在线)研究,只能在少数研究中应用。因此,漫反射傅里叶变换红外光谱技术和衰减全反射傅里叶变换红外光谱技术应运而生。
课堂训练
1.溶液中可能有下列阴离子中的一种或几种:SO、、CO、Cl-。
(1)当溶液中有大量H+存在时,则不可能有______存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有______存在。
(3)当溶液中有______和______的阳离子存在时,上述所有阴离子都不可能存在。
2.为了除去粗盐中Ca2+、Mg2+、SO及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( CD )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
3.实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①可选择_____或_____仪器。
(2)操作②是否可改为加硝酸钡溶液?为什么?
(3)进行操作②后,如何判断SO已除尽,方法是__________。
(4)操作③的目的是_________,为什么不先过滤后加碳酸钠溶液?理由是________。
(5)操作④的目的是____________________________________。
答案:(1)蒸发皿坩埚
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO,以后操作中无法除去
(3)取上层清液加入BaCl2溶液,若无沉淀说明SO已除尽
(4)除去过量的Ba2+减少一次过滤操作
(5)除去溶解在溶液中的CO2
课后记:本节课从明星的故事出发,容易激发学生的兴趣,从初中的常见物质的检验来回归知识,衔接比较自然,这堂课如果采取学生实验,效果会更好,但是从目前的实验课堂效果来讲,都不尽如意,是教师本身开设太少,还是学生过于激动,导致不好控制呢?
玉环实验学校 颜丹峰
2006-9-29
K2SO4
KCl
白色沉淀
无沉淀
BaCl2溶液,稀HCl
KCl,K2SO4
(NH4)2SO4
NH4Cl
白色沉淀
无沉淀
BaCl2溶液,稀HCl
NH4Cl,(NH4)2SO4
火焰呈紫色(透过蓝色钴玻璃观察)
无焰色反应现象
焰色反应
NH4Cl,(NH4)2SO4,KCl,K2SO4
实验方案4
PAGE
1
