专题三第一单元铝的化合物和氢氧化物(浙江省舟山市)
文档属性
| 名称 | 专题三第一单元铝的化合物和氢氧化物(浙江省舟山市) |  | |
| 格式 | rar | ||
| 文件大小 | 82.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-10-11 07:20:00 | ||
图片预览








文档简介
课件29张PPT。铝及其化合物一、学习目标
1.了解地壳中铝元素的含量,知道铝元素在自然界中的主要存在形式,了解工业上从铝土矿获得铝的方法,从金属铝冶炼方法的变化体验化学科学的发展对人类生活的影响。
2.知道铝、氧化铝和氢氧化铝的性质,了解铝及其化合物在生产生活中的重要应用,进一步认识化学与生产生活的关系。
3.了解两性氧化物和两性氢氧化物的概念,知道氧化铝和氢氧化铝分别是两性氧化物和两性氢氧化物。
。
铝的物理性质铝是一种较软的银白色金属固体.
密度是2.70g/cm3(铁的密度7.86g/cm3)
熔点660.4oC,沸点2467 oC
具有较强的韧性,延展性,良好的导电
性,导热性.
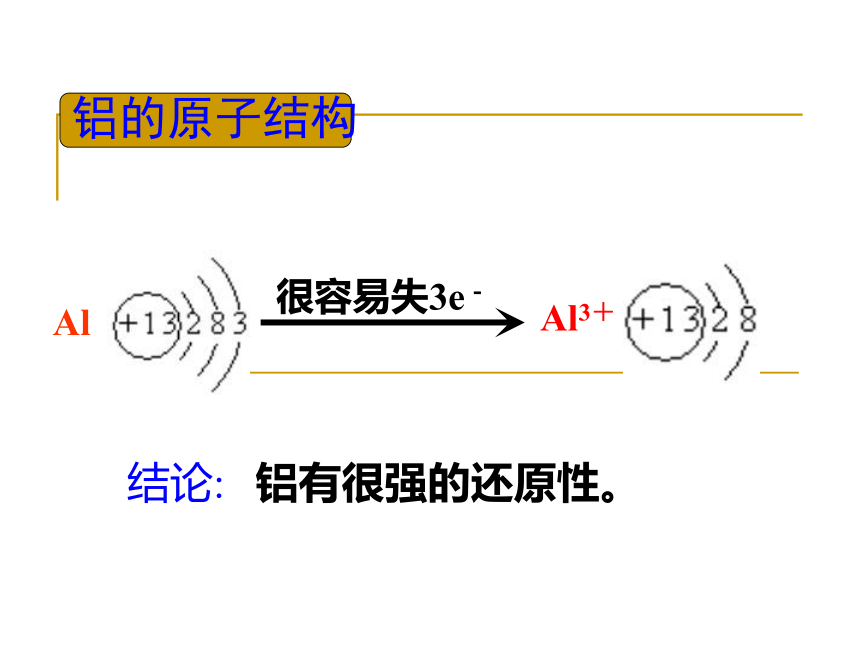
地壳中各元素含量前5位:氧,硅,铝,铁,钙.铝的原子结构结论:铝有很强的还原性。Al3+Al 铝的化学性质铝和非金属单质的反应
注:常温下铝和空气中的氧气反应生成致密的氧化物保护膜,故空气中铝有较好的抗腐蚀性
铝和水的反应铝和冷水不反应,与热水缓慢反应
2Al+6H2O===2Al(OH)3+3H2↑
回顾钠,镁和水的反应,得出什么结论?
反应的条件和反应速率,在判断物质性质中的作用加热与酸反应①在冷的浓硫酸、浓硝酸中钝化。③与稀硫酸,盐酸反应产生氢气。铝和碱的反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
NaAlO2读作偏铝酸钠,HAlO2即为偏铝酸
小结:铝是一种既能和酸反应又能和碱反应的物质铝热反应及其用途定义:铝粉还原金属氧化物的反应
铝热剂:铝粉和被还原的金属氧化物的混合物
特点:反应放出大量的热
用途:冶炼金属,野外焊接
下列为铝或铝合金的各种用途,在后面的横线上写出所根据的性质。
(1)制造飞机或汽车外壳
(2)作为储存浓硫酸的容器
(3)制造各种日用炊具
(4)铝热法冶炼金属
(5)制造电线电缆
(6)制造包装用的铝箔 氧化铝的物理性质熔点2054 oC,沸点2980 oC,高硬度
不溶与水的白色固体
重点:高熔点,高硬度
下图为氧化铝的应用
耐火
砖刚玉耐磨球红宝石两性氧化物:既可以与酸反应也可以与碱
反应生成盐与水的氧化物.Al2O3+2NaOH =2NaAlO2+H2OAl2O3+3H2SO4 = Al2(SO4)3+3H2O偏铝酸钠:NaAlO2 偏铝酸:HAlO2
工业制取铝的最后一步反应(注意:氧化铝中添加冰晶石的目的)
2Al2O3(熔融) ===4Al+3O2↑通电氢氧化铝的化学性质Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O两性氢氧化物:既能跟酸反应又能跟碱反应的氢氧化物.反应原理:(Al(OH)3的双向电离)碱式电离:Al(OH)3 Al3++3OH-酸式电离:Al(OH)3 H2O+AlO2-+H+注:在酸式电离中Al(OH)3可写成H3AlO3(铝酸)氢氧化铝的分解
2Al(0H)3=== Al2O3+ 3H2O
举一反三:氢氧化铁,氢氧化铜等不溶性氢氧化物有类似的性质
加热Al3+和强碱反应 AlCl3+3NaOH=Al(0H)3↓+3NaCl沉淀完全后,继续加入 NaOHAl(0H)3+NaOH=NaAlO2+2H2O将上面两个反应相加得:AlCl3+4NaOH=NaAlO2+ 3NaCl+2H2O写成离子方程式:Al3++3OH- =Al(0H)3 ↓(碱少量)Al3++4OH- =AlO2-+2H2O(碱过量)沉淀被溶解Al3+和弱碱反应AlCl3+3NH3.H2O=Al(0H)3↓+3NH4Cl
沉淀完全后,继续滴加氨水:沉淀不溶解
注意Al3+和强碱反应的区别
写成离子方程式
Al3++3NH3.H2O=Al(0H)3 ↓+3NH4+
故,用Al3+制取Al(0H)3用弱碱更合适3NH4OH AlO2-与强酸的反应NaAlO2+HCl+H2O=Al(0H)3 ↓ +NaCl
沉淀完全后,继续加入盐酸,
Al(OH)3+3HCl=AlCl3+3H2O
将上面两化学反应加和得
NaAlO2+4HCl=AlCl3+2H2O +NaCl
写成离子方程式
AlO2-+H++H2O=Al(0H)3 ↓(酸少量)
AlO2-+4H+= Al3++2H2O(酸过量)H3AlO3 ↓沉淀被溶解AlO2-与弱酸的反应2NaAlO2+CO2+3H2O=Na2CO3+2Al(0H)3 ↓
沉淀完全后,继续通入CO2沉淀不溶解,发生了如下反应:
CO2+H2O+Na2CO3=2NaHCO3
注意AlO2-与强酸反应的区别
写成离子方程式:
2AlO2-+CO2+3H2O=2Al(0H)3 ↓+CO32-
AlO2-+CO2+2H2O=Al(0H)3 ↓+HCO3-
故,由AlO2-制取Al(0H)3用弱酸更合适
少量CO2过量CO2Al3+ 和 AlO2-Al3+ +3AlO2-+6H2O=4Al(0H)3 ↓
新增离子共存问题
Al3+不能和AlO2-,OH-共存
AlO2-不能和Al3+,H+共存
活动与探究1.AlCl3溶液中滴加NaOH溶液直至过量
NaOH溶液中滴加AlCl3溶液直至过量
2NaAlO2溶液中滴加盐酸直至过量
盐酸中滴加NaAlO2溶液直至过量
练习2、向30mL1mol·L-1的AlCl3溶液中逐渐
加入浓度为4mol·l-1的NaOH溶液,若产
生0.78g白色沉淀,则加入的NaOH溶液
的体积可能为( )
A.3mL B.7.5mL
C.15mL D.27.5mL解析:利用图形一目了然地看到碱的量有两个值
0.03mol÷4mo1·L-1=7.5mL。
0.11mol÷4mo1·L-1=27.5mL。
答案:BD从铝土矿制备铝的工艺流程:铝土矿氢氧化钠溶液溶解、过滤残渣滤液二氧化碳酸化、过滤残渣滤液NaAlO2Al(OH)3Al2O3灼烧电解铝从铝土矿中提取铝
Al2O3+2NaOH = 2NaAlO2+H2O
AlO2-+CO2+2H2O=Al(0H)3 ↓+HCO3-
2Al(0H)3=== Al2O3+ 3H2O
2Al2O3 ===4Al+3O2↑
加热通电补充:金属与强酸反应(计算)哪些金属能和强酸反应产生氢气?
KCa Na Mg Al Zn Fe Sn Pb (H)
问:如何比较各金属与强酸反应产生氢气的速率?
答:在金属活动顺序表中,相对靠前的金属产生氢气速率快于相对靠后的.
问:那么金属与强酸反应产生氢气的量又和什么有关呢?
金属与强酸反应产生氢气的量与强酸的物质的量有关
例.钠镁铝各4g分别与100ml2mol/L硫酸反应,下列说法正确的是( )
A镁铝产生氢气一样多
B镁产生氢气最多
C铝产生氢气最多
D三者生成氢气一样多金属与强酸反应产生氢气的量与金属的种类和物质的量有关
等物质的量的下列金属与足量强酸反应,产生氢气比较。
钠 镁 铝 铁 铜 锌
等质量的下列金属与足量强酸反应,产生氢气比较
钠 镁 铝 铁 铜 锌
平均分子量法的使用例,由锌铁铝镁等四种金属中的两种组成的混合物10g与足量的盐酸反应产生的氢气在标况下为11.2L,则混合物中一定含有哪种金属( )
A 锌 B 铁 C 铝 D 镁提示:注意钠的特殊性例 将钠镁铝各0.3mol分别放入100ml
1mol/L的盐酸中,同温同压下产生氢气体积比( )提示:质量守恒定律的使用能力提升12题
问:在同样条件下,将Mg,Al,Fe分别投入质量相等的稀盐酸中(足量),反应完毕后,三溶液的质量仍相等,比较投入金属的质量.
1.了解地壳中铝元素的含量,知道铝元素在自然界中的主要存在形式,了解工业上从铝土矿获得铝的方法,从金属铝冶炼方法的变化体验化学科学的发展对人类生活的影响。
2.知道铝、氧化铝和氢氧化铝的性质,了解铝及其化合物在生产生活中的重要应用,进一步认识化学与生产生活的关系。
3.了解两性氧化物和两性氢氧化物的概念,知道氧化铝和氢氧化铝分别是两性氧化物和两性氢氧化物。
。
铝的物理性质铝是一种较软的银白色金属固体.
密度是2.70g/cm3(铁的密度7.86g/cm3)
熔点660.4oC,沸点2467 oC
具有较强的韧性,延展性,良好的导电
性,导热性.
地壳中各元素含量前5位:氧,硅,铝,铁,钙.铝的原子结构结论:铝有很强的还原性。Al3+Al 铝的化学性质铝和非金属单质的反应
注:常温下铝和空气中的氧气反应生成致密的氧化物保护膜,故空气中铝有较好的抗腐蚀性
铝和水的反应铝和冷水不反应,与热水缓慢反应
2Al+6H2O===2Al(OH)3+3H2↑
回顾钠,镁和水的反应,得出什么结论?
反应的条件和反应速率,在判断物质性质中的作用加热与酸反应①在冷的浓硫酸、浓硝酸中钝化。③与稀硫酸,盐酸反应产生氢气。铝和碱的反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
NaAlO2读作偏铝酸钠,HAlO2即为偏铝酸
小结:铝是一种既能和酸反应又能和碱反应的物质铝热反应及其用途定义:铝粉还原金属氧化物的反应
铝热剂:铝粉和被还原的金属氧化物的混合物
特点:反应放出大量的热
用途:冶炼金属,野外焊接
下列为铝或铝合金的各种用途,在后面的横线上写出所根据的性质。
(1)制造飞机或汽车外壳
(2)作为储存浓硫酸的容器
(3)制造各种日用炊具
(4)铝热法冶炼金属
(5)制造电线电缆
(6)制造包装用的铝箔 氧化铝的物理性质熔点2054 oC,沸点2980 oC,高硬度
不溶与水的白色固体
重点:高熔点,高硬度
下图为氧化铝的应用
耐火
砖刚玉耐磨球红宝石两性氧化物:既可以与酸反应也可以与碱
反应生成盐与水的氧化物.Al2O3+2NaOH =2NaAlO2+H2OAl2O3+3H2SO4 = Al2(SO4)3+3H2O偏铝酸钠:NaAlO2 偏铝酸:HAlO2
工业制取铝的最后一步反应(注意:氧化铝中添加冰晶石的目的)
2Al2O3(熔融) ===4Al+3O2↑通电氢氧化铝的化学性质Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O两性氢氧化物:既能跟酸反应又能跟碱反应的氢氧化物.反应原理:(Al(OH)3的双向电离)碱式电离:Al(OH)3 Al3++3OH-酸式电离:Al(OH)3 H2O+AlO2-+H+注:在酸式电离中Al(OH)3可写成H3AlO3(铝酸)氢氧化铝的分解
2Al(0H)3=== Al2O3+ 3H2O
举一反三:氢氧化铁,氢氧化铜等不溶性氢氧化物有类似的性质
加热Al3+和强碱反应 AlCl3+3NaOH=Al(0H)3↓+3NaCl沉淀完全后,继续加入 NaOHAl(0H)3+NaOH=NaAlO2+2H2O将上面两个反应相加得:AlCl3+4NaOH=NaAlO2+ 3NaCl+2H2O写成离子方程式:Al3++3OH- =Al(0H)3 ↓(碱少量)Al3++4OH- =AlO2-+2H2O(碱过量)沉淀被溶解Al3+和弱碱反应AlCl3+3NH3.H2O=Al(0H)3↓+3NH4Cl
沉淀完全后,继续滴加氨水:沉淀不溶解
注意Al3+和强碱反应的区别
写成离子方程式
Al3++3NH3.H2O=Al(0H)3 ↓+3NH4+
故,用Al3+制取Al(0H)3用弱碱更合适3NH4OH AlO2-与强酸的反应NaAlO2+HCl+H2O=Al(0H)3 ↓ +NaCl
沉淀完全后,继续加入盐酸,
Al(OH)3+3HCl=AlCl3+3H2O
将上面两化学反应加和得
NaAlO2+4HCl=AlCl3+2H2O +NaCl
写成离子方程式
AlO2-+H++H2O=Al(0H)3 ↓(酸少量)
AlO2-+4H+= Al3++2H2O(酸过量)H3AlO3 ↓沉淀被溶解AlO2-与弱酸的反应2NaAlO2+CO2+3H2O=Na2CO3+2Al(0H)3 ↓
沉淀完全后,继续通入CO2沉淀不溶解,发生了如下反应:
CO2+H2O+Na2CO3=2NaHCO3
注意AlO2-与强酸反应的区别
写成离子方程式:
2AlO2-+CO2+3H2O=2Al(0H)3 ↓+CO32-
AlO2-+CO2+2H2O=Al(0H)3 ↓+HCO3-
故,由AlO2-制取Al(0H)3用弱酸更合适
少量CO2过量CO2Al3+ 和 AlO2-Al3+ +3AlO2-+6H2O=4Al(0H)3 ↓
新增离子共存问题
Al3+不能和AlO2-,OH-共存
AlO2-不能和Al3+,H+共存
活动与探究1.AlCl3溶液中滴加NaOH溶液直至过量
NaOH溶液中滴加AlCl3溶液直至过量
2NaAlO2溶液中滴加盐酸直至过量
盐酸中滴加NaAlO2溶液直至过量
练习2、向30mL1mol·L-1的AlCl3溶液中逐渐
加入浓度为4mol·l-1的NaOH溶液,若产
生0.78g白色沉淀,则加入的NaOH溶液
的体积可能为( )
A.3mL B.7.5mL
C.15mL D.27.5mL解析:利用图形一目了然地看到碱的量有两个值
0.03mol÷4mo1·L-1=7.5mL。
0.11mol÷4mo1·L-1=27.5mL。
答案:BD从铝土矿制备铝的工艺流程:铝土矿氢氧化钠溶液溶解、过滤残渣滤液二氧化碳酸化、过滤残渣滤液NaAlO2Al(OH)3Al2O3灼烧电解铝从铝土矿中提取铝
Al2O3+2NaOH = 2NaAlO2+H2O
AlO2-+CO2+2H2O=Al(0H)3 ↓+HCO3-
2Al(0H)3=== Al2O3+ 3H2O
2Al2O3 ===4Al+3O2↑
加热通电补充:金属与强酸反应(计算)哪些金属能和强酸反应产生氢气?
KCa Na Mg Al Zn Fe Sn Pb (H)
问:如何比较各金属与强酸反应产生氢气的速率?
答:在金属活动顺序表中,相对靠前的金属产生氢气速率快于相对靠后的.
问:那么金属与强酸反应产生氢气的量又和什么有关呢?
金属与强酸反应产生氢气的量与强酸的物质的量有关
例.钠镁铝各4g分别与100ml2mol/L硫酸反应,下列说法正确的是( )
A镁铝产生氢气一样多
B镁产生氢气最多
C铝产生氢气最多
D三者生成氢气一样多金属与强酸反应产生氢气的量与金属的种类和物质的量有关
等物质的量的下列金属与足量强酸反应,产生氢气比较。
钠 镁 铝 铁 铜 锌
等质量的下列金属与足量强酸反应,产生氢气比较
钠 镁 铝 铁 铜 锌
平均分子量法的使用例,由锌铁铝镁等四种金属中的两种组成的混合物10g与足量的盐酸反应产生的氢气在标况下为11.2L,则混合物中一定含有哪种金属( )
A 锌 B 铁 C 铝 D 镁提示:注意钠的特殊性例 将钠镁铝各0.3mol分别放入100ml
1mol/L的盐酸中,同温同压下产生氢气体积比( )提示:质量守恒定律的使用能力提升12题
问:在同样条件下,将Mg,Al,Fe分别投入质量相等的稀盐酸中(足量),反应完毕后,三溶液的质量仍相等,比较投入金属的质量.
