专题三第一单元铝的性质(浙江省舟山市)
文档属性
| 名称 | 专题三第一单元铝的性质(浙江省舟山市) |  | |
| 格式 | rar | ||
| 文件大小 | 536.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-10-11 07:25:00 | ||
图片预览








文档简介
课件29张PPT。专题三:从矿物到基础材料第一单元 从铝土矿到铝合金
从铝土矿提取铝一、学习目标
1.了解地壳中铝元素的含量,知道铝元素在自然界中的主要存在形式,了解工业上从铝土矿获得铝的方法,从金属铝冶炼方法的变化体验化学科学的发展对人类生活的影响。
2.知道铝、氧化铝和氢氧化铝的性质,了解铝及其化合物在生产生活中的重要应用,进一步认识化学与生产生活的关系。
3.了解两性氧化物和两性氢氧化物的概念,知道氧化铝和氢氧化铝分别是两性氧化物和两性氢氧化物。
4.通过相关探究活动进一步了解探究学习的一般过程和方法。
5.尝试采用联想、类比等方法学习新知识,学习构建知识结构的常用方法。拿破仑的餐叉和钮扣 现在,谁家都有铝锅、铝盆、铝勺之类的日用器具。可是,在100多年前,凡和铝沾边的东西,就是一种极贵重的宝贝。1848年以后,拿破仑三世登上了法国皇帝的宝座。一天,他举办了一个盛大的宴会,邀请了王室成员和贵族赴宴,另外还有一些地位较低的来宾。客人入席后,发现用餐的餐具各不相同,在高贵的王室成员和皇宫贵族的餐桌上摆的都是铝匙和铝叉,而在地位较低的来宾面前,摆的却是普通的金制和银制的餐具。那一天,宴会虽很丰盛,但是使用金制和银制餐具的人心里就堵得慌,因为他们发觉自己是在低人一等的餐桌上用餐。其实,这也不是拿破仑三世的本意,在当时,即使是皇上也无法给每个来宾提供当时是既贵重而又稀少的铝餐具。
一直到19世纪80年代,铝仍然是一种有珠宝价值的珍贵金属。1889年,俄国著名的化学家门捷列夫到英国伦敦访问和讲学,英国科学家为表彰他在化学上的杰出贡献,尤其是在发现元素周期律和建立元素周期表上的贡献,赠给他一件贵重的奖品,就是用铝和金制成的一架天平。
100多年后,铝进入了最平常的百姓家中。这要归功于那些一直在研究如何大批生产铝的科学家。19世纪末,奥地利化学家拜尔在前人实验的基础上研究出了一种生产铝的方法——电解氧化铝。不久后,铝的产量剧增,铝的价格也大降。铝是地壳中含量最多的金属元素。 由于铝是活泼的金属,因此铝元素在自然界
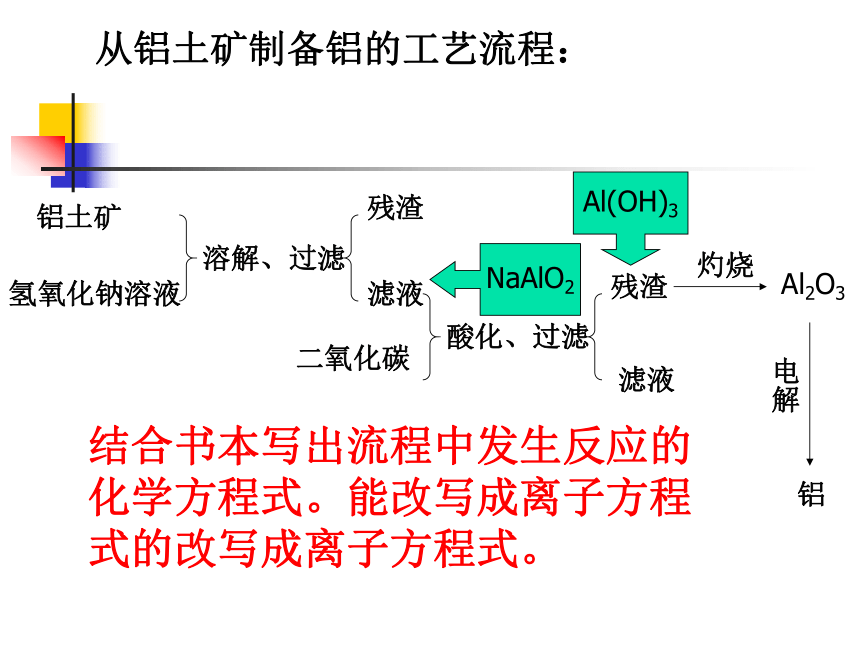
中均以化合态的形式存在。 铝土矿的主要成分:Al2O3、Fe2O3、SiO2等。从铝土矿制备铝的工艺流程:铝土矿氢氧化钠溶液溶解、过滤残渣滤液二氧化碳酸化、过滤残渣滤液NaAlO2Al(OH)3Al2O3灼烧电解铝结合书本写出流程中发生反应的化学方程式。能改写成离子方程式的改写成离子方程式。流程中的一些主要反应方程式:氧化铝的熔点很高,加入冰晶石后就能降低熔点,
从而节能。两性氧化物:既可以与酸反应也可以与碱
反应生成盐与水的氧化物.Al2O3+2NaOH = 2NaAlO2+H2O
Al2O3+3H2SO4 = Al2SO4+3H2O
偏铝酸钠:NaAlO2耐火
砖刚玉耐磨球红宝石氧化铝:高硬度、高熔点、高沸点,不溶于水
的白色固体。
常用作耐火材料。你知道吗? 刚玉的主要成分是α –氧化铝,硬度仅次于
金刚石。红宝石、蓝宝石的主要成分也是刚玉。
红宝石:混有少量含铬的化合物;
蓝宝石:混有少量含钛的化合物。
人造宝石不但是漂亮的装饰品,还常用来制造钟表的轴承、光学仪器等等。活动与探究在氯化铝溶液中滴加氨水,然后把产生的沉淀分成三份。在两份中分别加入盐酸和氢氧化钠溶液。
观察并记录实验现象,写出反应方程式并改写成离子方程式。
沉淀溶解沉淀溶解沉淀不溶解两性氢氧化物:既可以与强酸反应也可以与
强碱反应生成盐与水的氢氧化物.活动与探究在氯化铝溶液中滴加氢氧化钠溶液与氢氧化钠溶液中滴加氯化铝溶液比较。在偏铝酸钠溶液中滴加盐酸与在盐酸中滴加偏铝酸钠溶液比较。(注意实验过程中要边滴边振荡)
观察并记录实验现象,写出反应方程式并改写成离子方程式。
1、在MgO中混有少量的Al2O3杂质,欲将杂质除
去可选用的试剂是( )
A.稀硫酸 B.浓氨水
C.稀盐酸 D.氢氧化钠溶液
练习答案:D
练习2、向30mL1mol·L-1的AlCl3溶液中逐渐
加入浓度为4mol·l-1的NaOH溶液,若产
生0.78g白色沉淀,则加入的NaOH溶液
的体积可能为( )
A.3mL B.7.5mL
C.15mL D.27.5mL解析:利用图形一目了然地看到碱的量有两个值
0.03mol÷4mo1·L-1=7.5mL。
0.11mol÷4mo1·L-1=27.5mL。
答案:BD物性铝是银白色有金属光泽的金属,熔点较低(660.4℃),是热和电的良导体。密度较小(2.7g·cm-3),铝的原子结构结论:铝有很强的还原性。Al3+Al 回顾与尝试以你熟知的反应为例说明金属铝有较强的还原性。活动与探究将用砂纸打磨过的铝条分别放入四支洁净的试管中,在向试管中分别加入浓硫酸、浓硝酸、盐酸、氢氧化钠溶液。
观察并记录实验现象,写出结论或方程式。观察与思考:铝热反应。观察并记录实验现象,写出化学反应方程式。试总结金属铝的化学性质。化性(1)与非金属反应:(2)与酸反应①在冷的浓硫酸、浓硝酸中钝化。②在热的浓硫酸、浓硝酸,稀硝酸
中反应,但不产生氢气。③与稀硫酸,盐酸反应产生氢气。(4)与碱反应(3)与氧化物反应用途铝合金:主要用于建筑业、交通运输业
以及电子行业。铝导热能力强,可用于各种家用器皿。铝导电能力强,可用于导线。铝延展性好,可制成铝箔。铝热反应放出大量热,可置换铁。下列为铝或铝合金的各种用途,在后面的横线上写出所根据的性质。
(1)制造飞机或汽车外壳
(2)作为储存浓硫酸的容器
(3)制造各种日用炊具
(4)铝热法冶炼金属
(5)制造电线电缆
(6)制造包装用的铝箔 1、向一个铝制的易拉罐中充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,不多会儿听到罐内“卡卡”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓起来,试回答:
(1)易拉罐变瘪的原因是 ,反应的离子方程式是 。
(2)易拉罐又鼓起来的原因是 ,反应的离子方程式是 。2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而 加以控制。铝及其化合物在下列场合的使用须加以控制的是 ( )
①制铝锭
②制易拉罐
③制电线、电缆
④制包糖果用的铝箔
⑤用明矾净水
⑥制炊具
⑦用明矾和苏打作食物膨化剂
⑧用氢氧化铝制胃药 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
从铝土矿提取铝一、学习目标
1.了解地壳中铝元素的含量,知道铝元素在自然界中的主要存在形式,了解工业上从铝土矿获得铝的方法,从金属铝冶炼方法的变化体验化学科学的发展对人类生活的影响。
2.知道铝、氧化铝和氢氧化铝的性质,了解铝及其化合物在生产生活中的重要应用,进一步认识化学与生产生活的关系。
3.了解两性氧化物和两性氢氧化物的概念,知道氧化铝和氢氧化铝分别是两性氧化物和两性氢氧化物。
4.通过相关探究活动进一步了解探究学习的一般过程和方法。
5.尝试采用联想、类比等方法学习新知识,学习构建知识结构的常用方法。拿破仑的餐叉和钮扣 现在,谁家都有铝锅、铝盆、铝勺之类的日用器具。可是,在100多年前,凡和铝沾边的东西,就是一种极贵重的宝贝。1848年以后,拿破仑三世登上了法国皇帝的宝座。一天,他举办了一个盛大的宴会,邀请了王室成员和贵族赴宴,另外还有一些地位较低的来宾。客人入席后,发现用餐的餐具各不相同,在高贵的王室成员和皇宫贵族的餐桌上摆的都是铝匙和铝叉,而在地位较低的来宾面前,摆的却是普通的金制和银制的餐具。那一天,宴会虽很丰盛,但是使用金制和银制餐具的人心里就堵得慌,因为他们发觉自己是在低人一等的餐桌上用餐。其实,这也不是拿破仑三世的本意,在当时,即使是皇上也无法给每个来宾提供当时是既贵重而又稀少的铝餐具。
一直到19世纪80年代,铝仍然是一种有珠宝价值的珍贵金属。1889年,俄国著名的化学家门捷列夫到英国伦敦访问和讲学,英国科学家为表彰他在化学上的杰出贡献,尤其是在发现元素周期律和建立元素周期表上的贡献,赠给他一件贵重的奖品,就是用铝和金制成的一架天平。
100多年后,铝进入了最平常的百姓家中。这要归功于那些一直在研究如何大批生产铝的科学家。19世纪末,奥地利化学家拜尔在前人实验的基础上研究出了一种生产铝的方法——电解氧化铝。不久后,铝的产量剧增,铝的价格也大降。铝是地壳中含量最多的金属元素。 由于铝是活泼的金属,因此铝元素在自然界
中均以化合态的形式存在。 铝土矿的主要成分:Al2O3、Fe2O3、SiO2等。从铝土矿制备铝的工艺流程:铝土矿氢氧化钠溶液溶解、过滤残渣滤液二氧化碳酸化、过滤残渣滤液NaAlO2Al(OH)3Al2O3灼烧电解铝结合书本写出流程中发生反应的化学方程式。能改写成离子方程式的改写成离子方程式。流程中的一些主要反应方程式:氧化铝的熔点很高,加入冰晶石后就能降低熔点,
从而节能。两性氧化物:既可以与酸反应也可以与碱
反应生成盐与水的氧化物.Al2O3+2NaOH = 2NaAlO2+H2O
Al2O3+3H2SO4 = Al2SO4+3H2O
偏铝酸钠:NaAlO2耐火
砖刚玉耐磨球红宝石氧化铝:高硬度、高熔点、高沸点,不溶于水
的白色固体。
常用作耐火材料。你知道吗? 刚玉的主要成分是α –氧化铝,硬度仅次于
金刚石。红宝石、蓝宝石的主要成分也是刚玉。
红宝石:混有少量含铬的化合物;
蓝宝石:混有少量含钛的化合物。
人造宝石不但是漂亮的装饰品,还常用来制造钟表的轴承、光学仪器等等。活动与探究在氯化铝溶液中滴加氨水,然后把产生的沉淀分成三份。在两份中分别加入盐酸和氢氧化钠溶液。
观察并记录实验现象,写出反应方程式并改写成离子方程式。
沉淀溶解沉淀溶解沉淀不溶解两性氢氧化物:既可以与强酸反应也可以与
强碱反应生成盐与水的氢氧化物.活动与探究在氯化铝溶液中滴加氢氧化钠溶液与氢氧化钠溶液中滴加氯化铝溶液比较。在偏铝酸钠溶液中滴加盐酸与在盐酸中滴加偏铝酸钠溶液比较。(注意实验过程中要边滴边振荡)
观察并记录实验现象,写出反应方程式并改写成离子方程式。
1、在MgO中混有少量的Al2O3杂质,欲将杂质除
去可选用的试剂是( )
A.稀硫酸 B.浓氨水
C.稀盐酸 D.氢氧化钠溶液
练习答案:D
练习2、向30mL1mol·L-1的AlCl3溶液中逐渐
加入浓度为4mol·l-1的NaOH溶液,若产
生0.78g白色沉淀,则加入的NaOH溶液
的体积可能为( )
A.3mL B.7.5mL
C.15mL D.27.5mL解析:利用图形一目了然地看到碱的量有两个值
0.03mol÷4mo1·L-1=7.5mL。
0.11mol÷4mo1·L-1=27.5mL。
答案:BD物性铝是银白色有金属光泽的金属,熔点较低(660.4℃),是热和电的良导体。密度较小(2.7g·cm-3),铝的原子结构结论:铝有很强的还原性。Al3+Al 回顾与尝试以你熟知的反应为例说明金属铝有较强的还原性。活动与探究将用砂纸打磨过的铝条分别放入四支洁净的试管中,在向试管中分别加入浓硫酸、浓硝酸、盐酸、氢氧化钠溶液。
观察并记录实验现象,写出结论或方程式。观察与思考:铝热反应。观察并记录实验现象,写出化学反应方程式。试总结金属铝的化学性质。化性(1)与非金属反应:(2)与酸反应①在冷的浓硫酸、浓硝酸中钝化。②在热的浓硫酸、浓硝酸,稀硝酸
中反应,但不产生氢气。③与稀硫酸,盐酸反应产生氢气。(4)与碱反应(3)与氧化物反应用途铝合金:主要用于建筑业、交通运输业
以及电子行业。铝导热能力强,可用于各种家用器皿。铝导电能力强,可用于导线。铝延展性好,可制成铝箔。铝热反应放出大量热,可置换铁。下列为铝或铝合金的各种用途,在后面的横线上写出所根据的性质。
(1)制造飞机或汽车外壳
(2)作为储存浓硫酸的容器
(3)制造各种日用炊具
(4)铝热法冶炼金属
(5)制造电线电缆
(6)制造包装用的铝箔 1、向一个铝制的易拉罐中充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,不多会儿听到罐内“卡卡”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓起来,试回答:
(1)易拉罐变瘪的原因是 ,反应的离子方程式是 。
(2)易拉罐又鼓起来的原因是 ,反应的离子方程式是 。2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而 加以控制。铝及其化合物在下列场合的使用须加以控制的是 ( )
①制铝锭
②制易拉罐
③制电线、电缆
④制包糖果用的铝箔
⑤用明矾净水
⑥制炊具
⑦用明矾和苏打作食物膨化剂
⑧用氢氧化铝制胃药 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
