专题1第二单元溶液的配制及分析(包括三课时)
文档属性
| 名称 | 专题1第二单元溶液的配制及分析(包括三课时) |  | |
| 格式 | rar | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-10-18 19:08:00 | ||
图片预览







文档简介
课件50张PPT。溶液的配制和分析 什么是溶液中溶质的质量分数?
优点:1.配制容易。2.知道溶液的质量就可以算出溶质的质量。缺点:1.称量液体的质量不如量体积方便。 2.发生反应的各物质间的质量关系要比它们
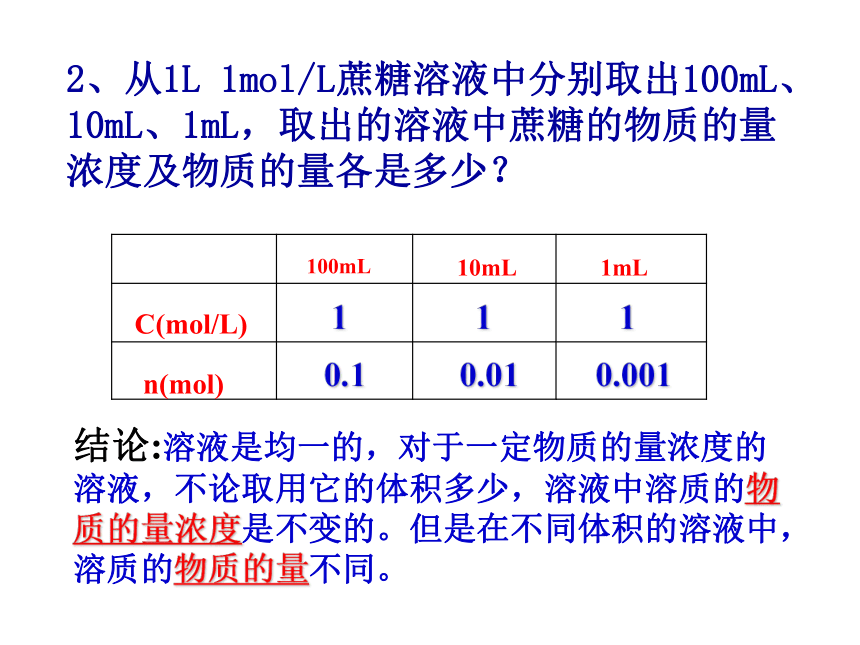
的物质的量关系要复杂得多。质量分数(ω):溶质B的质量和溶液的质量之比复习:溶液浓度一、物质的量浓度1、 定义:以单位体积溶液中所含有的溶质的物质的量来表示溶液的组成。2、 单位:mol/L (或mol/m3)3、公式:讨 论 …1、将342g蔗糖(C12H22O11)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L?结论:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。 物质的量浓度(c)是一种表示溶液组成的物理量,它反映了单位体积的溶液中所含溶质的物质的量的多少,也就是溶质的物质的量除以溶液的体积,即c=n/V,单位为mol/L;
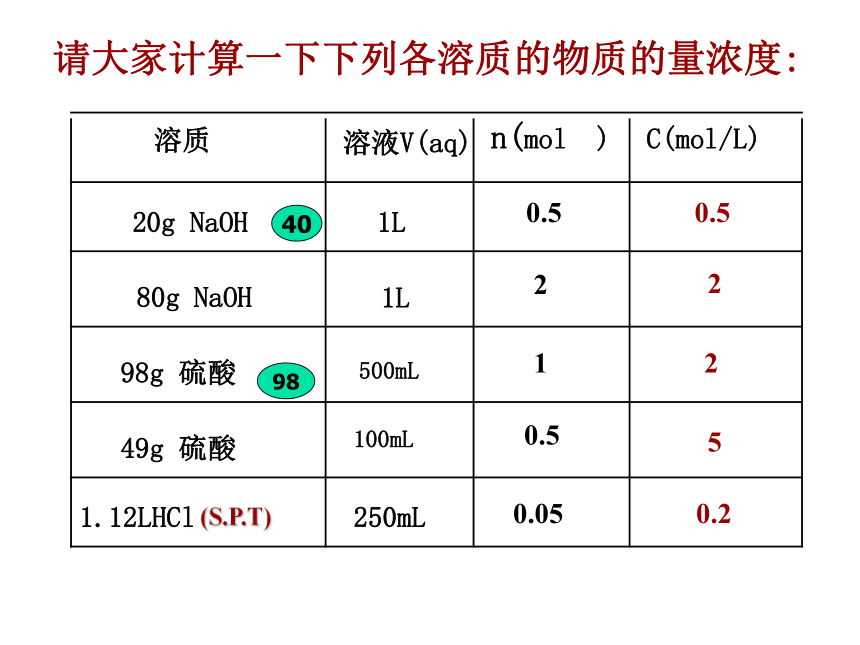
由于溶液是均一稳定的,无论将溶液分成几份,其物质的量浓度都保持不变。注意:500mL请大家计算一下下列各溶质的物质的量浓度:0.52250.20.5210.50.054098
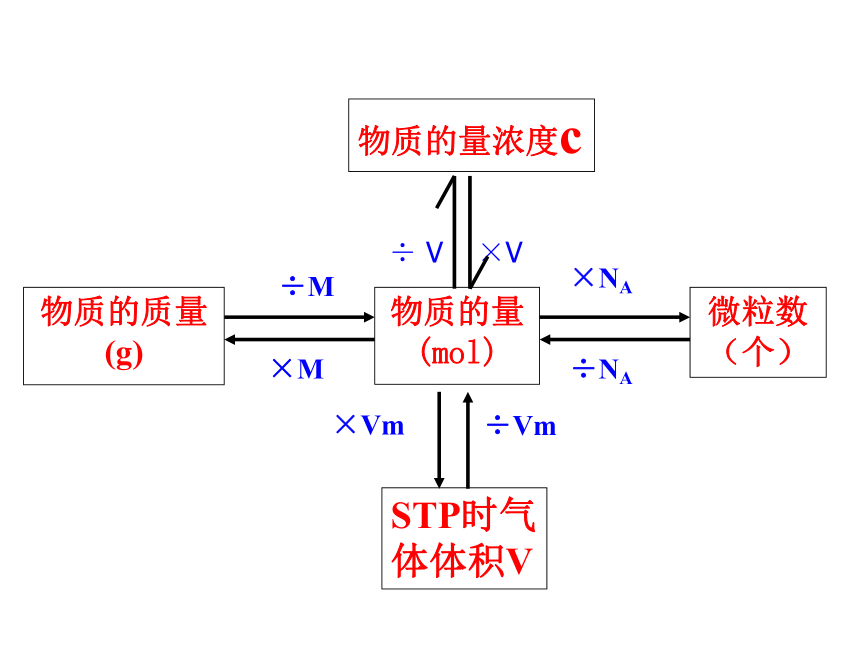
÷ V ×V
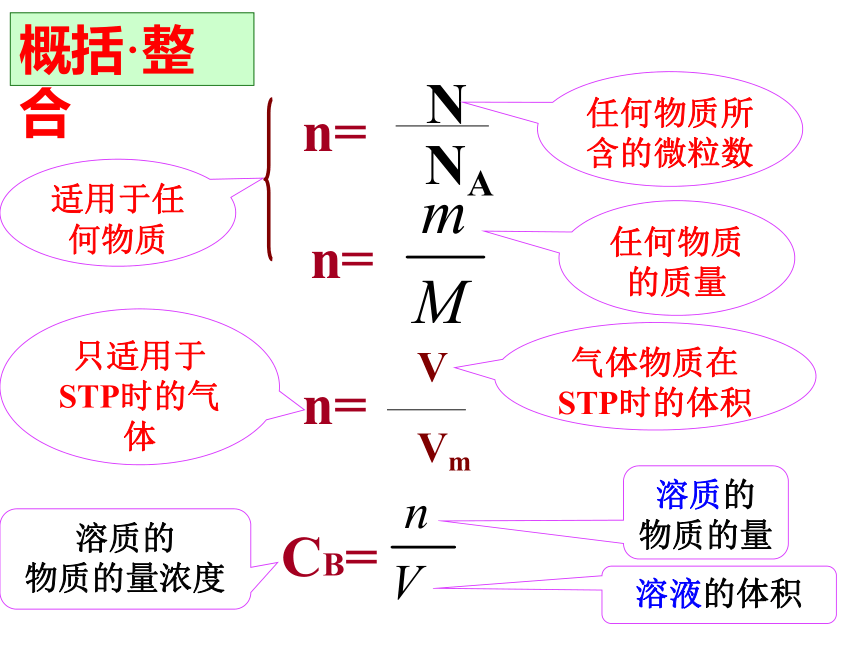
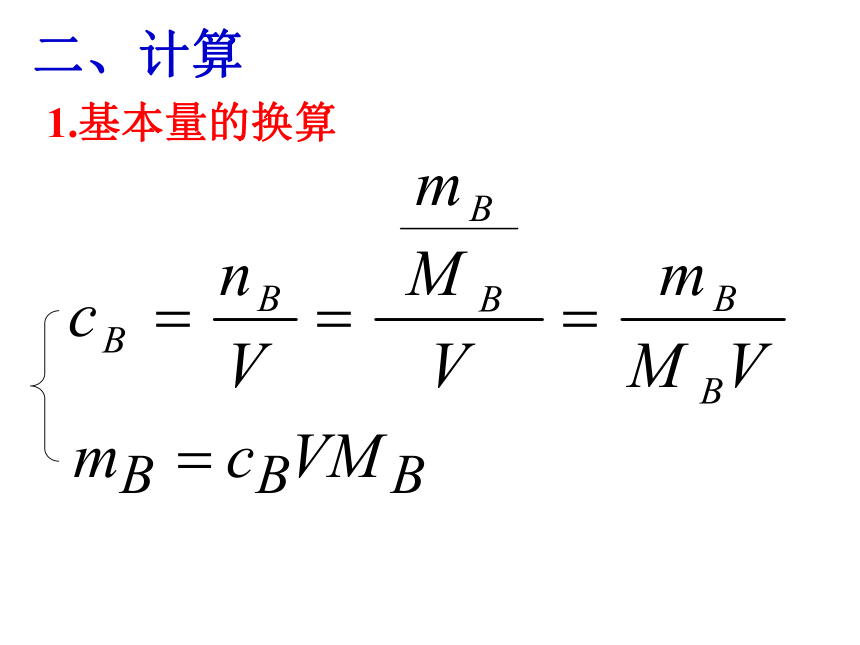
物质的量浓度cn=任何物质所含的微粒数任何物质的质量气体物质在STP时的体积只适用于STP时的气体概括·整合CB=溶质的
物质的量浓度溶液的体积溶质的
物质的量二、计算1.基本量的换算例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V
= 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)书P23例题4例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
书P23问题解决2.在物质的量浓度溶液中溶质微粒数目的计算
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同,所含溶质的分子数也必然相同,但不能说所含微粒数也相同。 1)、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10242)、0.5 mol /L的下列溶液500mL中含NO3-数目最多的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝
D3.溶液中溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)换算方法:1、分别根据物质的量浓度和质量分数
的公式进行求算2、换算时注意体积单位:1L=1000mL设一法设V=1L=1000mL例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:设有1L浓硝酸,例:2mol/LNaOH溶液(ρ=1.08g/cm3)的溶质的质量分数为多少?解:设有1L NaOH溶液,答:该溶液溶质的质量分数为7.4%4.有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 习题思路:稀溶液前后溶质的物质的量相等
有关溶液稀释和浓缩的计算1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L, 其体积为多少毫升?
解:10mL×2mol/L=V(H2SO4) ×0.5mol/L5.有关两种不同浓度溶液混合的计算
C总V总 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)
6.有关溶液反应的计算
见课本P25例题5思 考配制100g7%的Na2CO3溶液,操作步骤有哪些?需要哪些实验仪器?步骤①计算 ②称量 ③溶解仪器托盘天平 、药匙 、 烧杯 量筒 、胶头滴管、 玻棒三、一定物质的量浓度溶液的配制 如果要你配制 100mL 0.100mol/L的Na2CO3溶液,你能从题目中得出哪些信息?溶质的物质的量为0.01mol溶液的体积为100mL你打算如何来配制呢配制500mL0.1mol/LNa2CO3溶液。一、实验仪器: 烧杯、玻璃棒、胶头滴管、托盘天平、药匙、量筒、纸片、试剂瓶 500mL容量瓶、容量瓶构造:细颈、梨形、平底的玻璃瓶,
配有磨口玻璃塞或塑料塞
3.使用:当溶液的凹液面与刻度线相切时,容量瓶
中溶液的体积即为容量瓶上所标识的体积。2.特点:①容量瓶上标有温度和容积
②容量瓶瓶颈上有一道刻度线 4. 使用范围:
用来配制一定体积、浓度准确的溶液5. 注意事项:
①使用前要检查是否漏水②溶解或稀释的操作不能在容量瓶中进行③不能长期存放溶液或进行化学反应不同容积的容量瓶二、实验步骤计算需要称量的碳酸钠的质量:五字方针:计称溶转定2. 称量注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零思考:NaOH能否直接放在称量纸上称量?为什么?
应如何操作?3. 溶解注意事项:
应在烧杯中溶解,不能在容量瓶中溶解。因为在容量瓶上标有
温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解
往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因
热胀冷缩使它的体积不准确,严重时还可能导致容量瓶炸裂。提问:除了烧杯外还需要哪些仪器?使用中应注意什么?还需要玻璃棒。搅拌时沿着一定的方向,玻璃
棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在
实验台上,以免弄脏。思考:
若量取的是浓硫酸需要稀释,应如何操
作才是正确的?4. 转移 注意事项:
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。提问:
将烧杯中的碳酸钠溶液转移到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?还有残留在烧杯壁和玻璃棒上的碳酸钠未被转移。因此要用蒸馏水洗涤用过的烧杯和玻璃棒。5. 洗涤注意事项:
用少量蒸馏水洗涤2~3次,洗涤液要全部转移到容量瓶中。思考:如果用量筒量取液体药品,量筒要洗涤吗?如果用量筒量取液体药品,量筒不必洗涤。因为这是量筒的“自然残留液”,若洗涤后转移到容量瓶中会导致所配溶液浓度偏高。但是使用量筒时应注意选择的量筒与量取液体的体积相匹配。6.定容向容量瓶中加入蒸馏水,在距离刻度2~3cm时,改用胶头滴管滴加蒸馏水至刻度线。思考:
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?必须重新配制7. 摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。思考:
摇匀后发现液面低于刻线,能否补充水?不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。8. 装瓶贴签容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。配制一定物质的量浓度溶液5.3gNa2CO3 讨论 在配制溶液中哪些操作可能引起溶液浓度的误差? 可能影响溶液浓度的操作1、固体药品的称量与液体药品的量取是否准确;
2、把溶液向容量瓶中转移,溶液洒了;
3、未洗涤烧杯和玻璃棒或洗涤了量筒;
4、定容时水加多了或加少了;
5、定容时未平视刻度线。 讨论 定容时俯视或仰视刻度线,对溶液的浓度有何影响? 俯视 仰视俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 小结:容量瓶的使用六忌 一、忌用容量瓶进行溶解(体积不准确)
二、忌直接往容量瓶倒液(洒到外面)
三、忌加水超过刻度线(浓度偏低)
四、忌读数仰视或俯视(仰视浓度偏低,
俯视浓度偏高)
五、忌不洗涤玻璃棒和烧杯(浓度偏低)
六、忌标准液存放于容量瓶(容量瓶是量
器,不是容器) 配制一定物质的量浓度溶液随堂检测 1、欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250 配制一定物质的量浓度溶液③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3偏低2~3厘米胶头滴管偏低重新配制摇匀 2. 在配制一定物质的量浓度溶液的实验中,下列操作对
所配得溶液无影响的是(写序号) ;会使所配溶
液的浓度偏大的是 ;会使所配溶液的浓度偏小的
是 。
(1)在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
(2)未将洗涤烧杯内壁的溶液转移入容量瓶;
(3)容量瓶中所配的溶液液面未到刻度线便停止加水;
(4)将配得的溶液从容量瓶转移到干燥、洁净的试剂
瓶中时,有少量溅出;
(5)将烧杯中溶液转移到容量瓶之前,容量瓶中有少量
蒸馏水;
(6)将容量瓶中液面将达到刻度线时,俯视刻度线和液面。答:(4)(5); (3)(6); (1)(2)3、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变作业
中和120ml1mol/LH2SO4溶液共用去了NaOH溶液80ml,求此NaOH溶液的物质的量浓度和溶质的质量分数.(NaOH溶液的密度为1.05g/ml)
优点:1.配制容易。2.知道溶液的质量就可以算出溶质的质量。缺点:1.称量液体的质量不如量体积方便。 2.发生反应的各物质间的质量关系要比它们
的物质的量关系要复杂得多。质量分数(ω):溶质B的质量和溶液的质量之比复习:溶液浓度一、物质的量浓度1、 定义:以单位体积溶液中所含有的溶质的物质的量来表示溶液的组成。2、 单位:mol/L (或mol/m3)3、公式:讨 论 …1、将342g蔗糖(C12H22O11)溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol/L?结论:溶液体积不等于溶剂体积。溶质溶于溶剂后,体积会发生变化。(否)2、从1L 1mol/L蔗糖溶液中分别取出100mL、10mL、1mL,取出的溶液中蔗糖的物质的量浓度及物质的量各是多少?1110.10.010.001结论:溶液是均一的,对于一定物质的量浓度的溶液,不论取用它的体积多少,溶液中溶质的物质的量浓度是不变的。但是在不同体积的溶液中,溶质的物质的量不同。 物质的量浓度(c)是一种表示溶液组成的物理量,它反映了单位体积的溶液中所含溶质的物质的量的多少,也就是溶质的物质的量除以溶液的体积,即c=n/V,单位为mol/L;
由于溶液是均一稳定的,无论将溶液分成几份,其物质的量浓度都保持不变。注意:500mL请大家计算一下下列各溶质的物质的量浓度:0.52250.20.5210.50.054098
÷ V ×V
物质的量浓度cn=任何物质所含的微粒数任何物质的质量气体物质在STP时的体积只适用于STP时的气体概括·整合CB=溶质的
物质的量浓度溶液的体积溶质的
物质的量二、计算1.基本量的换算例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。
解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V
= 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。(106)书P23例题4例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
书P23问题解决2.在物质的量浓度溶液中溶质微粒数目的计算
只要溶液体积相同,物质的量浓度相同,所含溶质的物质的量必然相同,所含溶质的分子数也必然相同,但不能说所含微粒数也相同。 1)、2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。22.408×10241.204×10242)、0.5 mol /L的下列溶液500mL中含NO3-数目最多的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝
D3.溶液中溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)换算方法:1、分别根据物质的量浓度和质量分数
的公式进行求算2、换算时注意体积单位:1L=1000mL设一法设V=1L=1000mL例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:设有1L浓硝酸,例:2mol/LNaOH溶液(ρ=1.08g/cm3)的溶质的质量分数为多少?解:设有1L NaOH溶液,答:该溶液溶质的质量分数为7.4%4.有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 习题思路:稀溶液前后溶质的物质的量相等
有关溶液稀释和浓缩的计算1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L, 其体积为多少毫升?
解:10mL×2mol/L=V(H2SO4) ×0.5mol/L5.有关两种不同浓度溶液混合的计算
C总V总 = C1V1+C2V2
(混合前后溶质的物质的量总和不变)
6.有关溶液反应的计算
见课本P25例题5思 考配制100g7%的Na2CO3溶液,操作步骤有哪些?需要哪些实验仪器?步骤①计算 ②称量 ③溶解仪器托盘天平 、药匙 、 烧杯 量筒 、胶头滴管、 玻棒三、一定物质的量浓度溶液的配制 如果要你配制 100mL 0.100mol/L的Na2CO3溶液,你能从题目中得出哪些信息?溶质的物质的量为0.01mol溶液的体积为100mL你打算如何来配制呢配制500mL0.1mol/LNa2CO3溶液。一、实验仪器: 烧杯、玻璃棒、胶头滴管、托盘天平、药匙、量筒、纸片、试剂瓶 500mL容量瓶、容量瓶构造:细颈、梨形、平底的玻璃瓶,
配有磨口玻璃塞或塑料塞
3.使用:当溶液的凹液面与刻度线相切时,容量瓶
中溶液的体积即为容量瓶上所标识的体积。2.特点:①容量瓶上标有温度和容积
②容量瓶瓶颈上有一道刻度线 4. 使用范围:
用来配制一定体积、浓度准确的溶液5. 注意事项:
①使用前要检查是否漏水②溶解或稀释的操作不能在容量瓶中进行③不能长期存放溶液或进行化学反应不同容积的容量瓶二、实验步骤计算需要称量的碳酸钠的质量:五字方针:计称溶转定2. 称量注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零思考:NaOH能否直接放在称量纸上称量?为什么?
应如何操作?3. 溶解注意事项:
应在烧杯中溶解,不能在容量瓶中溶解。因为在容量瓶上标有
温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解
往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因
热胀冷缩使它的体积不准确,严重时还可能导致容量瓶炸裂。提问:除了烧杯外还需要哪些仪器?使用中应注意什么?还需要玻璃棒。搅拌时沿着一定的方向,玻璃
棒不要碰烧杯底和烧杯壁,不要把玻璃棒放在
实验台上,以免弄脏。思考:
若量取的是浓硫酸需要稀释,应如何操
作才是正确的?4. 转移 注意事项:
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。提问:
将烧杯中的碳酸钠溶液转移到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?还有残留在烧杯壁和玻璃棒上的碳酸钠未被转移。因此要用蒸馏水洗涤用过的烧杯和玻璃棒。5. 洗涤注意事项:
用少量蒸馏水洗涤2~3次,洗涤液要全部转移到容量瓶中。思考:如果用量筒量取液体药品,量筒要洗涤吗?如果用量筒量取液体药品,量筒不必洗涤。因为这是量筒的“自然残留液”,若洗涤后转移到容量瓶中会导致所配溶液浓度偏高。但是使用量筒时应注意选择的量筒与量取液体的体积相匹配。6.定容向容量瓶中加入蒸馏水,在距离刻度2~3cm时,改用胶头滴管滴加蒸馏水至刻度线。思考:
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?必须重新配制7. 摇匀将容量瓶盖好塞子,如图示,把容量瓶倒转和摇动多次,使得溶液混合均匀。思考:
摇匀后发现液面低于刻线,能否补充水?不能。因为是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。8. 装瓶贴签容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。配制一定物质的量浓度溶液5.3gNa2CO3 讨论 在配制溶液中哪些操作可能引起溶液浓度的误差? 可能影响溶液浓度的操作1、固体药品的称量与液体药品的量取是否准确;
2、把溶液向容量瓶中转移,溶液洒了;
3、未洗涤烧杯和玻璃棒或洗涤了量筒;
4、定容时水加多了或加少了;
5、定容时未平视刻度线。 讨论 定容时俯视或仰视刻度线,对溶液的浓度有何影响? 俯视 仰视俯
视仰
视 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 俯视或仰视刻度线对溶液浓度的影响 俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 小结:容量瓶的使用六忌 一、忌用容量瓶进行溶解(体积不准确)
二、忌直接往容量瓶倒液(洒到外面)
三、忌加水超过刻度线(浓度偏低)
四、忌读数仰视或俯视(仰视浓度偏低,
俯视浓度偏高)
五、忌不洗涤玻璃棒和烧杯(浓度偏低)
六、忌标准液存放于容量瓶(容量瓶是量
器,不是容器) 配制一定物质的量浓度溶液随堂检测 1、欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。10烧杯少量冷却玻璃棒250 配制一定物质的量浓度溶液③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。 2~3偏低2~3厘米胶头滴管偏低重新配制摇匀 2. 在配制一定物质的量浓度溶液的实验中,下列操作对
所配得溶液无影响的是(写序号) ;会使所配溶
液的浓度偏大的是 ;会使所配溶液的浓度偏小的
是 。
(1)在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
(2)未将洗涤烧杯内壁的溶液转移入容量瓶;
(3)容量瓶中所配的溶液液面未到刻度线便停止加水;
(4)将配得的溶液从容量瓶转移到干燥、洁净的试剂
瓶中时,有少量溅出;
(5)将烧杯中溶液转移到容量瓶之前,容量瓶中有少量
蒸馏水;
(6)将容量瓶中液面将达到刻度线时,俯视刻度线和液面。答:(4)(5); (3)(6); (1)(2)3、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变作业
中和120ml1mol/LH2SO4溶液共用去了NaOH溶液80ml,求此NaOH溶液的物质的量浓度和溶质的质量分数.(NaOH溶液的密度为1.05g/ml)
