物质的量计算
图片预览






文档简介
课件19张PPT。关于物质的量浓度的计算山亭实验中学 张琼国
(一)有关溶液反应的计算 可用来表示反应各微粒间数目关系
2NaOH + H2SO4=Na2SO4+2H2O
表示参加反应NaOH .H2SO4.Na2SO4.H2O四者之间微粒个数比为2:1:1:2
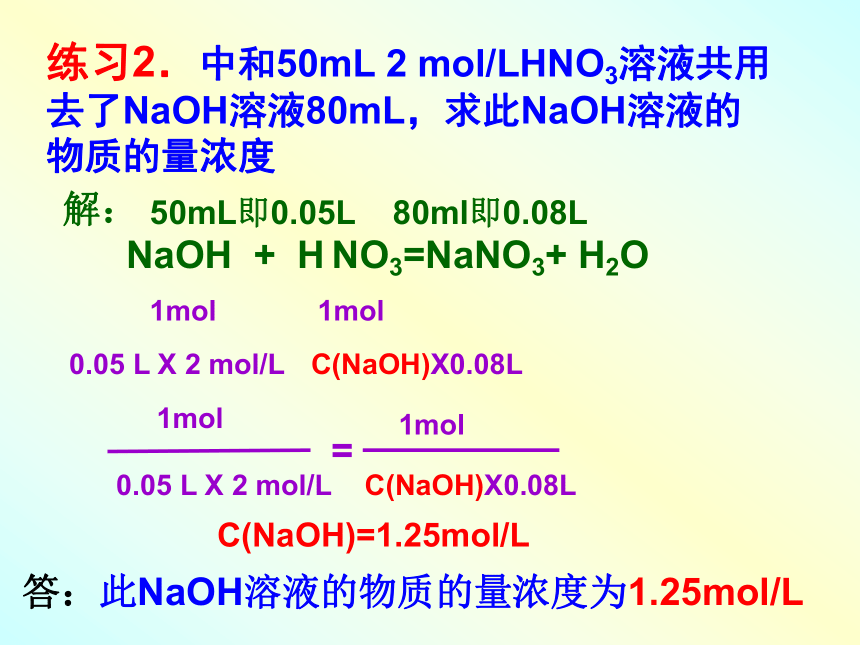
想想:能不能用来表示各反应物质间的物质量关系呢?动动脑:化学方程式代表意义?有关溶液反应的计算 练习1.中和1升0.5 mol/LNaOH溶液,需要多少升1 mol/LH2SO4溶液?2mol1mol1LX0.5 mol/L V[H2SO4(aq)]x1 mol/L2mol1mol1LX0.5 mol/L V[H2SO4(aq)]x1 mol/L=V[H2SO4(aq)]=0.25L解:2NaOH + H2SO4=Na2SO4+2H2O练习2.中和50mL 2 mol/LHNO3溶液共用
去了NaOH溶液80mL,求此NaOH溶液的
物质的量浓度解:
NaOH + H NO3=NaNO3+ H2O0.05 L X 2 mol/L 50mL即0.05L 80ml即0.08L1mol1molC(NaOH)X0.08L0.05 L X 2 mol/L 1mol1molC(NaOH)X0.08L=C(NaOH)=1.25mol/L答:此NaOH溶液的物质的量浓度为1.25mol/L(二).在物质的量浓度溶液中溶质微粒数目及浓度的计算
只要溶液体积相同,物质的量浓 度相同,所含溶质的物质的量必然相同,但不能说所含微粒数也相同。 如1mol/L的H2SO4溶液,对于溶液溶质可电离,溶液中以离子形式存在,C(H+)为2mol/L2、0.5mol/L的NaCl溶液250mL,所含的溶质的物质的量是多少?
质量是多少克?
溶质的微粒数分别是多少?1、2L 1mol/L的H2SO4溶液,含溶质的物质的量 为 mol,含H+ 个,SO42- 个。22.408x10241.204x10240.125mol7.31gN(Na+)=7.525X1022N(Cl-)=7.525X1022练习(A组) 4、 求等体积的0.5 mol /L的三种溶液
硫酸钠、硫酸镁、硫酸铝中阳离子
的个数比?阴离子的个数比?3、 0.5 mol /L的下列溶液500mL中
含NO3 - 数目最多的是:( )
NO3 - 物质的量浓度最大的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝DD2:1:21:1:3在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5mol/L、 c(K+)=1.5mol/L、
c(SO42- )=0.5mol/L。 求c(Al 3+) 依据:溶液中正负电荷总数相等设:溶液体积为1则:c(K+) + 3c(Al3+) = c(Cl-) + 2c(SO42-) c(Al3+)=1 mol/L 1.5mol/L+ 3c(Al3+)= 3.5mol/L+2X 0.5mol/L 某地酸雨经检验,除H+和OH-外,还含有
Na+、Cl-、NH4+和SO42-,其离子浓度依次
为 7.0x10-6mol/L 、3.5x10-5mol/L
2.3x10-5mol/L 、2.5x10-6mol/L,其中OH-
的浓度极小,可忽略。则酸雨中H+的物质的量
浓度为 ( ) A 7.0x10-6mol/L B 1x10-5mol/L
C 1.5x10-5mol/L D 2x10-5mol/L7.0x10-6mol/L+ 2.3x10-5mol/L+c(H+)
=3.5x10-5mol/L+ 2x 2.5x10-6mol/Lc(H+)=1x10-5mol/LB(三).溶液中溶质的质量分数与物质的量浓度的换算 1、已知物质的量浓度cB求溶质的质量分数 =m(溶质)m(溶液)=m(溶质)m(溶质)+m(溶剂)X100%X100%计算1、已知75ml2mol/LNaOH溶液的质量
为80g。计算溶液中溶质的质量分数。解:75ml=0.075L
n(NaOH)=C(NaOH) X V[NaOH(aq)]
=2mol/Lx0.075L=0.15molm(NaOH)=n(NaOH)XM (NaOH )
=0.15molx40g/mol=6gω(NaOH)=m(NaOH)m[NaOH(aq)]X100% 6g80gX100%=7.5%=计算2、物质的量浓度为12mol/L,
密度为1.32g/cm3的硝酸溶液的质量分数。ω=设:溶液的体积为1L即1000ml=57.3%12mol/LX1LX63g/mol1.32g/cm3x1000mLMBV(aq)mBC B==mBm(aq)mB=MBV(aq)CBm(aq)=ρ(aq) x V(aq) =ρ(aq) x 1000V(aq) MBV(aq)CB(g/mL或g/cm3)(mL)=1000 ρ(aq) MBCB小结V(aq)n CB=B2、已知溶质的质量分数
求物质的量浓度CB =V(aq)mBMB=V(aq)mBMB练习1、36.5%的盐酸,密度为1.19g/cm3,求其物质的量浓度? 解:设溶液的体积为1L即1000mlC(HCl )=M(HCl) x V[HCl(aq)] ρ[HCl(aq)]x V [HCl (aq)]xω(HCl)=1.19g/cm3x1000mlx 36.5%36.5g/molx1L=11.9mol/LmB=m(aq)xω=ρ(aq) x V (aq) xω CB=V(aq)MB ρ(aq)x 1000 V (aq)xω=MB 1000ρ(aq)ω CB小结练习2、98%的硫酸,密度为1.84g/cm3,求其物质的量浓度? C(H2SO4 )=M (H2SO4 ) 1000 ρ[H2SO4(aq)] ω (H2SO4 )=1000X 1.84g/mLX 98%98g/mol=18.4mol/L(四).有关两种不同浓度溶液混合的计算
C3V3 == C1V1+C2V2
(混合前后溶质的物质的量总和不变) 练习1.2 mol/L的盐酸溶液200mL和5 mol/L的盐酸溶液100mL混合,求:混合后溶液中盐酸的物质的量浓度。(设混合后溶液体积不变)
练习2.2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?(设混合后溶液体积不变) C(HCl)=3mol/LC(H+)=4mol/L随堂检测 配制500mL0.2 mol/L硝酸溶液,
需要密度为1.4g/cm3的65%的硝酸
多少毫升?
在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
工业烧碱2g,制成500mL溶液,取25mL可与0.1 mol/L盐酸20mL完全
中和,求烧碱的纯度? 6.9ml80%
(一)有关溶液反应的计算 可用来表示反应各微粒间数目关系
2NaOH + H2SO4=Na2SO4+2H2O
表示参加反应NaOH .H2SO4.Na2SO4.H2O四者之间微粒个数比为2:1:1:2
想想:能不能用来表示各反应物质间的物质量关系呢?动动脑:化学方程式代表意义?有关溶液反应的计算 练习1.中和1升0.5 mol/LNaOH溶液,需要多少升1 mol/LH2SO4溶液?2mol1mol1LX0.5 mol/L V[H2SO4(aq)]x1 mol/L2mol1mol1LX0.5 mol/L V[H2SO4(aq)]x1 mol/L=V[H2SO4(aq)]=0.25L解:2NaOH + H2SO4=Na2SO4+2H2O练习2.中和50mL 2 mol/LHNO3溶液共用
去了NaOH溶液80mL,求此NaOH溶液的
物质的量浓度解:
NaOH + H NO3=NaNO3+ H2O0.05 L X 2 mol/L 50mL即0.05L 80ml即0.08L1mol1molC(NaOH)X0.08L0.05 L X 2 mol/L 1mol1molC(NaOH)X0.08L=C(NaOH)=1.25mol/L答:此NaOH溶液的物质的量浓度为1.25mol/L(二).在物质的量浓度溶液中溶质微粒数目及浓度的计算
只要溶液体积相同,物质的量浓 度相同,所含溶质的物质的量必然相同,但不能说所含微粒数也相同。 如1mol/L的H2SO4溶液,对于溶液溶质可电离,溶液中以离子形式存在,C(H+)为2mol/L2、0.5mol/L的NaCl溶液250mL,所含的溶质的物质的量是多少?
质量是多少克?
溶质的微粒数分别是多少?1、2L 1mol/L的H2SO4溶液,含溶质的物质的量 为 mol,含H+ 个,SO42- 个。22.408x10241.204x10240.125mol7.31gN(Na+)=7.525X1022N(Cl-)=7.525X1022练习(A组) 4、 求等体积的0.5 mol /L的三种溶液
硫酸钠、硫酸镁、硫酸铝中阳离子
的个数比?阴离子的个数比?3、 0.5 mol /L的下列溶液500mL中
含NO3 - 数目最多的是:( )
NO3 - 物质的量浓度最大的是:( )
A.硝酸钾 B.硝酸钡 C.硝酸镁 D.硝酸铝DD2:1:21:1:3在含有AlCl3、KCl、K2SO4三种溶质的溶液中,已知c(Cl-)=3.5mol/L、 c(K+)=1.5mol/L、
c(SO42- )=0.5mol/L。 求c(Al 3+) 依据:溶液中正负电荷总数相等设:溶液体积为1则:c(K+) + 3c(Al3+) = c(Cl-) + 2c(SO42-) c(Al3+)=1 mol/L 1.5mol/L+ 3c(Al3+)= 3.5mol/L+2X 0.5mol/L 某地酸雨经检验,除H+和OH-外,还含有
Na+、Cl-、NH4+和SO42-,其离子浓度依次
为 7.0x10-6mol/L 、3.5x10-5mol/L
2.3x10-5mol/L 、2.5x10-6mol/L,其中OH-
的浓度极小,可忽略。则酸雨中H+的物质的量
浓度为 ( ) A 7.0x10-6mol/L B 1x10-5mol/L
C 1.5x10-5mol/L D 2x10-5mol/L7.0x10-6mol/L+ 2.3x10-5mol/L+c(H+)
=3.5x10-5mol/L+ 2x 2.5x10-6mol/Lc(H+)=1x10-5mol/LB(三).溶液中溶质的质量分数与物质的量浓度的换算 1、已知物质的量浓度cB求溶质的质量分数 =m(溶质)m(溶液)=m(溶质)m(溶质)+m(溶剂)X100%X100%计算1、已知75ml2mol/LNaOH溶液的质量
为80g。计算溶液中溶质的质量分数。解:75ml=0.075L
n(NaOH)=C(NaOH) X V[NaOH(aq)]
=2mol/Lx0.075L=0.15molm(NaOH)=n(NaOH)XM (NaOH )
=0.15molx40g/mol=6gω(NaOH)=m(NaOH)m[NaOH(aq)]X100% 6g80gX100%=7.5%=计算2、物质的量浓度为12mol/L,
密度为1.32g/cm3的硝酸溶液的质量分数。ω=设:溶液的体积为1L即1000ml=57.3%12mol/LX1LX63g/mol1.32g/cm3x1000mLMBV(aq)mBC B==mBm(aq)mB=MBV(aq)CBm(aq)=ρ(aq) x V(aq) =ρ(aq) x 1000V(aq) MBV(aq)CB(g/mL或g/cm3)(mL)=1000 ρ(aq) MBCB小结V(aq)n CB=B2、已知溶质的质量分数
求物质的量浓度CB =V(aq)mBMB=V(aq)mBMB练习1、36.5%的盐酸,密度为1.19g/cm3,求其物质的量浓度? 解:设溶液的体积为1L即1000mlC(HCl )=M(HCl) x V[HCl(aq)] ρ[HCl(aq)]x V [HCl (aq)]xω(HCl)=1.19g/cm3x1000mlx 36.5%36.5g/molx1L=11.9mol/LmB=m(aq)xω=ρ(aq) x V (aq) xω CB=V(aq)MB ρ(aq)x 1000 V (aq)xω=MB 1000ρ(aq)ω CB小结练习2、98%的硫酸,密度为1.84g/cm3,求其物质的量浓度? C(H2SO4 )=M (H2SO4 ) 1000 ρ[H2SO4(aq)] ω (H2SO4 )=1000X 1.84g/mLX 98%98g/mol=18.4mol/L(四).有关两种不同浓度溶液混合的计算
C3V3 == C1V1+C2V2
(混合前后溶质的物质的量总和不变) 练习1.2 mol/L的盐酸溶液200mL和5 mol/L的盐酸溶液100mL混合,求:混合后溶液中盐酸的物质的量浓度。(设混合后溶液体积不变)
练习2.2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?(设混合后溶液体积不变) C(HCl)=3mol/LC(H+)=4mol/L随堂检测 配制500mL0.2 mol/L硝酸溶液,
需要密度为1.4g/cm3的65%的硝酸
多少毫升?
在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
工业烧碱2g,制成500mL溶液,取25mL可与0.1 mol/L盐酸20mL完全
中和,求烧碱的纯度? 6.9ml80%
