高三化学考点复习之基本概念
图片预览








文档简介
课件24张PPT。 理智的分析自己
充分的利用有限的时间
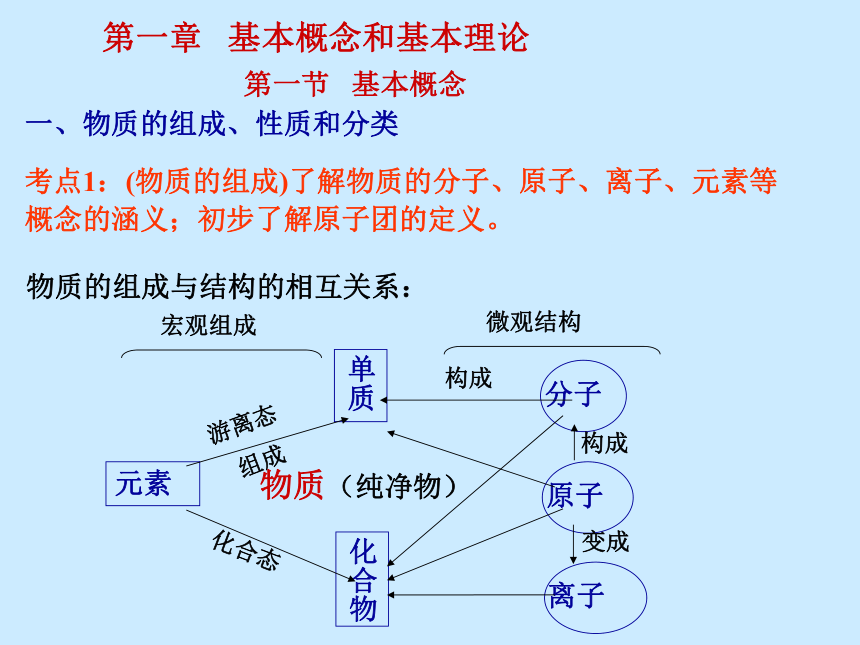
激情的面对高考怎样面对高考 ?4、“有效”的量的积累才能达到质变------做一题通一题。3、有形的练习代替不了无形的记忆理解。1、放低姿态、重视课堂、跟老师走,必须记笔记。2、重视知识的内化。怎样面对高三化学复习 ?5、作业如考试。 态度决定一切 细节决定成败自信 + 有序的工作 = 成功天下事,有难易乎?……第一章 基本概念和基本理论第一节 基本概念一、物质的组成、性质和分类考点1:(物质的组成)了解物质的分子、原子、离子、元素等
概念的涵义;初步了解原子团的定义。物质(纯净物)物质的组成与结构的相互关系:元素讨论1:下列说法正确的是( )
A、水由水分子构成
B、水分子由氢元素和氧元素组成
C、每个水分子中含有一个氢分子和一个氧原子
D、水中氢元素与氧元素的个数比为2∶11、元素:具有相同核电荷数的同一类原子的总称。注意:元素是宏观概念,只论种类不论大小、个数;
不能说微观是由宏观构成的;
元素有游离态和化合态两种存在形态。2、分子:保持物质化学性质的一种微粒。AC由分子构成的物质:分子分子晶体
(s)多数非金属单质讨论2:下列化学式能真实表示物质
在通常状态下的分子组成的是( )
A、CsCl B、SiO2
C、SO2 D、S3、原子:化学变化中的最小微粒。注意:由比原子小的粒子引起的变化不属化学变化。
(例:核反应)由原子构成的物质:原子原子晶体金刚石、晶体硅等SiO2、SiC等4、离子:带电的原子或原子团。有简单离子(单核离子)和复杂离子(多核离子)。由离子构成的物质:离子离子晶体注意:分子、原子、离子属微观粒子,既论种类又论大小、个数、
质量。粒子间有间隔,有一定作用力,并在不停地运动。5、原子团:多个原子结成的集团。讨论4:下列说法正确的是( )
A、氢离子是一个质子
B、含有阳离子的物质中一定含有阴离子
C、分子是不显电性的一种微粒,原子是构成分子的一种微粒,
离子是构成物质的一种微粒
D、含有金属元素的离子都是阳离子讨论5:地壳中含量居第一、二位的两种元素组成的物质由( )
A、原子构成 B、分子构成 C、离子构成 D、元素组成BC(AD)注意:作为整体参与化学反应,不能拆开。
既包括某些阴阳离子,也包括不带电的基团。..考点2:理解混合物和纯净物、单质和化合物、金属和非金属的概念物质—酸、碱、盐、氧化物、氢化物—烃、烃的衍生物、糖、氨基酸、
蛋白质、合成高分子化合物等1、纯净物:由一种物质组成的物质。混合物:由两种或多种物质混合而成的物质。注意:A 、纯净物具有固定的组成,具有固定的性质。
混合物绝大多数不具有固定的组成,不具有固定的性质。B、由同素异形体组成的物质为混合物,如金刚石和石墨混合。C、典型的混合物和纯净物有:
溶液、胶体、空气、石油、煤、漂白粉、碱石灰、王水、
高分子化合物、氯水(久置,新置)、氨水、水煤气、黑火药
重晶石、胆矾(蓝矾)、明矾、绿矾、苛性钠、苛性钾、氯仿
氟里昂、蚁酸、蚁醛、磁铁矿(磁性氧化铁)、赤铁矿、
硫铁矿(黄铁矿)、玻璃等讨论:1、下列物质中属于纯净化合物的是
A.福尔马林 B.干冰 C.凡士林 D.石墨
E.碱石灰 F.波尔多液 G. 硝化甘油 H.淀粉
I.磁铁矿 J.小苏打 K.液氨 L.草木灰
M.重钙 N.水银 O. 碳铵 P.电石
Q.明矾 R.沼气2.下列各组物质前一种是混合物,后二种是纯净物的是 A.蓝矾、玻璃、无色的刚玉
B.汽油、液氯、无色的水晶 C.石蜡、纯盐酸、软水
D.干冰、铝热剂、铁触煤 2、单质和化合物同种元素组成的纯净物不同种元素组成的纯净物分子由同种元素的原子构成 分子由不同种元素的原子构成游离态化合态 3、金属是由金属元素组成,
具有特殊光泽富有延展性及导电导热性的一类物质。
常温下液态金属只有汞,液态非金属只有溴。考点3:了解同素异形体的概念同素异形体:由同种元素形成的几种性质不同的单质,叫做这种
元素的同素异形体。常见的同素异形体:注意:同素异形体之间的转化属化学变化,但并不属氧化还原
反应,故有单质参加或生成的变化不一定是氧化还原反应。讨论:1、碳的三种同素异形体:金刚石、足球烯(C60)、石墨,
其中足球烯是分子晶体,据此推测下列说法中正确的是( )
A.足球烯可以发生加成反应
B.金刚石、足球烯、石墨和氧反应的最终产物不同
C.足球烯、石墨均可作生产耐高温润滑剂的原料
D.金刚石、石墨、足球烯都是碳的共价化合物A(差异主要体现在物理性质上.)讨论2、下列物质互为同素异形体的是 ( ) A.16O、17O、18O
B.金刚石、石墨、C60 C.HCI、DCl、TCl
D.CH4、C2H6、C3H8 E. H2 D2 T2考点4:理解物理变化与化学变化的区别和联系没有新物质生成有新物质生成没有原子(或原子团)
的重新组合,即没有
破坏化学键原子(或原子团)的
重新组合,即旧键
的断裂新键的形成化学变化过程中一定同时发生物理变化讨论:分馏、干馏、风化、裂化、渗析、盐析、电解、分别
属于什么变化?常见物理变化:物质的三态变化、金属导电、蒸馏、分馏、挥发、
蒸发、升华、渗析、盐析、吸附、焰色反应、潮解、粉碎等常见化学变化:风化、硫化、老化、油脂硬化、钝化、硝化、炭化、
裂化、裂解、干馏、燃烧、金属腐蚀、电解、电镀、变性等讨论1:下列变化一定属于化学变化的是( )
①风化 ②变色 ③燃烧 ④爆炸 ⑤氧化
⑥分馏 ⑦ NO2气体冷却后颜色变浅
A、 ①②③④ B、 ③④⑤⑦
C、 ①③⑤⑦ D、 ①③④⑦讨论2:下列变化不属于氧化还原反应的是( )
A、Na2O2?O2 B、AlO ? Al3+
C、NH ?NH3 D、MnO ? MnOCBC讨论3 挥发性与不稳定性分别属于哪种类型的性质?物理性质 颜色、状态、气味、密度、溶解性、挥发性、熔沸点等化学性质 氧化性、还原性、不稳定性、稳定性等讨论4 下列各组物质不易用物理性质区别的是( )
A、苯和四氯化碳 B、酒精和汽油
C、氯化铵和硝酸铵晶体 D、碘和高锰酸钾固体C讨论5 下列变化属于物理变化的是( )
A、氧气在放电条件下变O3
B、漂白的草帽久置后变黄
C、氢氧化铁胶体加硫酸镁产生沉淀
D、碘遇淀粉变蓝
E、从重油中提取凡士林
F、浓硫酸可用做干燥剂考点5:理解酸、碱、盐、氧化物的概念及其相互联系1、酸:电离时所生成的阳离子全部是氢离子的化合物。注意:酸式盐既可电离出H+,还可电离出其它阳离子; 常见酸式酸根中
HSO4-、HSO3-、H2PO4-显酸性,其余显碱性。(元素非金属性越强,其最高价氧化物
对应水化物的酸性越强。)(练习册P3)讨论:已知亚磷酸(分子式为H3PO3)与NaOH溶液反应能形成两种盐。据此可知:H3PO3为___元酸,结构式为_________,生成的正盐化学式为______,酸酐的分子式为_______。酸的五条通性:(1)使指示剂变色(2)非强氧化性酸与(H前)金属反应产生氢气(3)与碱反应(4)与碱性(两性)氧化物反应(5)与某些盐反应思考:硝酸与氢氧化亚铁的反应产物是什么?较强酸与较弱酸的正盐反应生成新酸和新盐;
不挥发性酸与挥发性酸的盐反应制挥发性酸;
氧化性酸与具有还原性的盐发生氧化还原反应;
还原性酸与具有氧化性的盐发生氧化还原反应;
强酸与弱酸的酸式盐反应制弱酸或弱酸酐;
弱酸与强酸盐的反应;
强酸与弱酸的碱式盐反应。另:不稳定性酸的分解:HClO H2SO3 H2CO3 HNO3 HI H2S2、碱:电离时所生成的阴离子全部是氢氧根离子的化合物。注意:碱式盐即可电离出OH-,还可电离出其它阴离子。(难溶性碱一般受热易分解,
金属越不活泼,其对应碱分解程度越大。)碱的四条通性:(1)使指示剂变色(2)与酸反应(3)与酸性(两性)氧化物反应(4)与某些盐反应强碱可与部分单质(Cl2、Br2、I2、S、Si、Al等)反应。依OH—的数目分一元碱
二元碱
三元碱生成新盐和新碱
生成两种新盐
与酸式盐的反应两性氢氧化物:既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氢氧化物。常见Al(OH)3。讨论:
既能与盐酸反应,又能与NaOH溶液反应的物质类别常见有哪些?具有两性的金属、两性氧化物、两性氢氧化物、弱酸酸式盐、
弱酸铵盐、氨基酸、蛋白质3、盐:由金属离子(包括NH4+)和酸根离子组成的化合物。注意:金属氮化物(Na3N)、金属氢化物(NaH)不属盐类。:酸跟碱完全中和的产物。:酸中的氢部分被中和的产物。:碱中的氢氧根离子部分被中和的产物。:电离时有一种酸根离子和两种或两种以上金属离子的盐:电离时有络离子生成的盐。 另:特殊二氧化硅、二氧化硫等十种成盐方式:讨论:受热分解的盐有哪些?硝酸盐、铵盐、碳酸盐、碳酸氢盐,银盐见光易分解4、氧化物 分子中由氧元素和另外一种元素组成的化合物。与碱反应生成盐和水
的氧化物 b.属于酸
酐,但酸酐并不都是氧化
物,如乙酸酐,酸酐为酸
的偶羟基去水产物。a.不一定都是非金属氧化
物,如Mn2O7。a.多数溶于水且与水化合
成酸b.同定义c. + 碱性氧化物?盐与酸反应生成盐和
水的氧化物一定是金属氧化物,
但金属氧化物不一
定是碱性氧化物。a.少数溶于水且与水
化合成碱b.同定义c. + 酸性氧化物?盐既能与酸反应
生成盐和水,
又能与碱反应
生成盐和水的
氧化物。如:Al2O3、
ZnO等a.难溶于水b.同定义讨论1:下列说法正确的是( )
A.Na2O2是碱性氧化物
B.与水反应生成酸的氧化物一定是该酸的酸酐
C.酸性氧化物均可与碱溶液起反应
D.某氧化物既能与酸反应,又能与碱反应故它一定属于两性氧化物讨论2 练习册P10 第15题C
充分的利用有限的时间
激情的面对高考怎样面对高考 ?4、“有效”的量的积累才能达到质变------做一题通一题。3、有形的练习代替不了无形的记忆理解。1、放低姿态、重视课堂、跟老师走,必须记笔记。2、重视知识的内化。怎样面对高三化学复习 ?5、作业如考试。 态度决定一切 细节决定成败自信 + 有序的工作 = 成功天下事,有难易乎?……第一章 基本概念和基本理论第一节 基本概念一、物质的组成、性质和分类考点1:(物质的组成)了解物质的分子、原子、离子、元素等
概念的涵义;初步了解原子团的定义。物质(纯净物)物质的组成与结构的相互关系:元素讨论1:下列说法正确的是( )
A、水由水分子构成
B、水分子由氢元素和氧元素组成
C、每个水分子中含有一个氢分子和一个氧原子
D、水中氢元素与氧元素的个数比为2∶11、元素:具有相同核电荷数的同一类原子的总称。注意:元素是宏观概念,只论种类不论大小、个数;
不能说微观是由宏观构成的;
元素有游离态和化合态两种存在形态。2、分子:保持物质化学性质的一种微粒。AC由分子构成的物质:分子分子晶体
(s)多数非金属单质讨论2:下列化学式能真实表示物质
在通常状态下的分子组成的是( )
A、CsCl B、SiO2
C、SO2 D、S3、原子:化学变化中的最小微粒。注意:由比原子小的粒子引起的变化不属化学变化。
(例:核反应)由原子构成的物质:原子原子晶体金刚石、晶体硅等SiO2、SiC等4、离子:带电的原子或原子团。有简单离子(单核离子)和复杂离子(多核离子)。由离子构成的物质:离子离子晶体注意:分子、原子、离子属微观粒子,既论种类又论大小、个数、
质量。粒子间有间隔,有一定作用力,并在不停地运动。5、原子团:多个原子结成的集团。讨论4:下列说法正确的是( )
A、氢离子是一个质子
B、含有阳离子的物质中一定含有阴离子
C、分子是不显电性的一种微粒,原子是构成分子的一种微粒,
离子是构成物质的一种微粒
D、含有金属元素的离子都是阳离子讨论5:地壳中含量居第一、二位的两种元素组成的物质由( )
A、原子构成 B、分子构成 C、离子构成 D、元素组成BC(AD)注意:作为整体参与化学反应,不能拆开。
既包括某些阴阳离子,也包括不带电的基团。..考点2:理解混合物和纯净物、单质和化合物、金属和非金属的概念物质—酸、碱、盐、氧化物、氢化物—烃、烃的衍生物、糖、氨基酸、
蛋白质、合成高分子化合物等1、纯净物:由一种物质组成的物质。混合物:由两种或多种物质混合而成的物质。注意:A 、纯净物具有固定的组成,具有固定的性质。
混合物绝大多数不具有固定的组成,不具有固定的性质。B、由同素异形体组成的物质为混合物,如金刚石和石墨混合。C、典型的混合物和纯净物有:
溶液、胶体、空气、石油、煤、漂白粉、碱石灰、王水、
高分子化合物、氯水(久置,新置)、氨水、水煤气、黑火药
重晶石、胆矾(蓝矾)、明矾、绿矾、苛性钠、苛性钾、氯仿
氟里昂、蚁酸、蚁醛、磁铁矿(磁性氧化铁)、赤铁矿、
硫铁矿(黄铁矿)、玻璃等讨论:1、下列物质中属于纯净化合物的是
A.福尔马林 B.干冰 C.凡士林 D.石墨
E.碱石灰 F.波尔多液 G. 硝化甘油 H.淀粉
I.磁铁矿 J.小苏打 K.液氨 L.草木灰
M.重钙 N.水银 O. 碳铵 P.电石
Q.明矾 R.沼气2.下列各组物质前一种是混合物,后二种是纯净物的是 A.蓝矾、玻璃、无色的刚玉
B.汽油、液氯、无色的水晶 C.石蜡、纯盐酸、软水
D.干冰、铝热剂、铁触煤 2、单质和化合物同种元素组成的纯净物不同种元素组成的纯净物分子由同种元素的原子构成 分子由不同种元素的原子构成游离态化合态 3、金属是由金属元素组成,
具有特殊光泽富有延展性及导电导热性的一类物质。
常温下液态金属只有汞,液态非金属只有溴。考点3:了解同素异形体的概念同素异形体:由同种元素形成的几种性质不同的单质,叫做这种
元素的同素异形体。常见的同素异形体:注意:同素异形体之间的转化属化学变化,但并不属氧化还原
反应,故有单质参加或生成的变化不一定是氧化还原反应。讨论:1、碳的三种同素异形体:金刚石、足球烯(C60)、石墨,
其中足球烯是分子晶体,据此推测下列说法中正确的是( )
A.足球烯可以发生加成反应
B.金刚石、足球烯、石墨和氧反应的最终产物不同
C.足球烯、石墨均可作生产耐高温润滑剂的原料
D.金刚石、石墨、足球烯都是碳的共价化合物A(差异主要体现在物理性质上.)讨论2、下列物质互为同素异形体的是 ( ) A.16O、17O、18O
B.金刚石、石墨、C60 C.HCI、DCl、TCl
D.CH4、C2H6、C3H8 E. H2 D2 T2考点4:理解物理变化与化学变化的区别和联系没有新物质生成有新物质生成没有原子(或原子团)
的重新组合,即没有
破坏化学键原子(或原子团)的
重新组合,即旧键
的断裂新键的形成化学变化过程中一定同时发生物理变化讨论:分馏、干馏、风化、裂化、渗析、盐析、电解、分别
属于什么变化?常见物理变化:物质的三态变化、金属导电、蒸馏、分馏、挥发、
蒸发、升华、渗析、盐析、吸附、焰色反应、潮解、粉碎等常见化学变化:风化、硫化、老化、油脂硬化、钝化、硝化、炭化、
裂化、裂解、干馏、燃烧、金属腐蚀、电解、电镀、变性等讨论1:下列变化一定属于化学变化的是( )
①风化 ②变色 ③燃烧 ④爆炸 ⑤氧化
⑥分馏 ⑦ NO2气体冷却后颜色变浅
A、 ①②③④ B、 ③④⑤⑦
C、 ①③⑤⑦ D、 ①③④⑦讨论2:下列变化不属于氧化还原反应的是( )
A、Na2O2?O2 B、AlO ? Al3+
C、NH ?NH3 D、MnO ? MnOCBC讨论3 挥发性与不稳定性分别属于哪种类型的性质?物理性质 颜色、状态、气味、密度、溶解性、挥发性、熔沸点等化学性质 氧化性、还原性、不稳定性、稳定性等讨论4 下列各组物质不易用物理性质区别的是( )
A、苯和四氯化碳 B、酒精和汽油
C、氯化铵和硝酸铵晶体 D、碘和高锰酸钾固体C讨论5 下列变化属于物理变化的是( )
A、氧气在放电条件下变O3
B、漂白的草帽久置后变黄
C、氢氧化铁胶体加硫酸镁产生沉淀
D、碘遇淀粉变蓝
E、从重油中提取凡士林
F、浓硫酸可用做干燥剂考点5:理解酸、碱、盐、氧化物的概念及其相互联系1、酸:电离时所生成的阳离子全部是氢离子的化合物。注意:酸式盐既可电离出H+,还可电离出其它阳离子; 常见酸式酸根中
HSO4-、HSO3-、H2PO4-显酸性,其余显碱性。(元素非金属性越强,其最高价氧化物
对应水化物的酸性越强。)(练习册P3)讨论:已知亚磷酸(分子式为H3PO3)与NaOH溶液反应能形成两种盐。据此可知:H3PO3为___元酸,结构式为_________,生成的正盐化学式为______,酸酐的分子式为_______。酸的五条通性:(1)使指示剂变色(2)非强氧化性酸与(H前)金属反应产生氢气(3)与碱反应(4)与碱性(两性)氧化物反应(5)与某些盐反应思考:硝酸与氢氧化亚铁的反应产物是什么?较强酸与较弱酸的正盐反应生成新酸和新盐;
不挥发性酸与挥发性酸的盐反应制挥发性酸;
氧化性酸与具有还原性的盐发生氧化还原反应;
还原性酸与具有氧化性的盐发生氧化还原反应;
强酸与弱酸的酸式盐反应制弱酸或弱酸酐;
弱酸与强酸盐的反应;
强酸与弱酸的碱式盐反应。另:不稳定性酸的分解:HClO H2SO3 H2CO3 HNO3 HI H2S2、碱:电离时所生成的阴离子全部是氢氧根离子的化合物。注意:碱式盐即可电离出OH-,还可电离出其它阴离子。(难溶性碱一般受热易分解,
金属越不活泼,其对应碱分解程度越大。)碱的四条通性:(1)使指示剂变色(2)与酸反应(3)与酸性(两性)氧化物反应(4)与某些盐反应强碱可与部分单质(Cl2、Br2、I2、S、Si、Al等)反应。依OH—的数目分一元碱
二元碱
三元碱生成新盐和新碱
生成两种新盐
与酸式盐的反应两性氢氧化物:既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氢氧化物。常见Al(OH)3。讨论:
既能与盐酸反应,又能与NaOH溶液反应的物质类别常见有哪些?具有两性的金属、两性氧化物、两性氢氧化物、弱酸酸式盐、
弱酸铵盐、氨基酸、蛋白质3、盐:由金属离子(包括NH4+)和酸根离子组成的化合物。注意:金属氮化物(Na3N)、金属氢化物(NaH)不属盐类。:酸跟碱完全中和的产物。:酸中的氢部分被中和的产物。:碱中的氢氧根离子部分被中和的产物。:电离时有一种酸根离子和两种或两种以上金属离子的盐:电离时有络离子生成的盐。 另:特殊二氧化硅、二氧化硫等十种成盐方式:讨论:受热分解的盐有哪些?硝酸盐、铵盐、碳酸盐、碳酸氢盐,银盐见光易分解4、氧化物 分子中由氧元素和另外一种元素组成的化合物。与碱反应生成盐和水
的氧化物 b.属于酸
酐,但酸酐并不都是氧化
物,如乙酸酐,酸酐为酸
的偶羟基去水产物。a.不一定都是非金属氧化
物,如Mn2O7。a.多数溶于水且与水化合
成酸b.同定义c. + 碱性氧化物?盐与酸反应生成盐和
水的氧化物一定是金属氧化物,
但金属氧化物不一
定是碱性氧化物。a.少数溶于水且与水
化合成碱b.同定义c. + 酸性氧化物?盐既能与酸反应
生成盐和水,
又能与碱反应
生成盐和水的
氧化物。如:Al2O3、
ZnO等a.难溶于水b.同定义讨论1:下列说法正确的是( )
A.Na2O2是碱性氧化物
B.与水反应生成酸的氧化物一定是该酸的酸酐
C.酸性氧化物均可与碱溶液起反应
D.某氧化物既能与酸反应,又能与碱反应故它一定属于两性氧化物讨论2 练习册P10 第15题C
同课章节目录
